苦参治疗2019新型冠状病毒感染合并心肌炎的网络药理学分析
2021-07-14杨晓倩秦莉张艺文汪汉
杨晓倩 秦莉 张艺文 汪汉
(西南交通大学医学院 西南交通大学附属医院 成都市第三人民医院心内科,四川 成都 610031)
2019新型冠状病毒(2019-nCoV)是一种比严重急性呼吸综合征(SARS)冠状病毒传播性更强的新型β冠状病毒,其基因序列与SARS具有很高的同源性,且都会导致严重的呼吸道疾病[1-2]。2019-nCoV感染的具有独特的流行病学特征的新型冠状病毒肺炎(COVID-19)人数远超SARS,但病死率比SARS低得多,其临床症状主要表现为发热、乏力和干咳,少数患者有咽痛、腹泻和恶心等症状[1-2]。通过对临床病例报告的分析发现,2019-nCoV除感染肺部外,还会对心血管系统产生影响,有临床病例显示,无心血管系统疾病的COVID-19患者在疾病发展过程中出现心肌受损[3-4]。有学者认为2019-nCoV可能与SARS-CoV一样,能与在心血管系统中广泛表达的血管紧张素转换酶Ⅱ受体结合直接感染心肌细胞,造成心肌损伤[4]。研究发现,2019-nCoV感染患者体内的Th1和Th2细胞的反应均增强,使体内炎性细胞因子释放增多,免疫系统激活[4]。不论是病毒直接感染心肌细胞造成的心肌受损,还是由病毒引起的全身性炎症风暴和免疫系统紊乱造成的心肌受损,都可能引起心肌细胞炎症反应,继而诱发病毒性心肌炎(viral myocarditis,VMC),其主要临床症状为发热、恶心、呕吐、心慌和胸痛等,严重者可能发生休克、心律失常、心力衰竭,甚至猝死,要及早治疗[5]。
中国作为中医药大国,对病毒所致疾病的治疗有相当丰富的经验。在中医看来,此次2019-nCoV所致疫情的重要特征为“湿”邪,故可称为“湿毒疫”,其病位在肺,但可累及营血,逆传心包,气阴两虚,对于累及心包的重症患者,应以清热、化痰、活血、祛瘀和利水等为主要治疗方法;并且中医对VMC的看法是“以外感肺卫之邪,肺温热之毒,乘之入心而致病”,瘀和痰既是其病理产物又是致病因素,应祛痰化瘀[6-8]。苦参是豆科植物苦参的根,在临床上具有清热燥湿、抗炎消炎、平喘祛痰和利尿利水等作用,对2019-nCoV感染合并VMC(2019-nCoV心肌炎)可能是有益的。并且已有研究证明,苦参成分中的苦参碱和槐定碱对VMC具有抗炎、抗病毒和抗心肌细胞凋亡等作用[9]。为了阐明苦参对2019-nCoV心肌炎的有益作用,现通过网络药理学的研究方法,在分子水平上对其可能的有效成分和作用机制进行全面的研究[10]。
1 材料和方法
1.1 苦参成分和靶点的预测
在中药系统药理数据库和分析平台(TCMSP)中对苦参进行检索,得到苦参的活性成分,再以生物利用度(OB)≥30%和类药性(DL)≥0.18对活性成分进行筛选,得到候选化合物,并查找候选化合物对应的靶点[11]。在UnitProt数据库中以“人源”为限定标准,将预测靶点的蛋白名转换成官方基因名,以便于后面的分析。
1.2 2019-nCoV心肌炎的靶点预测
在GeneCards数据库和OMIM数据库中分别检索“novel coronavirus”(新型冠状病毒)和“myocarditis”(心肌炎),得到2019-nCoV和心肌炎各自的靶点,然后将它们进行取交集,得到共同靶点,即2019-nCoV心肌炎的潜在靶点。
1.3 “药物-活性成分-疾病-靶点”的网络构建
利用R软件中的“VennDiagram”程序包对苦参治疗2019-nCoV心肌炎的作用靶点进行预测,再通过预测到的靶点对上述得到的候选化合物进行筛选,得到与靶点相关的化合物。将作用靶点及其相关化合物导入Cytoscape3.7.2软件中,以药物、活性成分、疾病和靶点为节点,节点之间的连线为边,构建“药物-活性成分-疾病-靶点”网络。
1.4 蛋白互作网络构建及关键靶点筛选
通过String数据库,对药物作用于疾病的靶蛋白进行蛋白质相互作用的网络分析。限定蛋白种类为“Homo sapiens”(人源),设置最低蛋白互作得分为0.4,其余参数保持默认设置,以靶蛋白为节点,节点之间以边相连接。将得到的蛋白互作网络中,各靶蛋白所连接的节点数目进行排序,以连接节点数目排名前10的靶蛋白作为关键靶点。连接节点越多可认为在该网络中越关键,越有可能是药物作用于疾病的关键药效靶点。
1.5 基因本体及通路富集分析
利用R软件中的“clusterProfiler”安装包,对苦参作用于2019-nCoV心肌炎的作用靶点进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)代谢通路分析,得到苦参治疗2019-nCoV心肌炎可能涉及的生物学功能和通路。GO分析中通过分子功能、生物过程和细胞组分三个模块对靶点进行注释,设定阈值为P<0.05,P值大小表示富集显著性,P值越小,富集越显著,可认为P<0.05的所有条目是重要生物学功能,并根据P值大小进行排序,列出显著富集的前20个生物学功能的基本信息。与GO分析一样,选取KEGG分析得到的所有P<0.05的通路,用显著富集的前20条通路,绘制气泡图,图中节点的大小表示富集在该通路的基因数目,节点的颜色表示P值大小,节点越红越大说明该通路越重要。
2 结果
2.1 药物和疾病的相关靶点
将TCMSP中检索到的活性成分及其相关靶点,经筛选、整合和去重后,最终得到活性成分23个,相关靶点177个。将GeneCards数据库和OMIM数据库检索到的疾病靶点整合和去重后,得到2019-nCoV相关靶点348个,其中OMIM数据库未单独收集心肌炎的相关靶点,改成“myocardial”(心肌)后重新检索,最终得到心肌炎相关靶点987个,二者取交集后,得到共同靶点139个,即2019-nCoV心肌炎的相关靶点。
2.2 “药物-活性成分-疾病-靶点”网络
在R软件中导入上述得到的苦参相关靶点和2019-nCoV心肌炎相关靶点,运行“VennDiagram”程序包,得到交集靶点34个,即苦参治疗2019-nCoV心肌炎的潜在靶点,进一步的筛选确定了苦参发挥抗2019-nCoV心肌炎的14个主要活性成分(见表 1)。再将这34个靶点及其相关的14个活性成分导入Cytoscape3.7.2软件,得到“药物-活性成分-疾病-靶点”网络(见图1)。其中,黄色节点代表药物,红色节点代表疾病,蓝色节点代表成分,绿色节点代表靶点基因,各节点之间以边相连。通过这个网络,可知苦参主要是通过哪些成分以及这些成分是通过调控哪些靶点来产生对2019-nCoV心肌炎的治疗作用。

表1 苦参抗2019-nCoV心肌炎的活性成分
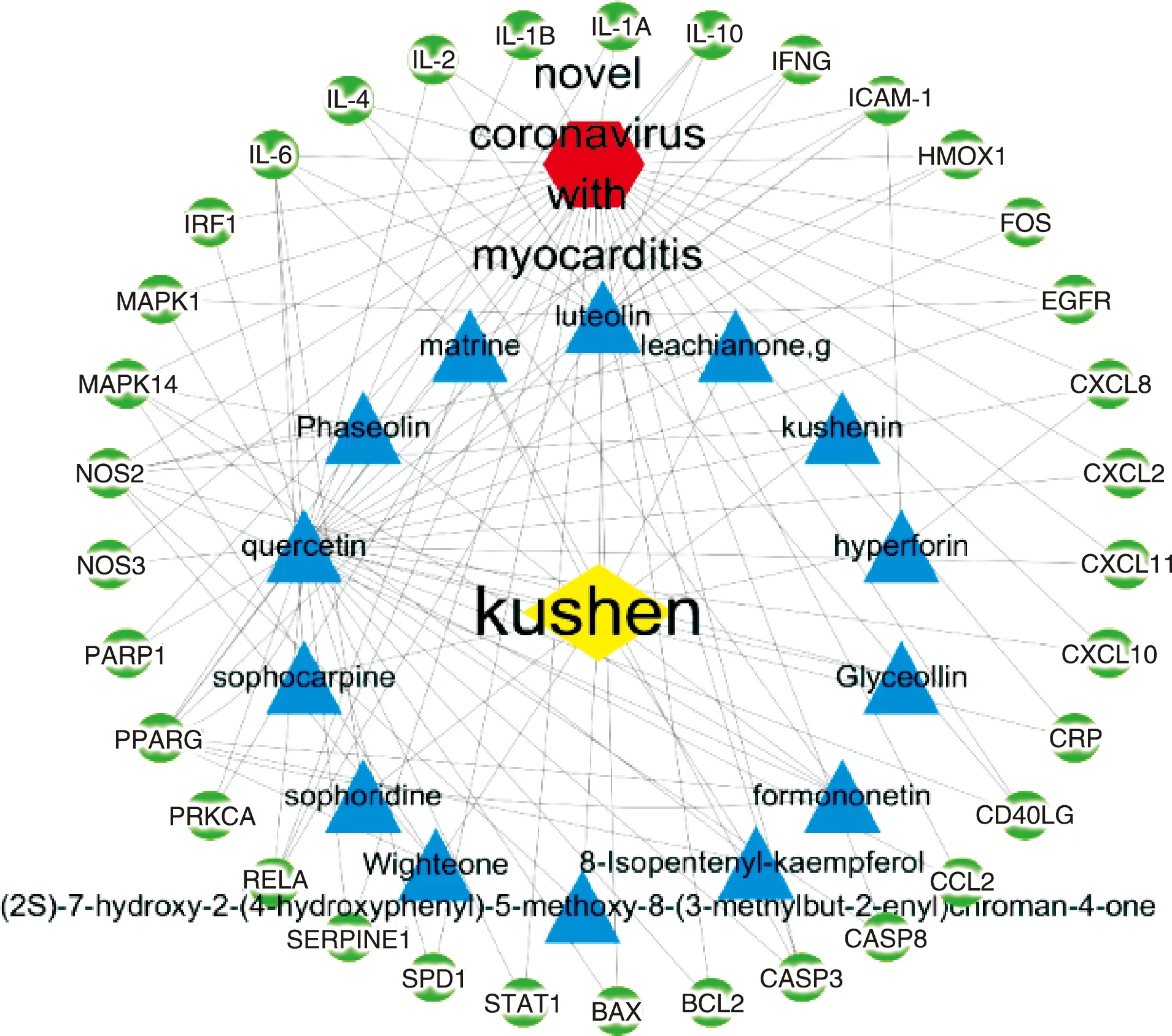
图1 药物-活性成分-疾病-靶点网络图注:黄色节点:苦参;红色节点:2019-nCoV心肌炎;蓝色节点:苦参的有效活性成分;绿色节点:苦参和2019-nCoV心肌炎的共同靶点。
2.3 蛋白互作网络及关键靶点
在String数据库中对上述得到的34个作用靶点进行蛋白互作网络分析,结果(见图2),图中显示出34个节点和367条边。节点代表靶基因,不同颜色的边代表不同的相互作用证据,两靶点之间的边越多,越能证明其具有相关性。利用R软件对各靶点连接的节点数目进行排序,得到排名前10的关键靶点(见图3),其中白介素(IL)-6连接了31个节点,是连接节点最多的靶点。各靶点连接节点越多,可认为其在该网络中越重要,越有可能是苦参治疗2019-nCoV心肌炎的主要药效靶点。

图2 作用靶点的蛋白互作网络图注:节点:靶点蛋白;不同颜色的连线代表不同的互作关系的证据。
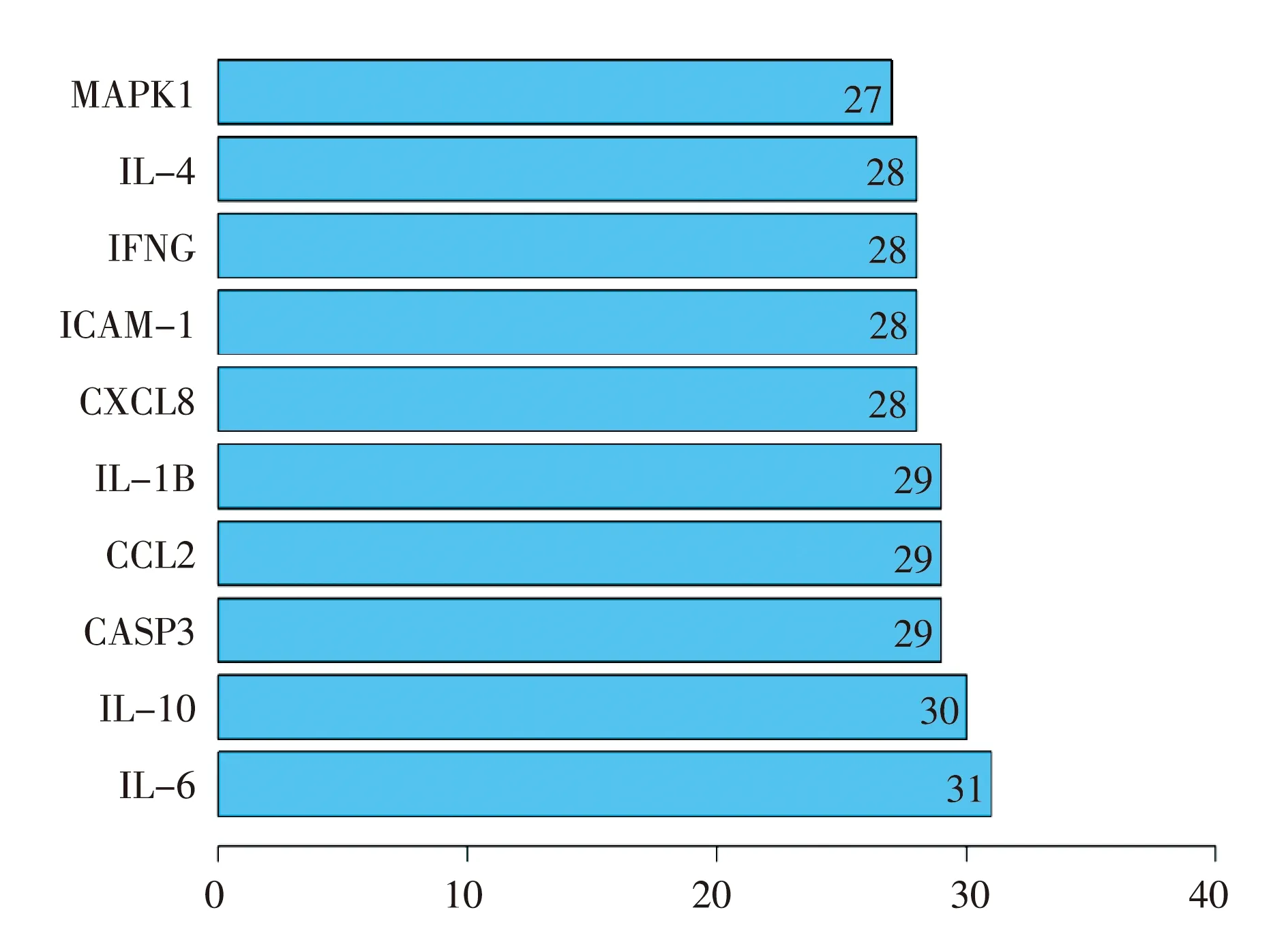
图3 关键靶点
2.4 靶点的GO分析和KEGG分析
GO分析结果显示共富集到63个与作用靶点相关的功能条目,以P值排序,前20个生物学功能见表2。该结果显示,这些作用靶点主要涉及的生物学功能有细胞因子受体结合、细胞因子活性、受体配体活性、趋化因子受体结合、趋化因子活性、磷酸酶结合、生长因子受体结合和蛋白磷酸酶结合等。由此得出,苦参对2019-nCoV心肌炎的治疗作用参与了多种生物学进程。KEGG分析得到P<0.05的通路135条,以P值排序,将前20条通路进行可视化分析结果(见图4)。该结果表明,苦参治疗2019-nCoV心肌炎的相关靶点主要参与IL-17、肿瘤坏死因子(tumor necrosis factor,TNF)、Toll样受体和缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)等信号通路,涉及其他通路有糖尿病并发症中的AGE-RAGE信号通路、甲型流感通路、恰加斯病(美洲锥虫病)通路、百日咳通路和结核通路等,这表明苦参可通过不同的代谢通路,相互协调、相互合作来发挥治疗2019-nCoV心肌炎的作用。
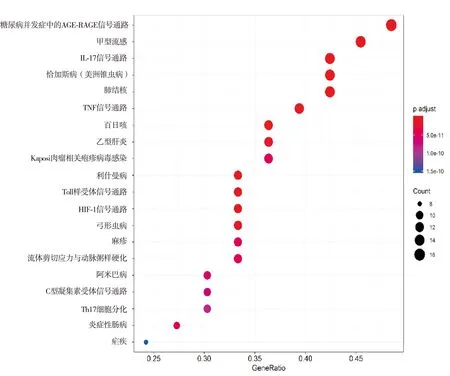
图4 苦参治疗2019-nCoV心肌炎的主要生物学通路(前20条)
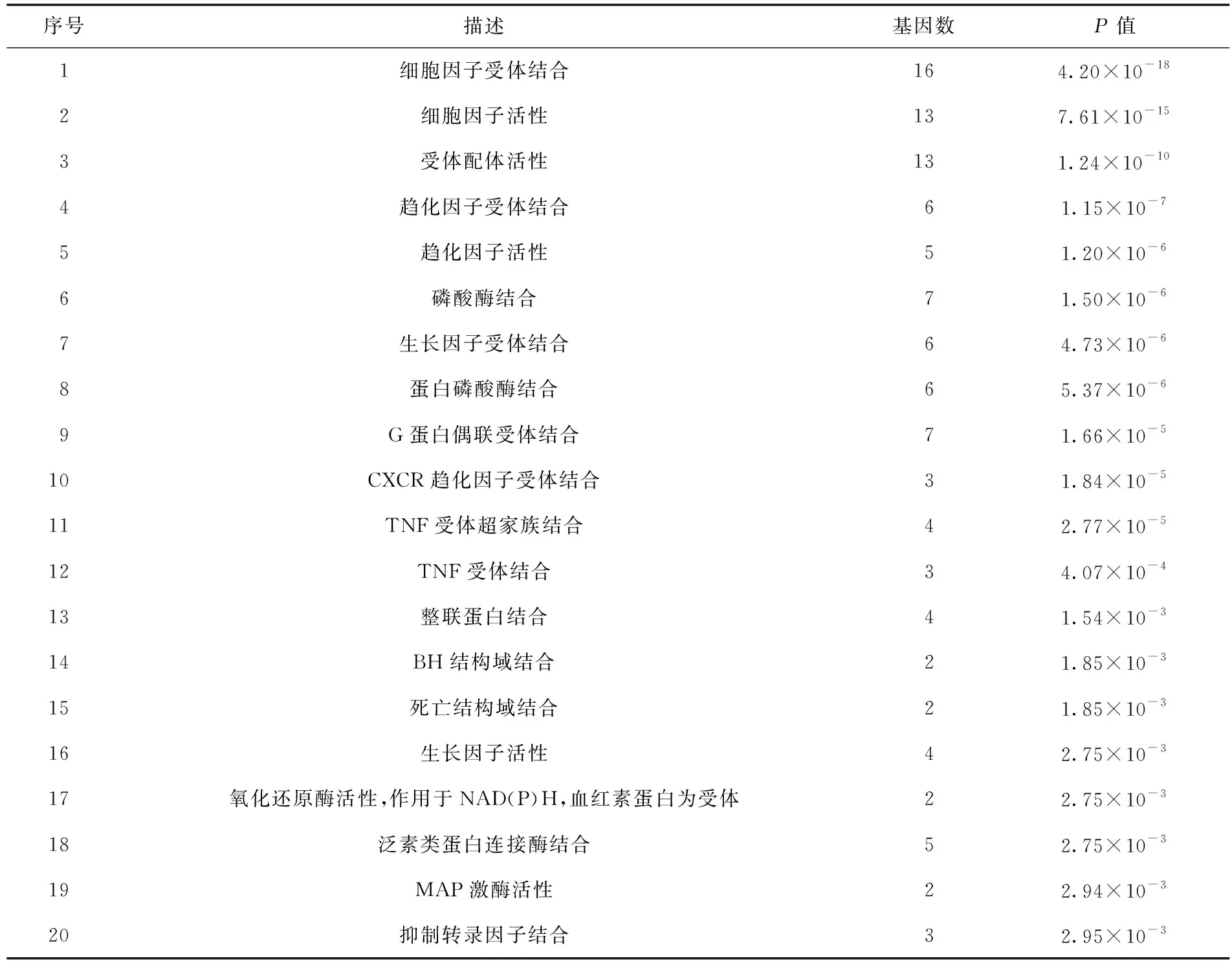
表2 苦参治疗2019-nCoV心肌炎的主要生物学功能(前20个)
3 讨论
COVID-19是感染2019-nCoV所致的主要疾病,属于呼吸系统疾病。呼吸系统疾病与炎症反应密切相关,此次2019-nCoV所导致的体内炎症风暴可能波及心血管系统,造成心肌损伤,继而导致心肌炎[3]。这与中医的整体观相契合,即人体是一个有机的整体,体内的五脏六腑是相互关联和相互影响的,其中心和肺是气和血相互依存关系的写照。苦参性寒凉,具有清热燥湿的作用,对于2019-nCoV的重要特征“湿邪”和2019-nCoV感染所致的“热证”可能有益;并且苦参的抗炎消炎作用能减轻炎症反应造成的心肌损伤。
对于中药成分多、作用机制复杂的特点,本文采用网络药理学的研究方法,通过活性成分筛选、作用靶点预测、网络构建和分析以及作用靶点功能和通路分析等过程,对苦参治疗2019-nCoV心肌炎的作用机制进行了探讨。研究发现,苦参中有14个活性成分可能通过直接或间接的方式作用于靶点发挥抗2019-nCoV心肌炎的作用,主要有香芹碱、槐定碱、苦参碱、木犀草素和槲皮素等。其中,苦参碱和槐定碱已被证明对VMC有治疗作用[9]。进一步分析得到34个作用靶点,推测苦参可能通过作用于这些靶点发挥作用。最后对作用靶点的功能和信号通路进行富集分析,结果显示:作用靶点主要涉及的生物学功能有细胞因子受体结合、细胞因子活性、受体配体活性、趋化因子受体结合、趋化因子活性、磷酸酶结合、生长因子受体结合、蛋白磷酸酶结合、G蛋白偶联受体结合和TNF受体结合以及TNF受体超家族结合等,分析发现这些生物学功能主要与炎症反应以及细胞生长、增殖和凋亡等密切相关。通路富集结果显示,作用靶点主要参与调控IL-17信号通路、TNF信号通路、Toll样受体信号通路、HIF-1信号通路以及各种疾病通路等多种类型的通路,来发挥治疗作用,其中IL-17、TNF、Toll样受体和HIF-1等信号通路都与炎症反应密切相关,并且IL-17信号通路还参与了细胞纤维化进程,TNF信号通路和HIF-1信号通路能调控细胞凋亡,推测苦参通过抑制炎症反应、心肌细胞纤维化和心肌细胞凋亡等来发挥抗2019-nCoV所致VMC的作用[12-14]。总之,苦参是通过多成分、多靶点和多通路的共同作用发挥抗2019-nCoV心肌炎的作用。
在34个作用靶点中进一步筛选出10个关键靶点,分别是IL-6、IL-10、CASP3、CCL2、IL-1B、CXCL8、ICAM-1、IFNG、IL-4和MAPK1。其中除CASP3和MAPK1外,都与炎症反应密切相关,IL-6和IL-4能介导T细胞和B细胞活化和增殖,在炎症反应中起重要作用;IL-10能抑制多种细胞因子的合成,从而抑制细胞免疫应答;CCL2和CXCL8是趋化因子,能诱导炎症反应,CCL2还能诱导其他炎性因子合成,如IL-6;IL-1B是促炎细胞因子,能活化T细胞和B细胞使细胞因子和抗体产生,促进炎症反应发生,另外,IL-1B能促进成纤维细胞增殖和胶原蛋白产生,从而促进心肌细胞纤维化;ICAM-1是细胞间黏附分子,是炎症发生的重要分子基础;IFNG是Ⅱ型干扰素(IFN-γ),具有免疫调节作用,促进巨噬细胞吞噬抗原、激活自然杀伤细胞和T、B淋巴细胞,增强机体免疫应答,并且IFN-γ还具有抗病毒活性[13,15]。CASP3参与负责凋亡执行的胱天蛋白酶的激活级联反应,在细胞凋亡过程中起重要作用[16]。MAPK1主要参与细胞信号转导,是细胞增殖和分化的调节剂[17]。这些基因的作用揭示了苦参可能通过调控免疫系统,抑制炎症反应、心肌细胞纤维化和心肌细胞凋亡或直接产生抗病毒作用等来发挥治疗2019-nCoV心肌炎的作用。
综上所述,本文基于网络药理学方法,挖掘了苦参治疗2019-nCoV心肌炎可能的活性成分及其相关作用靶点,对作用靶点进行了功能富集分析和通路富集分析,较全面地分析了其可能的作用机制,为临床上可能发生的2019-nCoV心肌炎的治疗提供了参考依据。