橘皮素通过抑制ERK1/2信号通路干预小鼠腹主动脉瘤的进展
2021-07-14乔晓博罗倩文赵鹏刘冉王乐吕晓张明明
乔晓博 罗倩文 赵鹏 刘冉 王乐 吕晓 张明明
(1.河北省人民医院检验科,河北 石家庄 050051; 2.华北理工大学临床医学院,河北 唐山 063210; 3.河北医科大学研究生学院,河北 石家庄 050051)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是动脉管壁在病理因素的作用下局部发生病变或损伤后于薄弱处向外膨出而发生的扩张,瘤体一旦发生破裂,死亡率高达80%,严重威胁中老年人的生命健康[1]。炎症反应、平滑肌细胞凋亡、细胞外基质降解、胶原蛋白沉积和血管弹力纤维断裂是主要病理学特征[2]。随着动脉管壁的逐渐变薄,无法阻抗动脉血流的压力时便发生破裂。胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通过磷酸化的形式可将细胞外各种信息传递至细胞核内,促进细胞增殖和分化等相关蛋白的转录激活[3],ERK1/2信号的过度激活和基质金属蛋白酶(matrix metalloproteinase,MMP)-2和MMP-9的高表达均与AAA相关[4-5]。另外,Notch信号通路可通过调节炎症反应促进AAA的病理进程[6-7],并且与其他细胞内信号通路相互作用,例如c-Jun[8]和ERK1/2[9]等。
橘皮素是于橘皮中提取出来的一种天然化合物,可特异性抑制Notch1受体蛋白的表达,并在抵抗炎症反应和阻断氧化应激等方面发挥着重要作用[10]。研究表明,橘皮素可抑制炎性因子介导的炎症细胞的释放以及ERK1/2的磷酸化,对动脉炎症性疾病如动脉粥样硬化的发生和发展起到一定程度的抑制作用[11],但橘皮素是否通过ERK1/2信号抑制AAA的发展仍未见报道。因此,课题组通过构建小鼠AAA模型去证实Notch1信号抑制剂橘皮素是否能抑制AAA的进展以及是否与ERK1/2信号通路的干预相关,为临床AAA的药物治疗提供参考。
1 材料与方法
1.1 实验试剂
Notch1抑制剂橘皮素(纯度为98.98%)购于北京百奥莱博科技有限公司;药物缓释泵(Alzet公司)购于明阳科华生物科技有限公司;血管紧张素Ⅱ购于Solarbio公司;吸入式麻醉剂异氟烷购于深圳市瑞沃德生命科技有限公司;ERK1/2和p-ERK1/2抗体购于美国Cell Signaling Technology公司;兔抗鼠抗体MMP-2和MMP-9购于Abcam公司;抗体稀释液购于Absin公司;凝胶配制试剂盒(SDS-PAGE Gel Kit)、二辛可宁酸蛋白浓度测定试剂盒、总蛋白提取试剂盒、硝酸纤维素膜(Immobilon-Nc)均购于Solarbio公司;Masson三色染色试剂盒(Solarbio公司)、弹力纤维染色试剂盒(Servicebio公司)、高脂饲料(含0.15%胆固醇、21%脂肪,美迪森公司)和抗荧光淬灭封片液(含4’,6-二脒基-2-苯基吲哚)购于上海碧云天生物技术有限公司。
1.2 实验设备
低温离心机(天美科学仪器有限公司),Epoch CHS酶标仪(赛默飞世尔公司),石蜡切片机(徕卡显微系统贸易有限公司),光学显微镜(日本奥林巴斯)和荧光显微镜(天津众邦企业国际贸易有限公司)。
1.3 小鼠AAA模型及样本制备
1.3.1 动物模型的建立
7~8周龄雄性ApoE-/-小鼠购自卡文斯实验动物有限公司[生产许可证号SCXK(苏)2016-0010],体重(22±1)g,动物实验在河北省人民医院临床研究中心SPF级动物房[SYXK(冀)2015-0065]进行,该动物实验经过了河北省人民医院医学伦理委员会的批准(201922)。以1 000 ng·kg-1·min-1持续4周剂量的血管紧张素Ⅱ缓释泵植入小鼠皮下,同时用含0.15%胆固醇的高脂饲料常规饲养,构建小鼠AAA模型,超声检查评估腹主动脉扩张情况,4周后将造模成功的小鼠随机分为两组:对照组和治疗组,各10只,治疗组中每只小鼠予以100 mg/kg的橘皮素溶液灌胃,对照组给予同等剂量的生理盐水,每日1次,共4周。
1.3.2 标本取材
0.2%戊巴比妥钠腹腔注射麻醉小鼠,由下腹部向上剪开至颈部,剥离肌肉及结缔组织,充分暴露心脏及相连的血管和肾脏,匀速输注4 ℃肝素生理盐水冲洗心脏,分离心脏、主动脉及肾脏,剥离血管外膜脂肪组织后置于解剖显微镜下观察主动脉血管形态,游标卡尺测量血管最大直径并拍照记录,统计测量后进行分析。每组5只小鼠瘤体组织4%多聚甲醛固定,石蜡包埋;另外5只瘤体组织置于液氮中保存。
1.4 检测方法
1.4.1 Masson染色
石蜡切片浸入二甲苯液中进行脱蜡,梯度酒精入水处理后,用免疫组化笔在载玻片上将组织画圈,Weigert铁苏木素染色10 min,水洗后置于酸性乙醇液分化1 min,流水冲洗并滴加Masson蓝化液5 min返蓝,再次冲洗,丽春红品红染液滴染10 min,之后用磷钼酸溶液洗3 min,滴加苯胺蓝染液3 min,弱酸工作液洗1 min,质量分数为95%、100%Ⅰ和100%Ⅱ的酒精梯度脱水,二甲苯透明,中性树胶封片。
1.4.2 弹力纤维染色
制备好的石蜡切片依次脱蜡至水,将酒精苏木素、三氯化铁和碘液按照5∶2∶2的比例混合为弹力纤维染色(Elastic Van Gieson,EVG)染液,避光滴加至切片组织上10 min,水洗,酸性乙醇分化液分化数秒,水洗终止分化,显微镜下控制分化程度,直至弹力纤维呈紫黑色细丝状为佳,苦味酸与酸性品红按9∶1混合配置VG染液,滴染10 s后浸入梯度酒精(95%、100%Ⅰ和100%Ⅱ)脱水,二甲苯透明,中性树胶封片。
1.4.3 Western blot检测
取出冻存的血管组织,用眼科剪剪碎,置冰上充分研磨后加入组织裂解液,4 ℃离心提取蛋白;配制SDS-PAGE凝胶,蛋白加样连接电泳,湿转法将蛋白转至聚偏二氟乙烯膜上,置于5%脱脂奶粉中封闭2 h,滴加稀释后的一抗4 ℃过夜,TBST洗5 min×5次,置于带有辣根过氧化物酶的二抗溶液中振荡孵育2 h,TBST洗5 min×5次,滴加电化学发光液进行曝光显影。
1.4.4 免疫荧光染色
4 μm切片石蜡切片,脱蜡至水,柠檬酸缓冲液高温高压抗原修复,冷却后磷酸缓冲盐溶液浸洗5次,10%山羊血清室温封闭30 min,一抗(抗体1∶50比例稀释)4 ℃孵育过夜,PBS浸洗5次,荧光二抗避光室温孵育60 min,PBS浸洗5次,抗荧光淬灭封片液染核并封片,于荧光显微镜下观察。
1.5 统计学分析
数据采用SPSS 19.0统计软件处理,计量资料以均数±标准差表示,两组间比较采用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 两组小鼠AAA的膨胀尺寸比较
测量两组小鼠瘤体尺寸后统计发现,与对照组相比,治疗组小鼠腹主动脉血管的持续扩张明显被抑制[(1.812±0.143) mm vs(2.549±0.265) mm,n=10],差异有统计学意义(P<0.05),如图1所示。
2.2 两组小鼠AAA的病理学观察
Masson和EVG染色发现,对照组小鼠AAA腔体增大,中膜层平滑肌细胞数减少且排列紊乱,胶原纤维溶解,含量减少;中层弹力蛋白结构破坏严重,原有曲度消失,甚至变直、变细和缺失,胶原沉积,断裂明显;经橘皮素干预后,AAA组织形态较为完善,胶原纤维排列均匀,中膜层弹力蛋白结构相对完整,纵行分裂较少,连续性好,弹力纤维曲度可见。如图2所示。
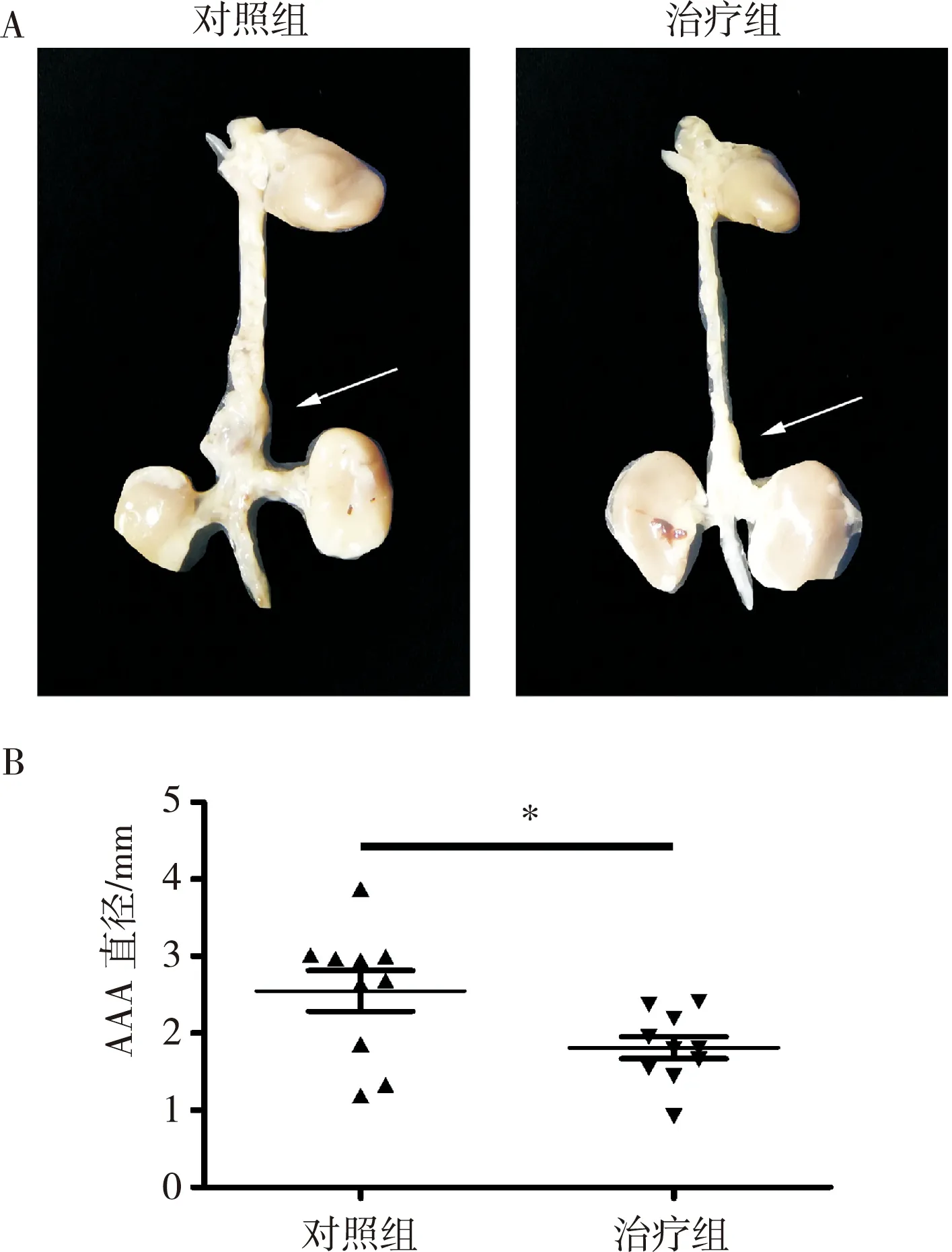
注:组织形态学显示橘皮素减弱了ApoE-/-小鼠AAA的膨胀尺度(*P<0.05)。图1 橘皮素对小鼠AAA膨出直径的影响

注:A和B:Masson染色中蓝色代表胶原纤维,橘皮素抑制了治疗组小鼠胶原纤维的溶解(放大倍数:10×);C和D:EVG染色中黑色代表弹力纤维,和对照组相比,橘皮素治疗组小鼠弹力纤维相对完整(放大倍数:10×)。图2 Masson和EVG染色两组小鼠AAA组织结果
2.3 两组小鼠AAA组织中ERK1/2、p-ERK1/2、MMP-2和MMP-9蛋白的表达
与对照组相比,100 mg/kg的橘皮素治疗组ApoE-/-小鼠动脉瘤组织中ERK1/2蛋白表达无明显变化,而其活化形式p-ERK1/2活性降低,随之其下游分子蛋白MMP-2和MMP-9的蛋白表达亦有所下降,提示橘皮素对ERK通路蛋白的调控作用,差异具有统计学意义(P<0.05)。见图3。
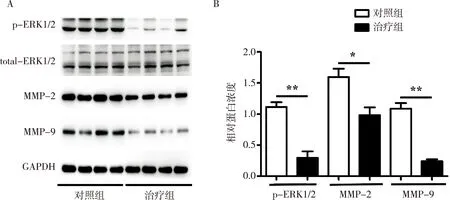
注:A:和对照组相比,橘皮素治疗组total-ERK1/2蛋白表达无明显变化,但其活化状态的p-ERK1/2以及MMP-9和MMP-2的表达明显降低(**P<0.01,*P<0.05),GAPDH为内参;B:橘皮素治疗组p-ERK1/2、MMP-9和MMP-2的表达水平明显降低(**P<0.01,*P<0.05)。图3 Western blot检测两组小鼠AAA组织中ERK通路蛋白的表达
2.4 两组小鼠AAA组织中MMP-2、MMP-9的定位
免疫荧光染色结果显示,在AAA组织中MMP-2表达主要分布于血管中膜部分,MMP-9主要分布在外膜区域;并且与对照组比较,治疗组主动脉壁绿色和红色荧光的强度明显减弱,进一步表明橘皮素对MMP-2和MMP-9表达的抑制作用。见图4。

注:A:绿色荧光区域代表MMP-2在各组小鼠AAA中的表达情况(放大倍数:40×);B:橙红色荧光区域代表MMP-9在各组小鼠AAA中的表达情况(放大倍数:40×);C:免疫荧光染色显示橘皮素降低了MMP-2和MMP-9在小鼠AAA中的表达(**P<0.01)。图4 免疫荧光法检测橘皮素对ERK通路下游蛋白的影响
3 讨论
腹主动脉血管中膜层以层状排列的血管平滑肌细胞为主,其可分泌大量的弹力蛋白和细胞外基质,用以维持并修复血管壁正常弹性状态。在AAA的形成过程中,炎症反应诱导趋化因子的分泌,招募单核巨噬细胞等炎性细胞在血管壁聚集,大量的炎性细胞可降解细胞外基质并促使血管平滑肌细胞的凋亡,致使正常血管组织结构被破坏,血管稳态及顺应性降低,最终促进了血管壁的局部扩张。大量研究证实,动脉瘤的发生机制与炎症反应、氧化应激和MMPs家族的水解有关,而炎症反应贯穿于动脉瘤病程的始终[12-13]。以巨噬细胞为主的炎症细胞聚集和炎性因子的释放激活血管平滑肌细胞中ERK信号通路,该通路的激活促进MMP-2和MMP-9表达的上调,溶解细胞外基质成分,血管组织屏障进一步被破坏[14]。
近年来研究发现,Notch1信号通路可能是通过影响血管平滑肌细胞和巨噬细胞参与动脉粥样硬化和AAA的发展进程[15],并且该信号通路与ERK等多种信号传导途径交汇[16]。并且在小鼠动脉瘤模型中,ERK磷酸化水平明显高于正常小鼠,通过抑制ERK通路蛋白的活化可明显延缓AAA的进展[17-18],提示Notch1可能是ERK1/2的上游信号并促进下游分子MMP-2和MMP-9的表达。本研究结果显示,在血管紧张素Ⅱ诱导成功的小鼠AAA模型中,血管组织中ERK磷酸化水平显著升高且MMP-2和MMP-9蛋白表达量亦增加;与此同时,MMP-2和MMP-9蛋白表达主要位于血管中膜和外膜组织,并伴随弹力纤维断裂以及大量胶原沉积,增加了动脉壁的扩张程度和动脉瘤破裂的风险;而在治疗组中小鼠的腹主动脉壁结构趋于相对完整,扩张度明显降低,胶原纤维分布均匀,弹力纤维断裂程度减缓,说明橘皮素显著保护了动脉壁结构的完整性,具有抑制AAA进展的作用。这与已有的橘皮素具有抗炎功能的报道结果一致。另外,橘皮素作为特异性阻断Notch1受体表达的天然产物[19-20],具有毒副作用少的优势,配合其他信号分子化学抑制剂的效果值得进一步研究。
尽管本研究证实了橘皮素抑制小鼠AAA的作用是通过ERK1/2信号通路的干预,但以下几点限制仍值得研究者的关注:(1)对照组和治疗组中整体Notch家族1~4分子的表达情况如何需进一步检测,以期全面了解该信号通路在AAA中的作用;(2)橘皮素与ERK1/2信号抑制剂联合应用是否在抑制AAA进展中的作用更为突出;(3)细胞水平的分子机制阐述仍必不可少。
综上所述,橘皮素作为Notch信号通路抑制剂可通过与ERK1/2的通路相互作用延缓AAA扩张的进程,抗血管重塑并降低AAA破裂的风险,有望成为有效缓解和治疗AAA进展的药物分子。