米贝地尔增强3,3′-二吲哚甲烷对肝癌细胞的抑制作用
2021-07-14姜袁越徐伟顾杰叶洋徐新明孙俊陈健陆荣柱
姜袁越,徐伟,顾杰,叶洋,徐新明,孙俊,陈健,陆荣柱,5
(1. 江苏大学医学院,江苏 镇江212013; 2. 昆山市中医医院病理科,江苏 苏州 215300; 3.江苏大学生命科学研究院,江苏 镇江212013; 4. 江苏大学附属昆山医院普外科,江苏 苏州 215132;5.江苏大学附属昆山医院临床实验研究中心,江苏 苏州 215300)
调节肿瘤细胞内胞质游离钙(cytosolic free calcium,[Ca2+]i)可影响肿瘤细胞凋亡、侵袭和转移等[1],钙通道阻滞剂因其阻断钙通道运输[Ca2+]i至周围细胞的功能,在肿瘤的实验治疗中有所应用[2-4],可能与降低[Ca2+]i外流,促进[Ca2+]i聚集,进而抑制神经胶质瘤细胞[5-6]、乳腺癌细胞[7-8]、黑色素瘤细胞[9]等肿瘤细胞增殖有关。因此调节钙离子通道的功能可调控[Ca2+]i水平,进而可以调节肿瘤细胞增殖与凋亡。
研究发现,植物化学物3,3′-二吲哚甲烷(3,3′-diindolylmethane, DIM)能上调IFNγ表达,其主要通过激活与[Ca2+]i相关的p38 MAPK信号通路[10]。我们前期研究发现,[Ca2+]i水平增高和p38 MAPK磷酸化信号转导激活是钙离子载体A23187增强DIM抗肝癌细胞效应的重要机制[11]。在前列腺癌细胞中,DIM通过升高[Ca2+]i诱导细胞凋亡,但在宫颈癌细胞中,DIM通过内质网钙库的耗竭引起细胞死亡[12],因而提示DIM扰乱钙稳态途径具有肿瘤细胞特异性。因此,本研究拟通过T型钙通道阻滞剂米贝地尔调控[Ca2+]i,进而探讨钙通道在DIM对肝癌细胞[Ca2+]i的影响中的作用及其潜在的分子机制。
1 材料与方法
1.1 主要材料
肝癌SMMC-7721和HepG2细胞购自中科院细胞生物学研究所;高糖培养基(美国HyClone公司);胎牛血清(美国Gibco公司);DIM、米贝地尔、[Ca2+]i荧光探针Fluo-3/AM(美国Sigma公司);CCK-8细胞计数试剂盒(日本Dojindo公司);β-肌动蛋白、羊抗兔二抗(美国Santa Cruz公司);兔抗人增殖细胞核抗原(PCNA)、cleaved-caspase 3、p-p38 MAPK单克隆抗体(美国Cell Signaling Technology公司);ECLIPSE TE2000-U倒置荧光显微镜(日本Nikon公司)。
1.2 细胞培养
将肝癌SMMC-7721和HepG2细胞培养于含有10%胎牛血清的高糖培养基内,其中含100 U/mL青霉素和100 μg/mL链霉素。将细胞于含5%CO2、37 ℃培养箱内常规培养传代。
1.3 细胞分组
将肝癌SMMC-7721和HepG2细胞按“1.2”方法培养至细胞融合度达70%~80%时,各分为4组,对照组用含10%胎牛血清的高糖培养基培养24.5 h;米贝地尔组用5 μmol/L米贝地尔处理24.5 h;DIM组用60 μmol/L DIM处理24.5 h;米贝地尔+DIM组用5 μmol/L米贝地尔预处理0.5 h,再与60 μmol/L DIM共同处理24 h,进行后续实验。
1.4 普通倒置显微镜观察细胞形态
取“1.3”各组处理后细胞,PBS冲洗,倒置显微镜观察细胞形态,并拍照记录。
1.5 荧光探针检测肝癌细胞[Ca2+]i水平
以5×105个/孔密度将肝癌SMMC-7721、HepG2细胞接种至6孔板,观察细胞生长情况;当细胞融合度达70%~80%时,按“1.3”分组处理后,PBS洗涤3次,每次5 min;每孔加入5 μmol/L Fluo-3/AM工作液300 μL,覆盖细胞表面;37 ℃避光孵育1 h;PBS洗涤3次,每次5 min;甘油封片,倒置荧光显微镜获得[Ca2+]i成像,激发波长480~500 nm。
1.6 CCK-8法检测细胞增殖活力
以5×103个/孔密度将肝癌SMMC-7721和HepG2细胞接种至96孔板。待细胞融合度达70%~80%时,按“1.3”分组处理后,每孔加入CCK-8试剂和高糖培养基的混合物,二者体积比为CCK-8 ∶高糖培养基=1 ∶10,37 ℃避光孵育40 min;测定450 nm波长处光密度(D)值;重复3次。
1.7 Hoechst 33342染色检测细胞凋亡水平
以1×104个/孔密度将肝癌SMMC-7721和HepG2细胞接种至24孔板。待细胞贴壁融合度达到70%~80%时,按“1.3”分组处理后,弃培养基,PBS清洗2次;每孔加入300 μL Hoechst染液,37 ℃避光染色30 min;PBS清洗5 min,甘油封片。在紫外光激发的倒置荧光显微镜下观察细胞成像,凋亡指数(%)=凋亡细胞数/(凋亡细胞数+非凋亡细胞数)×100%;重复3次。
1.8 蛋白质印迹法检测增殖与凋亡相关蛋白表达
取“1.3”分组细胞;弃培养基,将新鲜蛋白裂解液(磷酸酶抑制剂 ∶PMSF ∶RIPA裂解液=2 ∶1 ∶100)加入培养皿置于4 ℃裂解15 min,收集全蛋白; 4 ℃以12 000×g离心15 min,取上清液;BCA蛋白定量法测定蛋白浓度,加入适量的5×上样缓冲液,调至相同浓度,经振荡仪振荡30 s后,100 ℃煮沸5 min,-80 ℃保存备用。
蛋白于80 V经SDS-PAGE分离;300 mA转膜90 min至PVDF膜;5%脱脂奶粉室温封闭2 h;将PVDF膜放入对应的一抗稀释液中,其中PCNA、cleaved-caspase 3、p-p38 MAPK稀释比均为1 ∶1 000,β-肌动蛋白为内参,稀释比为1 ∶10 000,4 ℃孵育过夜;TBST洗涤3次,加入HRP标记的羊抗兔二抗稀释液(稀释比为1∶10 000),室温孵育1 h;TBST洗涤3次;在暗室中加入ECL化学发光剂,经凝胶成像系统显影。采用Lane 1D软件处理结果图像;重复3次。
1.9 统计分析

2 结果
2.1肝癌细胞形态学变化
与对照组相比,米贝地尔组细胞形态无明显变化,但DIM组细胞数变少,细胞分散,分布较稀疏,细胞融合度降低,细胞形态变小、变细,贴壁能力降低。与DIM组相比,米贝地尔+DIM组细胞数量更少,细胞形态破坏更严重。由此提示,米贝地尔单独处理并不能影响细胞形态,却能够增强DIM对细胞形态损伤以及降低细胞贴壁能力。见图1。
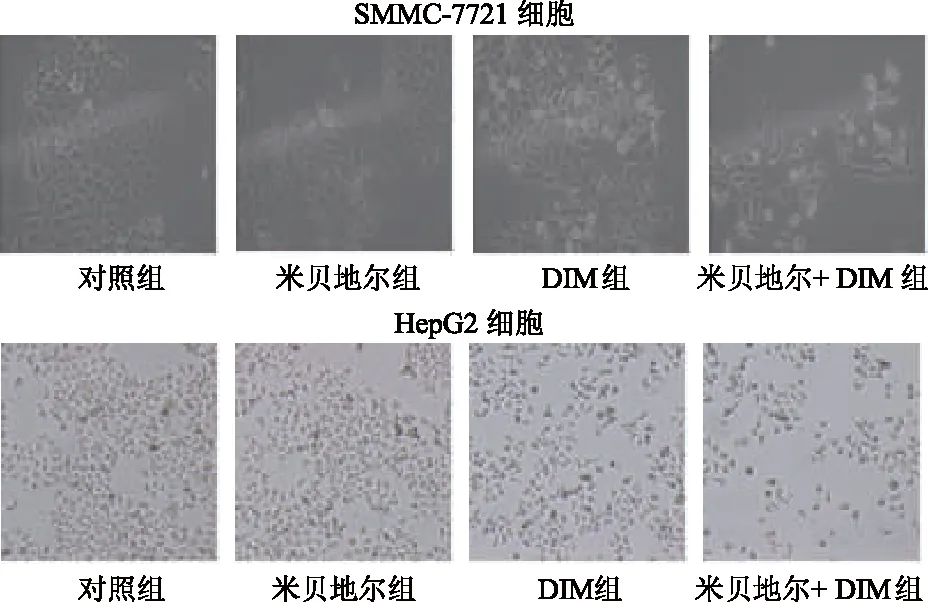
图1 各组肝癌SMMC-7721和HepG2细胞形态学变化(40×)
2.2 米贝地尔预处理增强DIM致肝癌细胞增殖活力下降
CCK-8结果显示,在肝癌SMMC-7721和HepG2细胞中,与对照组相比,米贝地尔组内细胞活力变化无统计学意义(P>0.05),但DIM组细胞活力明显降低(q=11.27, 12.46,P均<0.05)。与DIM组相比,米贝地尔+DIM组SMMC-7721和HepG2细胞活力明显降低(q=4.973, 5.647,P均<0.05)。由此提示,无细胞毒性的米贝地尔能够增强DIM导致肝癌细胞增殖活力下降效应。见图2。
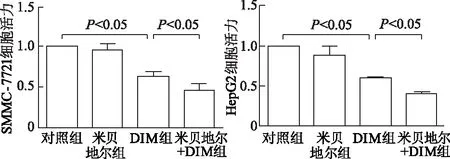
图2 CCK8法检测各组肝癌SMMC-7721和HepG2细胞增殖活力变化
2.3 肝癌细胞增殖及凋亡相关蛋白表达变化
在肝癌SMMC-7721和HepG2细胞中,与对照组相比,DIM组PCNA蛋白表达明显降低(q=12.8, 18.51,P均<0.05),但米贝地尔组中PCNA蛋白水平变化无统计学意义。与DIM组相比,米贝地尔+DIM组细胞PCNA表达水平明显降低(q=6.81, 8.35,P均<0.05)。见图3。由此显示,米贝地尔本身并不能降低肝癌细胞PCNA蛋白表达,但可增强DIM对肝癌细胞PCNA蛋白表达水平的抑制。
与对照组相比,DIM组细胞cleaved-caspase 3及p-p38 MAPK表达水平均明显升高(P均<0.05),米贝地尔组cleaved-caspase 3及p-p38 MAPK水平差异无统计学意义(P均>0.05)。与DIM组相比,米贝地尔+DIM组cleaved-caspase 3和p-p38 MAPK蛋白表达水平明显升高(P均<0.05)。见图3。由此提示,米贝地尔可增强DIM诱导肝癌细胞cleaved-caspase 3及p-p38 MAPK表达水平升高效应。
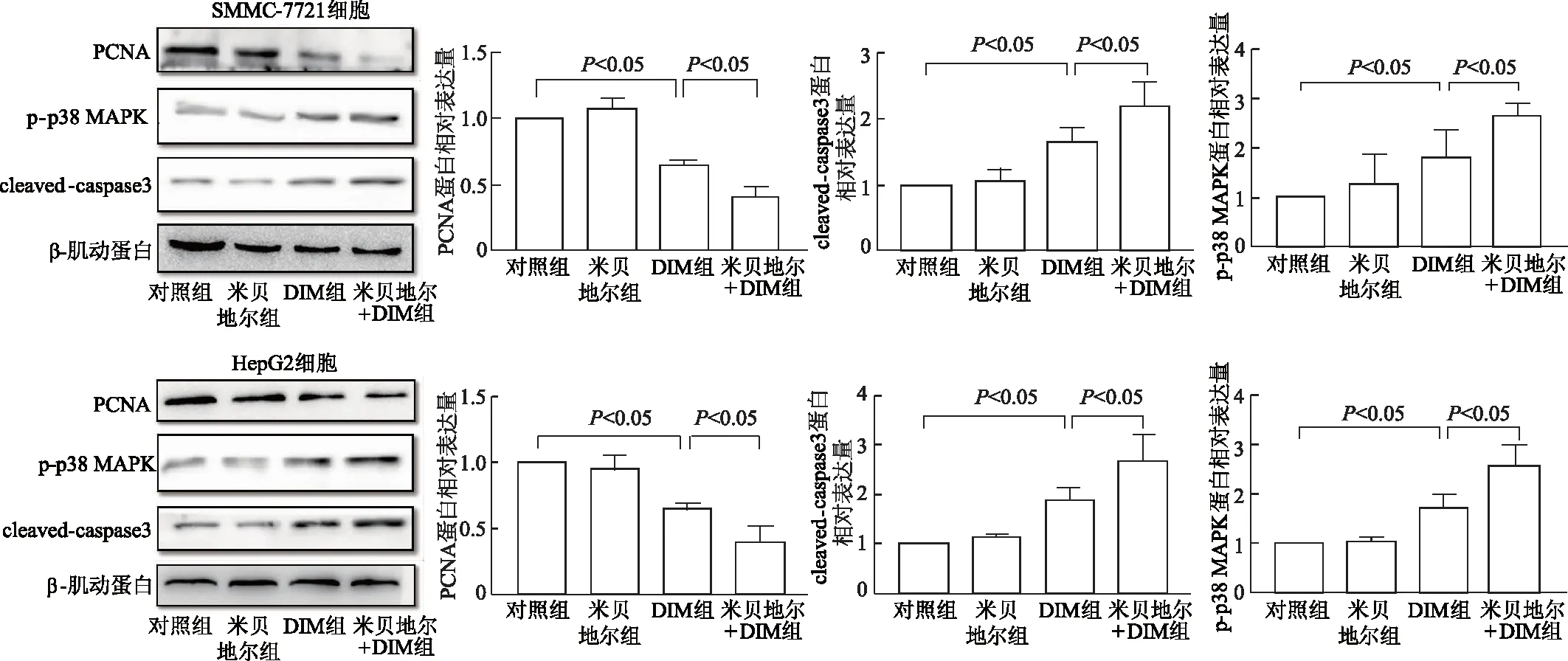
图3 免疫印迹法检测各组肝癌细胞增殖及凋亡相关蛋白表达水平
2.4 米贝地尔增强DIM诱导肝癌细胞的凋亡效应
与对照组相比,DIM组处理后,肝癌SMMC-7721和HepG2细胞凋亡水平明显升高(q=6.803,4.811,P均<0.05),米贝地尔组细胞凋亡水平差异无统计学意义(P>0.05)。与DIM组比较,米贝地尔+DIM组SMMC-7721和HepG2细胞凋亡指数明显增加(q=11.34, 8.018,P均<0.05)。见图4。由此提示,米贝地尔虽然对肝癌细胞凋亡水平并无直接作用,但是能够增强DIM诱导的肝癌细胞凋亡。
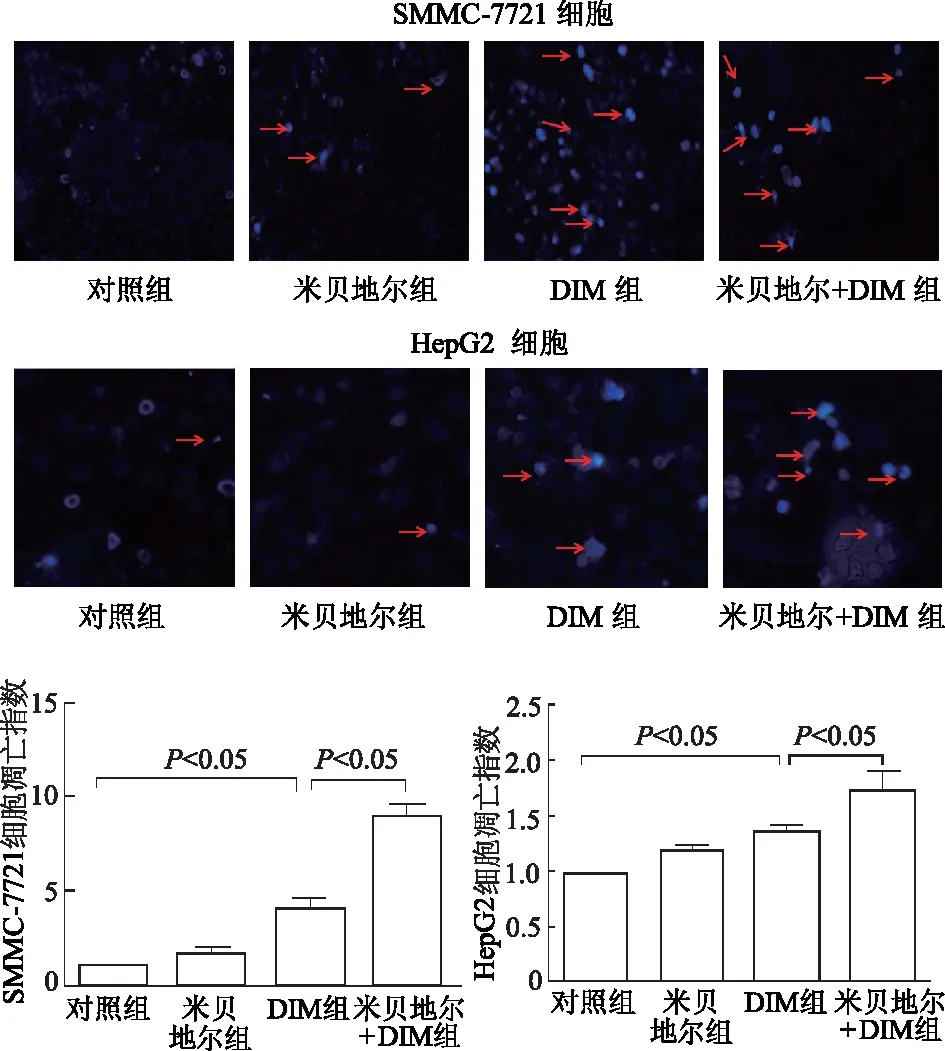
图4 Hoechst染色检测各组细胞凋亡水平
2.5 肝癌细胞[Ca2+]i荧光水平变化
Fluo 3/AM荧光探针与[Ca2+]i结合后,激发绿色荧光。如图5所示,与对照组相比,DIM组肝癌SMMC-7721、HepG2细胞内[Ca2+]i水平升高,而米贝地尔组肝癌细胞内[Ca2+]i水平无变化;与DIM组相比,米贝地尔+DIM组[Ca2+]i水平升高。由此提示,DIM能够升高肝癌细胞内[Ca2+]i水平,米贝地尔预处理能够增强DIM诱导肝癌细胞内[Ca2+]i水平升高。
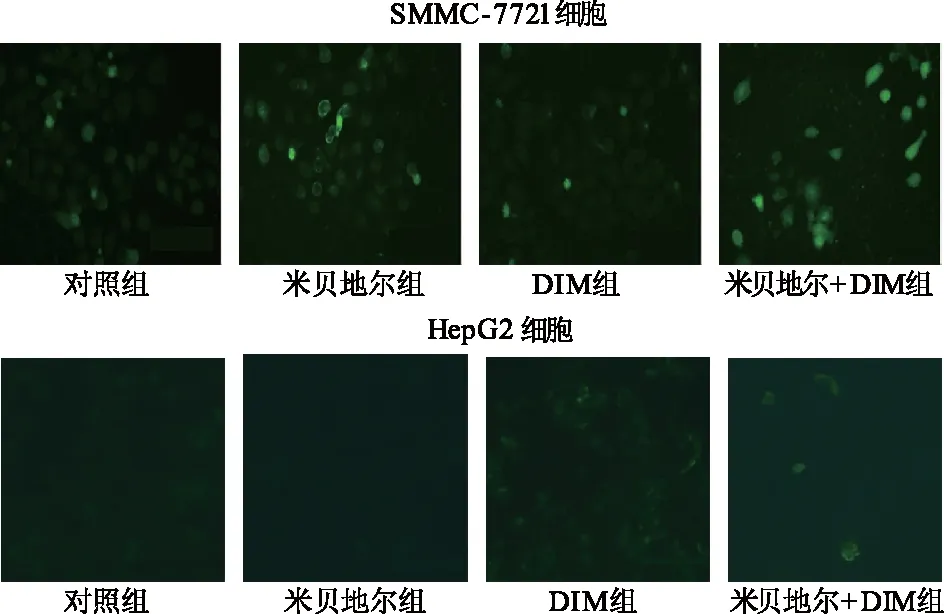
图5 荧光探针法检测肝癌SMMC-7721和HepG2细胞[Ca2+]i水平(标尺100 μm)
3 讨论
本研究发现,T型钙通道阻滞剂米贝地尔可增强DIM诱导肝癌细胞凋亡、抑制肝癌细胞增殖的效应,其机制与激活p-p38 MAPK信号通路转导及升高肝癌细胞内[Ca2+]i水平有关。
本研究结果表明,与DIM组相比,米贝地尔+DIM组细胞增殖活力降低且凋亡指数升高,提示联合使用钙通道阻滞剂与植物化学物DIM,一方面可抑制肝癌细胞增殖水平,另一方面可提高肝癌细胞凋亡水平,表明T型钙通道阻滞剂米贝地尔能够增强DIM(60 μmol/L)的抗肝癌细胞效应,这与钙通道阻滞剂氨氯地平增强长春新碱对胶质母细胞瘤的化疗效果[13]以及米贝地尔提高编码RAF家族中丝氨酸/苏氨酸蛋白激酶的BRAF基因靶向药物维罗非尼的抗癌效应[14]等研究结果相一致。已有研究发现,多种植物化学物抗癌机制涉及p-p38 MAPK信号通路转导,如姜黄素诱导肝癌HepG2细胞凋亡,其主要涉及上调cleaved-caspase 3、P53蛋白表达水平及降低总caspase 3蛋白表达水平[15]。细胞内p-p38 MAPK途径、线粒体途径、氧化应激途径是促进细胞凋亡的重要机制[16]。本研究结果显示,米贝地尔预处理+DIM处理后,cleaved-caspase 和p-p38 MAPK蛋白表达水平明显升高,提示米贝地尔可激活p38 MAPK蛋白磷酸化信号,进而诱导细胞凋亡,增强DIM抗肝癌效应。
研究表明,扰乱[Ca2+]i可诱导肿瘤细胞死亡,其可能与破坏细胞周期、诱导氧化应激等相关[17]。在成纤维L929细胞中,L型钙通道抑制剂维拉帕米或硝苯地平可抑制新曲霉素诱导的细胞增殖,其可能与蛋白激酶C功能抑制及cAMP失活相关。钙通道阻滞剂通过降低cAMP活性,抑制细胞周期,也可通过直接水解caspase-3、caspase-9,诱导p-p38 MAPK活化促进凋亡的发生[18]。本研究结果表明,DIM诱导肝癌细胞内[Ca2+]i荧光水平升高,米贝地尔+DIM组[Ca2+]i荧光强度明显高于DIM组,由此提示,米贝地尔可增强DIM诱导肝癌细胞[Ca2+]i升高。此外,米贝地尔预处理肝癌细胞凋亡指数与[Ca2+]i均升高,表明凋亡与[Ca2+]i水平升高可能有伴随效应;细胞cleaved-caspase 3和p-p38 MAPK蛋白表达水平升高可能与米贝地尔增强DIM诱导肝癌细胞[Ca2+]i水平升高相关。[Ca2+]i调控下游钙调蛋白促进PCNA结构域磷酸化,进而抑制DNA聚合酶合成,阻断细胞周期[19]。本研究中米贝地尔+DIM组[Ca2+]i升高,而PCNA蛋白表达降低,提示高[Ca2+]i水平可能参与降低PCNA表达水平,[Ca2+]i水平升高可能是米贝地尔增强DIM抑制肝癌细胞增殖的重要机制。
本研究中T型钙通道阻滞剂米贝地尔对SMMC-7721及HepG2肝癌细胞形态、增殖活力、凋亡水平并无直接作用,其可能与5 μmol/L米贝地尔抑制肝癌细胞膜上钙通道功能后,肝癌细胞[Ca2+]i外流受限,而胞质内质网、线粒体钙库的储备达到动态平衡有关[20]。
关于米贝地尔与DIM诱导[Ca2+]i的研究仍不完善,需要增加一些新的指标,如胞质游离钙相关蛋白测定,细胞内质网游离钙水平检测等。研究表明,10 μmol/L米贝地尔处理HCT116结肠癌细胞后能够激活Akt丝裂原活化蛋白激酶通路调控增殖相关通路[21]进而减弱米贝地尔对肠癌的抑制效应,但本研究中无细胞毒性的5 μmol/L米贝地尔并未诱导肝癌细胞增殖和凋亡的变化,这是否与肝癌细胞与结肠癌细胞差异性有关有待进一步研究。
