血清miR-144水平在膀胱癌诊断及预后评价中的价值分析
2021-07-13徐峰杨勇付斌
徐峰,杨勇,付斌
(1.航天中心医院泌尿外科,北京 100049;2.解放军总医院第四医学中心泌尿外科,北京 100037)
膀胱癌的死亡率一直位列全部恶性肿瘤的前十位[1],在我国的发病率位列男性恶性肿瘤的第八位[2]。膀胱癌主要分为非肌层浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC),NMIBC患者占绝大多数且恶性度相对较低,而MIBC通常恶性程度较高,预后较差[3]。虽然,近年来针对膀胱癌的新型治疗方法不断涌现[4],但患者预后并未得到有效改善,其主要原因是其早期诊断率较低且术后复发转移率较高,提高膀胱癌的早期诊断和术前危险度评价效率具有重要的临床意义。目前临床上针对膀胱癌的术前诊断主要依靠膀胱镜检查及病理组织活检,此类检查不仅具有依从性差、并发症多、费用高的局限性,而且难以发现早期的微小肿瘤病灶[5]。因此,寻找可靠的新型膀胱癌肿瘤标志物以提高诊断效率成为了该领域的焦点。微小RNA(microRNAs)、长链非编码RNA(long non-coding RNAs,LncRNAs)等非编码RNA(non-coding RNAs,ncRNAs)能够通过影响细胞的生长周期和各种信号通路参与肿瘤细胞的生长、增殖、侵袭和迁移,在膀胱癌研究领域也受到了广泛的关注,微小RNA-144(microRNA-144,miR-144)是近年来发现的一种在多种肿瘤组织中异常表达的microRNAs,但能否通过检测外周血miR-144水平来辅助膀胱癌的早期诊断和预后预测,仍然存在着较大的争议。基于此,本研究针对血清miR-144水平在膀胱癌诊断及预后评价中的价值进行了分析。
1 资料与方法
1.1 一般资料
连续选取2015年8月至2017年8月在航天中心医院泌尿外科行手术治疗的96例膀胱癌患者作为病例组,选取同期100名健康体检者作为对照组。两组研究对象均签署知情同意书并自愿参与本研究,研究方案经医院医学伦理委员会审批通过。
纳入标准:(1)膀胱癌的诊断标准参照美国国家综合癌症网络(national comprehensive cancer network,NCCN)制订的《膀胱癌临床实践指南(2016)》[6],具体诊断标准为:患者早期出现血尿症状,可伴有尿频、尿急、尿痛等膀胱刺激征或盆腔疼痛,晚期查体可触及盆腔包块,术前均经尿脱落细胞检查、膀胱镜检查及超声、X线、静脉尿路造影、核磁共振成像等影像学检查证实,并经术后病理检查确诊;(2)均于同一医院择期行手术治疗,其中NMIBC患者采用经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)联合术后卡介苗或蒽环类化疗药物局部灌注,MIBC患者采用膀胱根治性切除联合盆腔淋巴结清扫术、术后放化疗;(3)术后对患者进行随访。病例组患者入院病历资料完整。对照组研究对象均经临床检查排除泌尿系统疾病。排除标准:(1)合并心脑血管意外、肝肾功能不全、血液系统疾病、肺部急性感染、慢性阻塞性肺疾病、肺纤维化、神经系统疾病及膀胱外其它部位恶性肿瘤的患者;(2)复发性膀胱癌病例或术前已接受抗肿瘤治疗的患者;(3)年龄<18岁者;(4)妊娠期或哺乳期患者。
通过查阅病案资料对两组研究对象的年龄、性别构成、合并基础疾病等基线资料进行调查和对比,同时,对病例组患者的肿瘤类型、肿瘤大小、肿瘤分期、淋巴细胞转移等临床特征进行调查。两组研究对象在基线资料方面比较,差异均无统计学意义(P>0.05)。见表1。在病例组中,68例为NMIBC患者,28例为MICB患者,临床分期为T0~T1期32例,T2~T4期64例,52例患者肿瘤直径≥3 cm,40例患者存在淋巴结转移。

表1 两组研究对象基线资料对比
1.2 观察指标
血清miR-144相对表达量:采集两组研究对象的空腹外周静脉血样本4 mL,病例组采血时间为入院次日,对照组采血时间为体检当日。血样于室温下静置2 h后以3 000 rpm的速度(离心半径10 cm)离心10 min,以微量加样器吸取血清样本500 μL置于-18 ℃中保存待测。采用Trizol reagent RNA提取试剂盒(美国Invitrogen公司)提取血清总RNA,采用实时聚合酶链式反应(real time polymerase chain reaction,RT-PCR)法,检测仪器为ABI 7 500型荧光定量PCR仪(美国ABI公司),RNA催化合成采用cDNA:PrimerScriptTMRT试剂盒,RNA扩增采用SYBR Premix Ex TaqTMqRT-PCR试剂盒。以U6为内参,miR-144和U6的PCR扩增引物序列见表2,反应体系为20 μL,包括SYBR Premix Ex TaqTMⅡ 10 μL、PCR Forward Primer 0.8 μL、Uni-miR qPCR Primer 0.8 μL、ROX Reference DyeⅡ 0.4 μL、cDNA模板2 μL、dH2O6 μL。反应条件为:95 ℃变性5 min,95 ℃10 s,60 ℃20 s,72 ℃20 s,78 ℃20 s采集荧光,共反应40个循环,采用熔解曲线和3.5%的NuSieve琼脂糖凝胶电泳对扩增产物进行分析,采用Opticon Monitor 软件分析PCR反应结果并计算循环阈值(cycle threshold,Ct),采用2-△△Ct法计算目标RNA的相对表达量,其中△Ct=Ct目标基因-Ct内参基因,△△Ct=△Ct检测样品-△Ct基准样品。

表2 miR-144及内参的PCR扩增引物
1.3 膀胱癌患者术后生存期随访
所有患者术后均给予跟踪随访,最长随访期为36个月,随访方式为每4周至少进行1次电话微信随访,每3个月至少进行1次门诊随访,对患者的总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)进行随访。其中,OS的终点事件为患者全因死亡,PFS的终点事件为肿瘤进展或复发,如患者生存期长于末次随访,其生存数据记为删失数据。
1.4 统计学分析
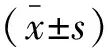
2 结果
2.1 两组研究对象及不同临床特征膀胱癌患者血清miR-144水平的比较
病例组患者的血清miR-144水平低于对照组,肿瘤分期T2~T4患者的血清miR-144水平低于肿瘤分期Ta~T1患者,有淋巴结转移患者的血清miR-144水平低于无淋巴结转移患者,差异有统计学意义(P<0.05)。见表3。ROC曲线分析结果显示,血清miR-144水平在诊断膀胱癌、T2~T4期膀胱癌、膀胱癌淋巴结转移中的AUCROC均具有统计学意义(P<0.05),其中血清miR-144水平在诊断膀胱癌中的AUCROC最高,为0.896。见表4及图1。

表3 两组研究对象及不同临床特征膀胱癌患者血清miR-144水平的比较

表4 血清miR-144水平诊断膀胱癌的ROC曲线分析

2.2 血清miR-144水平与膀胱癌患者预后的相关性分析
随访期截止2020年8月31日,以病例组血清miR-144水平均数为划分界值,将病例组分为高血清miR-144水平组(血清miR-144相对表达量>0.51,46例)和低血清miR-144水平组(血清miR-144相对表达量≤0.51,50例)。Kaplan-Meier生存分析结果显示,低血清miR-144水平组患者的OS、PFS估计值均低于高miR-144水平组,差异有统计学意义(P<0.05)。见表5、图2。Cox风险回归模型分析结果显示,膀胱癌患者术后OS和PFS与血清miR-144水平和肿瘤类型均具有相关性(P<0.05),其中MIBC可提升患者不良预后风险,高血清miR-144水平可降低患者不良预后风险。见表6、表7。

表5 不同血清miR-144水平膀胱癌患者术后OS和PFS的比较

表6 膀胱癌患者术后OS相关因素的Cox风险回归模型分析

表7 膀胱癌患者术后PFS相关因素的Cox风险回归模型分析

3 讨论
在本组接受手术治疗的膀胱癌病例中,NMIBC和肿瘤分期为T2~T4的患者比例较高,部分患者出现了淋巴结转移。早期诊断和及时治疗是改善膀胱癌患者预后的有效手段,据调查[7]早期膀胱癌术后5年生存率可达到94%,但患者的整体5年生存率不足50%[8],低早期诊断率和高复发率一直是影响患者预后的主要因素。约有5%的膀胱癌患者在确诊时已发生转移,如不能得到及时诊治,有10%~30%的NMIBC患者可发展为预后不佳的MIBC,而NMBIC患者在手术和灌注化疗后的5年复发率仍为30%~80%,约有30%的复发病例会出现肿瘤的恶性度增加[9]。仅依靠传统的膀胱镜检查,会有10%的膀胱癌病灶被漏诊,对于原位癌的诊断敏感度较低[10]。因此,肿瘤标志物成为了在膀胱癌早期诊断、复发监测及预后评估中应用较多的辅助诊断指标,但至今尚未寻找到能够适应临床需求的理想肿瘤标志物,这仍然是一项重要的临床科研任务。
血清miR-144水平对于膀胱癌的辅助诊断具有一定的价值,且与患者的术后生存期具有相关性,较低的血清miR-144水平可提示膀胱癌的发生和预后不良。膀胱癌的发病机制十分复杂,多种microRNAs与膀胱癌发生风险、临床特征及预后相关。miR-144前体就是以miR-144/miR-451簇的形式存在,且在红细胞中呈现高表达,能够对红系分化发育发挥重要的调节作用,在β珠蛋白合成障碍性贫血红系疾病的发生、发展中扮演着重要角色。近年来的研究证实,miR-144与肿瘤、心脑血管病、肺部炎症性疾病、神经系统疾病等的相关性也被逐渐揭示[11],其在肿瘤发生和发展中的作用机制主要是通过糖皮质激素调节蛋白激酶3、细胞周期蛋白B1、酪氨酸激酶受体/丝苏氨酸蛋白激酶、果蝇蛋白激酶、Wnt/β-连环蛋白等多种信号通路对恶性肿瘤细胞的增殖、迁移、侵袭等生物学行为进行负向调控,其上游调控基因包括了lncRNA HCG11、LncRNA SNHG14、lncRNA MEG3等[12]。但在膀胱癌的研究报道中则存在着一定的争议,有报道[13]称,膀胱癌组织中miR-144阳性表达率要高于癌旁对照组织,且其表达水平随着肿瘤的临床分期进展而提升,存在盆腔淋巴结转移的肿瘤组织miR-144表达显著高于无淋巴结转移者,肿瘤组织中高表达的miR-144可能提示了膀胱癌的转移和病情进展;但另外有研究[14]显示,膀胱癌患者的血清miR-144水平明显低于健康人群,其水平与肿瘤分期、淋巴结转移具有相关性,而且血清miR-144低表达患者的3年总生存率要低于血清miR-144高表达患者,与本研究结果基本一致。上述研究结论的差异可能与研究样本的异质性有关,也可能是缘于miR-144在膀胱癌组织和患者外周血中变化机制的差异,这需要进一步的研究予以讨论。本研究认为,血清miR-144水平的下降可提示膀胱癌的发生,并与患者的不良预后有关,故可将其作为一种新型血清标志物用于辅助膀胱癌的早期诊断和预后评价。但是,相关研究[15]证实,骨质疏松、活动期肺结核、脑胶质瘤等良性疾病也能够导致患者血清miR-144水平降低,因此,在应用血清miR-144针对膀胱癌进行早期诊断和预后评价时,应注意对患者的基础疾病进行诊断和识别,以减少混杂因素的影响。
综上所述,膀胱癌患者表现为血清miR-144水平的降低,其水平与患者的预后具有相关性,较低的血清miR-144水平提示着患者不良预后的出现,血清miR-144可作为一种潜在的肿瘤标志物以用于辅助膀胱癌的早期诊断和预后评价。
