急性呼吸窘迫综合征患者血清KL-6、sTM水平与病情及预后的关系研究
2021-07-13宋然祁红辉李雪王晓君郭瑞霞刘健
宋然,祁红辉,李雪,王晓君,郭瑞霞,刘健
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种具有高发病率和病死率的炎性反应性肺损伤,占全部重症监护病房(ICU)患者的10.4%,占需要机械通气患者的23.4%,是ICU患者死亡的主要原因[1]。目前缺乏有效的治疗手段,尽管呼吸支持技术不断提高,ARDS患者整体生存率有所提高,但病死率仍高达40%[2]。诊断ARDS较为依赖个人经验,但由于其起病急、发病原因不明确的特点,寻找与ARDS病情和预后密切相关的生物标志物对于该病的病情评估和预后判断意义重大。Ⅱ型肺泡细胞表面抗原-6(Kerbs yon Lungren 6,KL-6)是一种新发现的黏液样糖蛋白,可表达于支气管上皮细胞和肺泡Ⅱ型细胞,具有高度组织特性,与肺泡上皮细胞损伤有关,是肺间质性疾病的敏感标志物[3]。可溶性血栓调节蛋白(sTM)是一种具有抗炎、抗凝和细胞保护作用的内皮蛋白,是内皮损伤的生物标志物[4-5]。肺血管内皮损伤与ARDS发病有密切关系,推测sTM可能参与ARDS病情进展。血清KL-6、sTM与ARDS患者病情和预后的关系尚不明确,现对此进行分析,以期为ARDS危险分层和预后评估提供理论基础,报道如下。
1 资料与方法
1.1 临床资料 选取2016年5月—2019年3月河北省邯郸市第一医院呼吸与危重症医学科二病区收治ARDS患者105例,男56例,女49例,年龄45~60(52.65±3.71)岁;临床症状:呼吸急促53例,口唇紫绀35例,呼吸窘迫27例,胸闷64例,意识障碍19例。根据入院24 h内评估氧合指数(PaO2/FiO2)结果分为轻度组33例(PaO2/FiO2201~300 mmHg),中度组42例(PaO2/FiO2101~200 mmHg),重度组 30例(PaO2/FiO2≤100 mmHg);105例患者根据住院28 d内死亡情况又分为死亡亚组39例和存活亚组66例。本研究获得医院伦理委员会批准(审批号:L2016DYYY02115),患者家属均知情同意并签署知情同意书。
1.2 选择标准 (1)纳入标准:①符合2012年柏林新定义ARDS诊断标准[6];②均入住ICU,接受机械通气治疗。(2)排除标准:①心源性肺水肿、神经源性肺水肿;②入院前应用接受激素治疗者;③中途转院治疗者;④心力衰竭或液体过负荷引起呼吸衰竭。
1.3 观察指标与方法
1.3.1 血清KL-6、sTM检测:患者入院后24 h内采集清晨空腹肘静脉血5 ml,以TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)离心取血清保存于-70℃低温冰箱(日本三洋电器股份有限公司),48 h内待检。上述血清采用酶联免疫吸附试验检测血清KL-6、sTM水平,仪器为瑞士Hamilton FAME全自动酶联免疫分析仪,试剂盒购自美国R&D公司。
1.3.2 血生化指标检测:上述血清采用Bayer2400型(德国)全自动生化分析仪检测总蛋白(TP)、白蛋白(AIb)、尿素氮(BUN)、血肌酐(SCr)。
1.3.3 血气分析检测:动脉氧分压(PaO2)、吸入氧浓度(FiO2),动脉二氧化碳分压(PaCO2)、PaO2/FiO2采用GEM Premier3000(美国)全自动床旁血气分析仪检测。
2 结 果
2.1 不同预后患者临床资料比较 死亡亚组入院24 h内APACHE Ⅱ评分、入院24 h内SOFA评分、潮气量、平均气道压力、机械通气时间≥3 d占比、ICU住院时间≥10 d占比、FiO2高于存活亚组,PaO2、PaO2/FiO2低于存活亚组(P<0.05),死亡亚组、存活亚组性别、年龄、肺损伤原因、基础疾病、气道峰值压力、呼气末正压、有创治疗、BUN、SCr、TP、Alb、PaCO2比较差异均无统计学意义(P>0.05),见表1。

表1 不同预后ARDS患者临床资料比较
2.2 3组不同病情程度患者血清KL-6、sTM水平比较 血清KL-6、sTM水平比较,轻度组<中度组<重度组,即随着ARDS患者病情的加重而升高(P<0.01),见表2。

表2 3组ARDS患者血清KL-6、sTM水平比较
2.3 不同预后亚组血清KL-6、sTM水平比较 死亡亚组血清KL-6、sTM高于存活亚组(P<0.01),见表3。

表3 2亚组ARDS患者血清KL-6、sTM水平比较
2.4 影响ARDS患者预后的危险因素分析 以ARDS患者预后为因变量(0=存活,1=死亡),入院24 h内SOFA评分、入院24 h内APACHE Ⅱ评分、潮气量、平均气道压力、PaO2、FiO2、PaO2/FiO2、机械通气时间(1=≥3 d,2=<3 d)、ICU住院时间(1=≥10 d,2=<10 d)、血清KL-6、sTM为自变量,建立多元Logistic回归模型,校正性别、年龄混杂因素,最终入院24 h内SOFA评分、PaO2、FiO2、PaO2/FiO2、KL-6、sTM水平均是ARDS不良预后的危险因素(P<0.01),见表4。
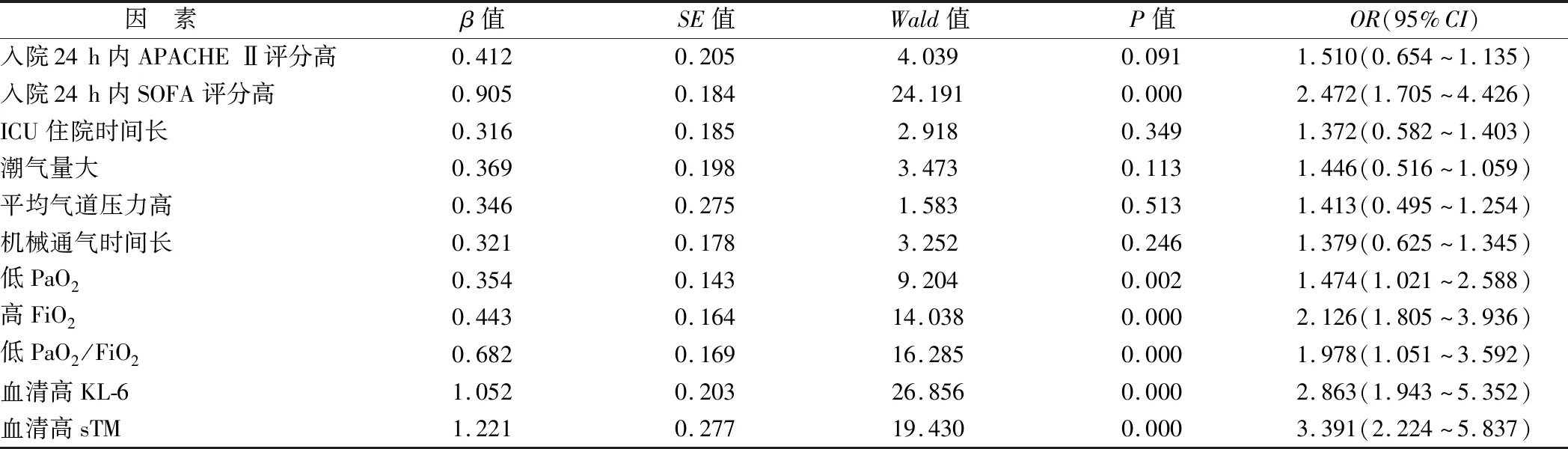
表4 影响ARDS患者预后的多元Logistic回归分析
2.5 血清KL-6、sTM预测ARDS患者预后的价值 ROC分析结果显示,血清KL-6、sTM及二者联合预测ARDS患者预后的曲线下面积(AUC)为0.812(95%CI0.720~0.904)、0.752(95%CI0.654~0.850)、0.904(95%CI0.830~0.979),最佳截断值(cut-off)为412.26 U/ml、97.93 μg/L,二者联合AUC大于KL-6、sTM单独预测(Z=2.026、2.316,P<0.05),见图1、表5。

表5 血清KL-6、sTM预测ARDS患者预后的效能比较
3 讨 论
ARDS是一种异质性疾病,多种致病性因素可导致肺损伤,引起非静压性血管外肺水肿、顺应性降低、严重低氧血症和急性呼吸衰竭。酗酒、主被动吸烟、环境污染、臭氧暴露、肺部感染、败血症、创伤、维生素D缺乏等是ARDS公认的危险因素[7-8]。ARDS缺乏有效的预防和救治措施,目前临床治疗以对症支持性治疗为主,尽管近年来对ARDS分子机制研究不断深入,通气策略不断改进,但是其病死率仍居高不下[9]。测定肺损伤相关生物标志物对于及时发现ARDS,评估病情和预后有重要意义。
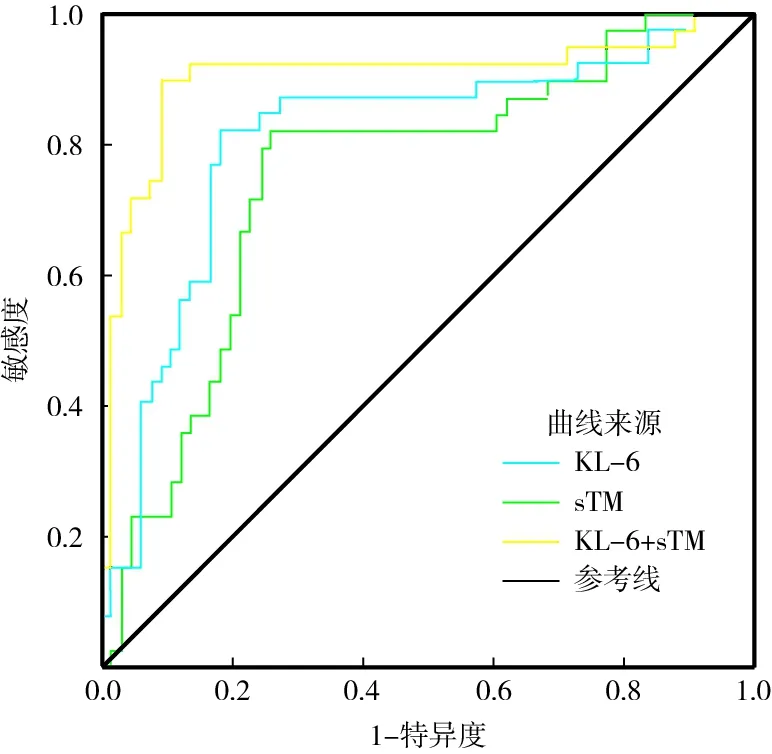
注:ARDS.急性呼吸窘迫综合征;KL-6.Ⅱ型肺泡细胞表面抗原-6;sTM.可溶性血栓调节蛋白;ROC.受试者工作特征曲线
KL-6是Ⅱ型肺泡上皮细胞分泌的高分子糖蛋白,在增殖、再生或损伤的Ⅱ型肺泡细胞中高度表达,在上皮细胞膜表面S-S键断裂后弥散到肺泡表面及肺上皮内膜液中,发挥降低肺泡表面张力,防止肺泡萎缩作用[10]。肺损伤初期Ⅱ型肺泡上皮细胞再生,分泌大量KL-6,KL-6经肺泡渗入血液导致血清浓度升高[11]。KL-6在单纯性间质性肺炎、胶原血管疾病相关间质性肺炎、过敏性肺炎、结节病、肺癌和结核病等多种呼吸系统疾病中水平升高,被广泛用作肺泡损伤或肺泡炎性反应标志物[12]。Koyama等[11]发现KL-6在ARDS患者明显增高,在鉴别诊断ARDS方面具有较高价值(AUC=0.90),KL-6与ARDS病情和预后的关系尚未完全阐明,目前鲜有报道。本研究结果表明,血清KL-6水平随着氧合指数的降低而逐渐升高,提示随着肺损伤加重肺氧合能力逐渐降低,KL-6合成增加,KL-6水平可反映ARDS患者病情严重程度,死亡亚组血清KL-6水平高于存活亚组,Logistic回归分析结果提示,血清KL-6是ARDS患者预后预测的一个有用指标。Kondo等[13]发现血清中KL-6浓度高于530 U/ml时,ARDS患者确诊后90d生存率显著降低,说明血清KL-6水平与ARDS预后有关,这是因为KL-6是肺泡Ⅰ型细胞损伤后,由增殖肺泡Ⅱ型细胞产生和释放,其水平反映肺泡上皮损伤的严重程度,而肺泡上皮损伤程度与ARDS患者预后密切相关[14-15],因此过高KL-6水平是严重肺泡上皮损伤的一个敏感指标,也是ARDS不良预后的一个预测因子。
sTM是分布于血管内皮细胞的一种跨膜糖蛋白,具有抑制内皮细胞增殖分化、抗炎、抗黏附作用,在维持内皮环境稳定方面发挥重要作用[16]。sTM还可通过激活蛋白C、凝血酶增加蛋白水解,发挥抗凝作用[17]。氧化应激、炎性反应、缺血再灌注损伤可抑制sTM表达,降低其抗凝、抗炎、抑制肿瘤浸润及转移的功能[18]。sTM在肺毛细管也有广泛表达,sTM水平与肺损伤密切相关,是肺损伤的重要标志物[19]。本研究说明,血清sTM水平升高反映ARDS患者肺血管内皮损伤的严重程度,有助于评估患者病情。死亡亚组血清sTM水平高于存活亚组,表明sTM可用于预测ARDS患者不良预后的发生。sTM参与ARDS病情进展和不良预后的可能机制为:ARDS肺毛细血管内皮细胞损伤可导致细胞对血管壁的黏附增强,放大炎性反应,促使血液高凝状态,导致微血管血栓形成[20]。炎性反应刺激下,中性粒细胞弹性蛋白酶、内毒素和肿瘤坏死因子-α诱导内皮细胞释放合成大量sTM,导致血清sTM水平升高。过度释放的sTM生物利用度降低,并通过激活中性粒细胞和成纤维细胞,破坏内皮完整性,造成肺泡表面活性剂活性降低,加重ARDS患者炎性反应[21]。本研究ROC分析结果显示,血清sTM对ARDS患者预后具有一定预测价值,Sapru等[22]发现血浆sTM水平预测ARDS患者60 d死亡的AUC 为0.72(95%CI0.66~0.78),提示sTM可用于ARDS患者预后的预测。联合血清KL-6、sTM显著提高了对ARDS预后预测的准确性,说明血清KL-6、sTM水平同时升高的ARDS患者具有更高的死亡风险。
综上,ARDS患者血清KL-6、sTM水平明显升高,KL-6、sTM水平升高与ARDS患者病情严重程度和不良预后有关,可用于预测ARDS患者28 d内死亡事件风险。
利益冲突:所有作者声明无利益冲突
作者贡献声明
宋然:设计研究方案,实施研究过程,论文撰写,论文修改;祁红辉、李雪:参与研究过程,病例资料搜集整理;王晓君、郭瑞霞:进行数据收集及统计学分析;刘健:提出研究思路,分析试验数据,论文审核
