桥延部肿瘤显微外科手术后神经源性肺水肿6例分析
2021-07-13郭阳阳石广志张铮徐明周建新
郭阳阳,石广志,张铮,徐明,周建新
神经源性肺水肿(neurogenic pulmonary edema,NPE)是指在无原发性心、肺、肾等疾病的情况下,由于颅脑损伤或中枢神经系统疾病引起颅内压急剧增高,而发生的一种严重肺部并发症,以急性肺水肿为特征性临床表现[1-2]。通常起病急,进展快,缺乏早期、特异性的诊断及治疗手段,病死率很高,但早期恰当的治疗通常恢复迅速[3-4]。许多神经系统疾病都可导致NPE的发生,包括蛛网膜下腔出血、创伤性颅脑损伤、大面积脑梗死、脊髓损伤、癫痫发作和癫痫持续状态、脑膜炎、多发性硬化等[2]。而有关桥延部肿瘤显微外科手术后合并NPE的病例报道较少,难以从中寻找诊断、治疗的相关规律。现对笔者治疗的6例桥延部肿瘤显微外科手术后NPE患者临床资料进行总结及分析,报道如下。
1 临床资料
1.1 一般资料 2018年1月—2020年12月首都医科大学附属北京天坛医院重症医学科收治6例患者,其中男2例,女4例;儿童1例(9岁),成人5例(年龄37~60岁)。4例患者术前无合并症,1例患者术前合并糖尿病、高血压及右侧肾切除后,1例患者既往乳腺癌病史。6例患者术前均出现颅内高压或后组颅神经受侵的症状,其中术前吞咽困难及饮水呛咳者3例,行走不稳3例,头晕、头痛5例,肢体麻木1例,吐字不清1例。6例患者均于全麻下行颅内肿物切除术,术中常规行电生理监测,手术时间4~6 h,失血量100~400 ml。患者手术病理结果为血管母细胞瘤4例(WHOⅠ级),室管膜瘤1例(WHO Ⅱ级),髓母细胞瘤1例(WHO Ⅳ级),见表1。
1.2 NPE诊断依据[1](1)双侧肺部浸润性病变;(2)氧合指数(PaO2/FiO2)<200 mmHg;(3)除外左心房高压;(4)存在中枢神经系统病变;(5)除外其他导致急性呼吸系统疾病或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的常见原因(如误吸、大量输血、脓毒症等)。
1.3 临床表现 6例患者入ICU时均带气管插管,急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)8~19分,其中15分以上者1例。格拉斯哥昏迷评分(GCS)8~10分,除1例儿童患者神志不清外,其余成人患者均神志清楚。4例患者于术后当天出现心率、血压及空腹血糖(术中补液均使用乳酸钠林格液)明显高于基础值。NPE发生时间为术后2~7 d,其中4例发生在术后第4天。所有患者均有发热(37.9~38.7℃),且表现为严重的低氧血症,呼吸窘迫,氧合指数<200 mmHg,其中2例患者氧合指数低于100 mmHg。听诊双肺可闻及明显的湿啰音。其中1例患者术后后组颅神经损伤明显,患者出现呼吸障碍,机械通气时间延长;3例患者在NPE病程后期合并肺部感染,见表1。
1.4 实验室检查 NPE诊断当天,患者白细胞计数多处于正常范围或轻度升高,降钙素原(procalcitonin,PCT)均未见明显升高。6例患者痰液均呈白色稀薄状,痰细菌学检查均为阴性,血气分析显示无二氧化碳蓄积。血浆白蛋白(albumin,Alb)水平降低(22.8~34.7 g/L),见表1。
1.5 影像学检查 NPE患者胸部X线检查表现为双侧肺野的透光度下降,双肺渗出性改变。胸部CT检查示双肺多发病灶,病灶呈大片状及斑片状,大小不一,两侧病灶分布基本对称,见表1。
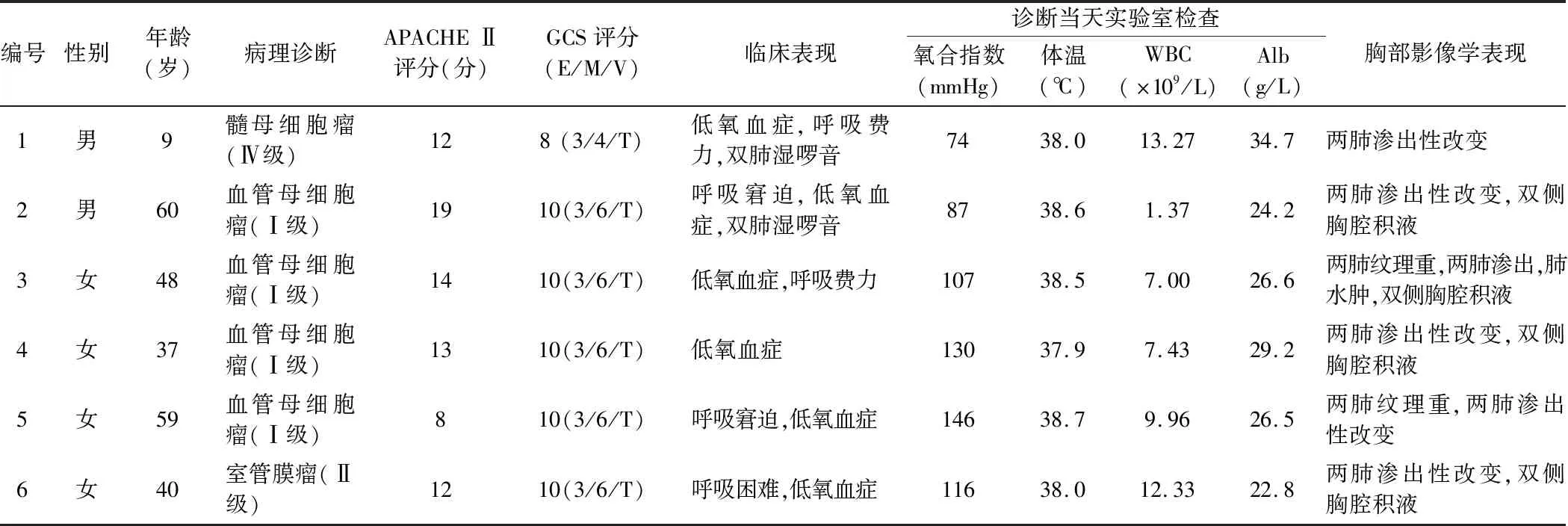
表1 桥延部肿瘤显微外科术后6例NPE患者的临床资料
1.6 治疗与转归 采取的主要治疗方法包括:(1)降低颅内压,常规采用甘露醇脱水及激素减轻脑水肿,部分脑水肿严重患者加用白蛋白及速尿(呋塞米)。(2)改善氧合,所有患者均术后保留气管插管,予机械通气及阶梯性增加呼气末正压(positive end expiratory pressure,PEEP)改善氧合。6例患者PEEP设置峰值8~18 cmH2O,较高PEEP支持条件下未见气压伤等不良结局。(3)液体治疗,监测24 h出入量、中心静脉压(central venous pressure,CVP)及脑钠肽(brain natriuretic peptide,BNP)等,在保证血流动力学稳定及脑灌注的基础上避免液体过负荷。(4)抗感染治疗,NPE患者易合并肺部感染,有感染证据时,即予以有效抗感染治疗。(5)营养,患者术后合并NPE,导致机体能量代谢增多,需保证能量供给,保证热氮比。低白蛋白血症引起血浆胶体渗透压降低,会进一步加重肺水肿,故需严密监测血浆白蛋白,及时予以补充。(6)其他,纠正水电解质、酸碱失衡及其他对症治疗。
转归:本组6例患者全部治愈出院。5例患者行气管切开术,1例患者拔管成功。6例患者机械通气时间5~29 d,平均15.8 d;6例患者ICU住院时间11~62 d,平均29 d。
2 讨 论
NPE与ARDS临床表现相似,但无心源性或肺源性功能障碍[1-3,5]。关于NPE的发病机制至今尚未明确,多数认为常见的触发因素是颅内压突然升高,导致脑血流量的整体下降或NPE触发区的局部缺血。关于NPE的触发区,一般认为包括下丘脑和延髓,尤其是A1和A5区。其中A1区位于延髓腹外侧,由一群富含儿茶酚胺的神经元组成;A5区位于延髓上部[3,5-6],本组6例桥延部肿瘤手术区域即位于或邻近NPE触发区。损伤A1区或A5区均可导致交感神经系统过度激活,儿茶酚胺大量释放。释放的儿茶酚胺一方面使体循环、肺循环血管收缩,导致血压异常升高和肺静水压升高;另一方面大量释放的儿茶酚胺可通过直接损伤肺部或释放大量细胞因子,导致肺通气/血流比失调和肺毛细血管通透性升高,血浆蛋白外渗,导致肺水肿的发生[6-7]。
关于NPE的发病时间及病程,有文献报道NPE发生可分为早期和延迟,且症状通常在发病后48~72 h内消失[8]。而本组6例NPE患者的发生时间为术后2~7 d,且病程较长(4~14 d),这或许是中枢神经系统桥延部局部损伤与弥漫性损伤(SAH、颅脑伤创等)并发NPE的病例特点的不同之处。
临床表现方面,本组病例的肺部病变特征与文献报道一致[9-10]。但在神经系统表现方面,除1例儿童患者神志不清外,其余5例成年患者在并发NPE时均神志清楚,这有别于既往文献中NPE患者多为神志昏迷的描述(可能与既往NPE多在严重颅脑损伤或SAH等患者中进行报道有关)[10-12]。故对此类病例来说,提示临床医生不应根据患者的神志来评估其发生NPE的危险性。桥延部肿瘤患者常合并呛咳及吞咽反射异常,易发生术后肺部感染,临床医生需根据患者的各项实验室检查与NPE进行仔细鉴别。若未及时准确诊断NPE,仅单纯进行抗感染治疗,则往往效果不佳,导致NPE病程延长[13]。
及时正确的治疗是改善NPE预后的关键。除了积极治疗中枢神经系统原发病,还应改善氧合、有效减少肺水肿、积极控制感染。在通气策略方面,适当增加PEEP可有效扩张小气道和肺泡,增加肺泡内压力,抑制毛细血管渗漏,减轻肺水肿;同时PEEP可防止肺泡陷闭,增加功能残气量,改善氧合,缩短机械通气时间,有效降低患者病死率[14]。关于PEEP过高导致颅内压升高进而影响脑灌注压的问题,也有研究结果表明,PEEP增加至15 cmH2O时对脑灌注压无影响[3]。在本组患者中,PEEP设置的峰值范围为8~18 cmH2O,在较高PEEP支持条件下未见气压伤、脑灌注降低等不良结局。液体治疗对NPE的改善也至关重要,对NPE患者进行出入量监测及血流动力学监测,可在保证血流动力学稳定及改善脑灌注的前提下,尽量减少循环液体负荷,减轻肺水肿。有学者对并发NPE的神经重症患者进行脉搏指示连续心排血量(pulse indicator continous cadiac output,PiCCO)监测,结果认为不增加或降低血管外肺水指数(extravascular lung water index,EVLWI)是有效减少和防止肺水肿的重要治疗方向[13,15]。提高血浆ALB有利于增加循环血胶体渗透压,减轻肺水肿,故对NPE患者还需注意血浆白蛋白的监测及补充。
利益冲突:所有作者声明无利益冲突
作者贡献声明
郭阳阳:病例数据收集,分析数据,论文撰写;石广志:提出研究思路,论文审核;张铮、徐明、周建新:资料整理,论文修改
