淋巴瘤相关静脉血栓的影响因素及风险评估模型的研究进展
2021-07-12杨婧诗邹立群
杨婧诗,邹立群
恶性肿瘤相关静脉血栓(VTE)是一种严重的并发症,因其致死率高以及治疗后出血或血栓复发等特点,逐渐受到研究人员重视[1]。淋巴瘤患者亦是VTE生成的高危人群。然而,目前的一些肿瘤相关VTE预测模型,如Khorana评分[2](Khorana score,KRS评分)以及ThroLy评分[3](ThroLy score,TS评分)对淋巴瘤相关VTE的预测价值欠佳,不利于对淋巴瘤相关VTE的预防。因此,本文就淋巴瘤相关VTE的影响因素及预测模型作一综述,以期对淋巴瘤相关VTE防治有进一步认识。
1 淋巴瘤疾病相关VTE危险因素
不同淋巴瘤类型,其VTE发生率不同。一般来说,Ⅲ/Ⅳ期淋巴瘤患者的VTE发病率较Ⅰ/Ⅱ期患者高。高级别侵袭性淋巴瘤的VTE发病率较惰性低级别淋巴瘤发病率高。一些高级别的淋巴瘤VTE发病率可达到10%以上,而对于一些低级别的淋巴瘤VTE发病率则为5%以下[4-5]。其中,VTE发病率最高的淋巴瘤类型是中枢神经系统(central nervous system,CNS)淋巴瘤。CNS淋巴瘤的发病率为59.5%,致死率为7%[6]。CNS淋巴瘤发病率最高的原因可能有以下几个方面:(1)CNS淋巴瘤患者大多因疾病而出现四肢肌力下降以及活动能力下降,长期制动成为CNS淋巴瘤患者VTE形成的危险因素之一[7]。(2)CNS淋巴瘤患者会接受高强度的化疗。甲氨蝶呤是CNS淋巴瘤治疗的重要化疗药物之一,其为一种抗叶酸类抗肿瘤药物,能够通过血-脑脊液屏障。有研究报道,甲氨蝶呤也是VTE生成的危险因素之一[8]。(3)为了缓解患者的脑水肿症状而使用激素也可能是VTE形成的原因之一[9]。
2 临床检验指标
2.1 D-二聚体 D-二聚体是纤溶酶分解纤维蛋白多聚体的产物,是反映纤维蛋白溶解功能的指标。D-二聚体对于实体肿瘤来说是VTE形成的危险因素[10]。此前研究表明,在肿瘤患者中,D-二聚体升高会增加血液系统肿瘤(包括淋巴瘤及多发性骨髓瘤)VTE风险,而且与肿瘤患者的不良预后相关[11-12]。然而,NEGAARD等[13]的研究纳入了48名(51.6%,48/93)非霍奇金淋巴瘤(NHL)患者,主要对其治疗前后的血液标本进行分析,旨在研究血液系统肿瘤的高凝状态;该研究认为,在治疗之前,淋巴瘤相关的VTE与D-二聚体无关,但对于治疗之后未缓解的患者,其D-二聚体水平较治疗后缓解的患者显著增高(中位数为925.3 ng/ml vs 483.7 ng/ml),提示与D-二聚体相比,恶性肿瘤疾病本身对淋巴瘤高凝状态的影响更大。
2.2 平均血小板体积(mean platelet volume,MPV) MPV是用来衡量血小板大小的指标,与血小板的活性密切相关。RUPA-MATYSEK等[14]认为血小板活性异常会增加血栓生成风险并提示肿瘤患者的不良预后。两项回顾性研究显示,MPV能够作为霍奇金淋巴瘤(hodgkin lymphoma,HL)以及弥漫大B 细胞淋巴瘤[15](diffuse large B cell lymphoma,DLBCL)的危险因素。研究发现,MPV≤第25百分位数的HL患者有更高的VTE风险;对于DLBCL来说,MPV≤第10百分位数,VTE风险越高[14-16]。在RIEDL等[16]的一项名为维也纳癌症与血栓研究(Vienna Cancer and Thrombosis Study,CATS)中,将MPV纳入VTE风险因素分析,研究结果与上述研究大致相同,认为MPV与VTE风险呈负相关,MPV≥第75百分位数时,VTE风险较低。
2.3 乳酸脱氢酶与β2-微球蛋白 乳酸脱氢酶是一种糖酵解酶,是评估淋巴瘤预后的指标之一,也是淋巴瘤国际预后指数(IPI)的评估项目之一。YILDIZ等[17]回顾性研究认为与非VTE患者相比,VTE患者的乳酸脱氢酶水平处于较高水平。然而,在LI等[18]的一篇关于间变性淋巴瘤激酶(ALK)阳性间变大细胞淋巴瘤的案例报道中认为,乳酸脱氢酶与VTE风险关系不大。此外,在YILDIZ等[17]的研究中还发现,另一项与淋巴瘤预后相关的指标β2-微球蛋白可能也与VTE形成相关。PARK等[19]的试验认为,由于β2-微球蛋白是提示淋巴瘤肿瘤负荷的一个可靠指标,肿瘤负荷增加可导致肿瘤相关促凝因子的激活,如白介素6、肿瘤坏死因子α可诱导血小板以及凝血因子的激活,从而导致VTE风险增加。
2.4 血红蛋白及白细胞计数 VTE是一种富含红细胞的血栓,与充满血小板的动脉血栓不同,VTE被称为红色血栓。在淋巴瘤相关VTE的研究中发现,血红蛋白降低是VTE的一个危险因素,这可能与VTE形成消耗大量红细胞有关[20]。但在ZHOU等[8]的研究中则认为,高水平的基线血红蛋白与VTE形成有关,因此血红蛋白与VTE究竟是呈正相关还是负相关尚需进一步的研究论证。在KRS评分中将白细胞计数>11×109/L作为VTE的危险因素,而在ThroLy评分中则认为中性粒细胞计数<1×109/L是VTE的危险因素。但对于淋巴瘤等血液恶性肿瘤来说,肿瘤本身以及化疗等因素会导致中性粒细胞计数减少或伴发热等症状,因此,用白细胞计数或中性粒细胞计数来评判VTE风险是缺乏精准性的。
3 抗肿瘤治疗
3.1 门冬酰胺酶 淋巴瘤相关VTE风险在淋巴瘤诊断后的前3个月是最高的,并随着时间的推移而降低[3]。这种诊断前期的高VTE风险可能与化疗有关[3]。左旋门冬酰胺酶(L-asparaginase,L-asp)通过消耗循环血液中的门冬酰胺酶,从而诱导恶性淋巴瘤细胞死亡的方式来治疗淋巴瘤,特别是NK/T细胞淋巴瘤。另一方面,L-asp可能会破坏asp依赖的蛋白合成,包括参与凝血系统的蛋白[21],如抗凝血酶(antithrombin,AT)。门冬酰胺酶引起血栓生成的一个主要作用机制是降低AT的水平。AT是丝氨酸蛋白酶抑制剂的成员之一,在肝脏内合成,参与机体的抗凝过程。以人肝细胞癌细胞(HepG2)为实验对象发现,在细胞培养、老鼠模型以及患者的实验样本中,受asp影响,AT会在细胞内聚集而释放减少,由此增加出血和血栓形成的风险[22]。LEE等[23]对3 281例接受过L-asp治疗的淋巴细胞相关恶性肿瘤患者(急性淋巴细胞白血病及恶性淋巴瘤)进行分析,其中淋巴瘤患者37%(1 217/3 281),结果发现淋巴瘤患者在接受L-asp治疗后血栓形成的风险较高;并且,对于淋巴瘤患者来说,年龄是接受L-asp治疗后的淋巴瘤相关VTE患者的一个重要影响因素;成年淋巴瘤患者VTE风险是儿童淋巴瘤患者的2~3倍。
3.2 多柔比星及甲氨蝶呤 ZHOU等[8]认为多柔比星以及甲氨蝶呤会增加淋巴瘤相关VTE的风险。SANFILIPPO等[24]也认为多柔比星会增加相关VTE风险。多柔比星以及甲氨蝶呤是淋巴瘤常用的化疗药物,这两种化疗药物增加VTE的风险可能与蛋白质C、蛋白质S的水平降低及血小板黏附性增加有关[25]。此外,PAREDES等[26]以T24/83细胞系为模型探讨化疗药物对细胞表面凝血酶的影响发现,经甲氨蝶呤处理过的T24/83细胞能够上调组织因子mRNA的表达,从而增加凝血功能启动的概率。甲氨蝶呤还能增加同型半胱氨酸水平,同型半胱氨酸是血管损害的敏感性指标,其水平升高可能会导致血管内皮受损,从而增加VTE生成的风险。
3.3 R-CHOP与R-EPOCH R-CHOP方案以及R-EPOCH方案是NHL的常用治疗方案。两种方案中蒽环类药物是VTE形成的高危因素。然而,DAVID等[27]回顾性研究发现,与R-CHOP方案相比,R-EPOCH方案有更高的浅表VTE生成风险,而且浅表VTE生成与导管置入相关,特别是经外周静脉置管(PICC)方式的患者有更高的VTE生成风险,其原因可能是:(1)在该研究队列中,使用R-CHOP方案治疗的患者没有外周静脉或中心静脉置管(central venous chatheterization,CVC),从而减少了置管带来的相关血栓风险;(2)R-EPOCH方案需要静脉持续灌注时间较长,患者卧床时间的延长也是血栓形成的一个外在条件。而接受R-CHOP治疗的患者一般在门诊完成治疗,不需要住院治疗。
3.4 来那度胺 来那度胺是一种免疫调节剂,被推荐用于多发性骨髓瘤或骨髓异常综合征的治疗。此外,ARORA等[28]研究证明,来那度胺联合利妥昔单抗治疗惰性NHL显示出了广泛的应用前景。许多临床试验正在评估来那度胺联合化疗或靶向生物制剂(如利妥昔单抗)联合治疗B淋巴细胞来源的NHL(如滤泡细胞淋巴瘤,套细胞淋巴瘤)的疗效和安全性。另一方面,有研究证实,来那度胺可增加患者的VTE风险[29-31]。PAL等[32]在体外以及骨髓瘤患者的基础试验中证实了来那度胺会增加血栓风险的观点,其分析认为,来那度胺可以增加组织蛋白酶G的水平,组织蛋白酶G为一种血小板聚合激动剂,可激活血小板的活性,加速VTE的产生。因此,在使用来那度胺治疗期间,需使用阿司匹林这一抗血小板聚集的药物降低VTE风险。此外,临床试验研究方面,YAMSHON等[33]综合分析了28篇关于含来那度胺治疗的B淋巴细胞来源NHL的前瞻性研究,包括了患者的一般特征、治疗方案、周期以及VTE发生率等数据,结果提示B淋巴细胞来源NHL患者使用来那度胺治疗后的VTE发病率与接受来那度胺治疗后的骨髓瘤患者的VTE发病率一致;同时,无论来那度胺单药,或者联合化疗或者生物治疗,均有发生VTE的风险;值得关注的是,来那度胺联合生物制剂的风险最低,而单药使用来那度胺治疗发生VTE的风险最高。但对于淋巴瘤患者应用来那度胺治疗后的VTE预防措施还需进一步的研究。
4 VTE风险预测
4.1 KRS评分 KRS评分标准奠定了肿瘤相关VTE风险评估的基石[2]。KRS评分标准如下:(1)若为胃癌或胰腺癌患者记为2分;(2)若为肺、淋巴、妇科、膀胱或睾丸肿瘤患者记为1分;(3)若化疗前血小板计数≥350×109/L记为1分;(4)若白细胞计数>11×109/L记为1分;(5)体质指数(body mass index,BMI)≥35 kg/m2记为1分。KRS评分为0分时为血栓低风险,1~2分时为血栓中风险,3分及以上为高风险。美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)推荐[34],KRS评分≥2分的门诊肿瘤患者VTE风险较高,需要行VTE预防治疗。SANTI等[35]为验证KRS评分的VTE预测能力,综合分析了12项共1 717例意大利淋巴瘤患者的前瞻性研究,结果认为KRS评分越高,其VTE发生率越高,显示出KRS评分良好的VTE风险预测能力。然而,KRS评分应用于淋巴瘤患者人群的VTE风险预测仍存在一定的问题。其一,有研究认为,KRS评分的研究人群是从临床试验或者门诊人群获得的,而对于淋巴瘤患者来说,更多患者需要住院治疗。患者住院期间卧床,体能活动可能有所下降,对于VTE的形成也有一定的影响[36]。其二,KRS评分研究人群更注重于实体瘤人群,而纳入研究的淋巴瘤患者样本量较小,代表性不足。
4.2 Ottawa评分 Ottawa评分是用于评估抗凝治疗后的前6个月恶性肿瘤相关VTE复发风险的预测模型[37-38]。Ottawa评分原是一项包含TNM分期的二分类预测性模型,将VTE复发风险人群分为低风险VTE复发人群以及高风险VTE复发人群,后根据TNM分期、肿瘤类别等变量进一步细分形成了改良后的Ottawa评分。ALATRI等[39]为对改良后的Ottawa评分效能进行检验,研究纳入了11 123例在VTE诊断前6个月以及VTE诊断后4周被确认为患有实体肿瘤(皮肤基底细胞癌以及皮肤鳞状细胞癌除外)以及血液恶性肿瘤的患者。其主要评分细则为若为女性患者+1分,肺癌患者+1分,既往VTE患者+1分,乳腺癌患者-1分,无远处转移的局限性肿瘤-1分(实体瘤为Ⅰ~Ⅱ期),血液恶性肿瘤的患者为0分;患者在抗凝治疗后出现临床复发的定义为若上述评分≤-1分则为低危复发风险,若评分为0分则为中危,若评分≥1分则为高危VTE复发风险;其中血液系统肿瘤患者占7.2%(799/11 123),高危患者为330例;同时该研究结果提示,改良后Ottawa评分并不能精准预测VTE复发风险,同时可能会误导临床诊疗方案的实施。
4.3 Michigan评分 Michigan评分[40]是专为PICC相关VTE制定的风险评估标准,其评价标准主要包括:白细胞计数、PICC导管腔道情况、CVC和PICC是否同时存在、是否为肿瘤患者;根据上述情况对患者进行个体化评分,评分为1~4级,1~4级血栓发生率分别为:0.9%、1.6%、2.7%、4.7%。有文献指出,淋巴瘤相关VTE形成可能与CVC相关[41-42],但Michigan评分对评估淋巴瘤相关VTE的价值尚需进一步的大样本前瞻性研究加以验证。
4.4 TS评分 TS评分是ANTIC等[3]专为淋巴瘤患者设计的血栓生成风险相关模型,其优点在于不仅能够体现淋巴瘤相关VTE评分的专有性,同时较其他评分标准有更强的适用性。如KRS评分是一项观察性的研究结果,其重点可能更倾向于研究是否有中性粒细胞计数减少及其他VTE相关并发症,但对VTE发生率的研究较少。其评分细则主要包括一些实验室指标,如血红蛋白及中性粒细胞计数,又如淋巴瘤患者自身因素如BMI、体能状况,既往有无血栓、心力衰竭、脑卒中史,同时也包括了具有淋巴瘤特色的指标如是否有淋巴结外受累、纵隔受累等。TS评分根据分值高低分为低危组(评分为0~1分)、中危组(评分为2~3分)、高危组(评分为3分以上)。然而,RUPA-MATYSEK等[43]对TS评分进行了外部验证后发现,TS评分并不能精准预测淋巴瘤相关VTE风险;同时也提到,类似于BMI>30 kg/m2这一危险因素,部分淋巴瘤患者因为种族人群或者肿瘤消耗的问题并不能达到此项标准,用BMI>30 kg/m2来评价血栓风险其偏倚性较大;该研究还发现,中性粒细胞计数减少(<1×109/L)这一指标,在淋巴瘤治疗中常用的一些化疗方案如CHOP(环磷酰胺,吡柔比星,长春新碱,泼尼松)方案,ABVD(吡柔比星,博来霉素,长春新碱,地塞米松)方案均有导致中性粒细胞计数减少的可能,因此,无法辨别中性粒细胞计数减少是化疗导致还是诱发VTE的危险因素;同时,该研究数据指出淋巴结外受累可能也跟VTE生成的关系不大。因此,虽然TS评分专为淋巴瘤相关VTE风险预测,但预测性欠佳。
5 结语
长期以来,肿瘤患者具有较高的VTE风险,并且VTE是接受化疗的肿瘤患者的主要死亡原因之一[44]。然而,最近的研究表明,淋巴瘤也有相当高的VTE发生率[20]。虽然已有多项研究[8,20,23,27,36,45]对淋巴瘤相关 VTE 影响因素进行了分析(表1),但不同的研究纳入的人群及评价体系尚未完全统一,研究结果未达到公认、一致的标准,一些VTE风险预测评分也不具有广泛适用性。另一方面,对于一些大型的前瞻性肿瘤相关VTE影响因素的研究,淋巴瘤常被排除在临床试验之外,或在VTE临床试验中因样本量小而代表性不足。因此,应开展更多大样本的、前瞻性的临床研究以及淋巴瘤相关VTE生成机制的研究,进一步细化淋巴瘤患者的VTE风险,以便于对淋巴瘤相关VTE的防治作出更好地指导。
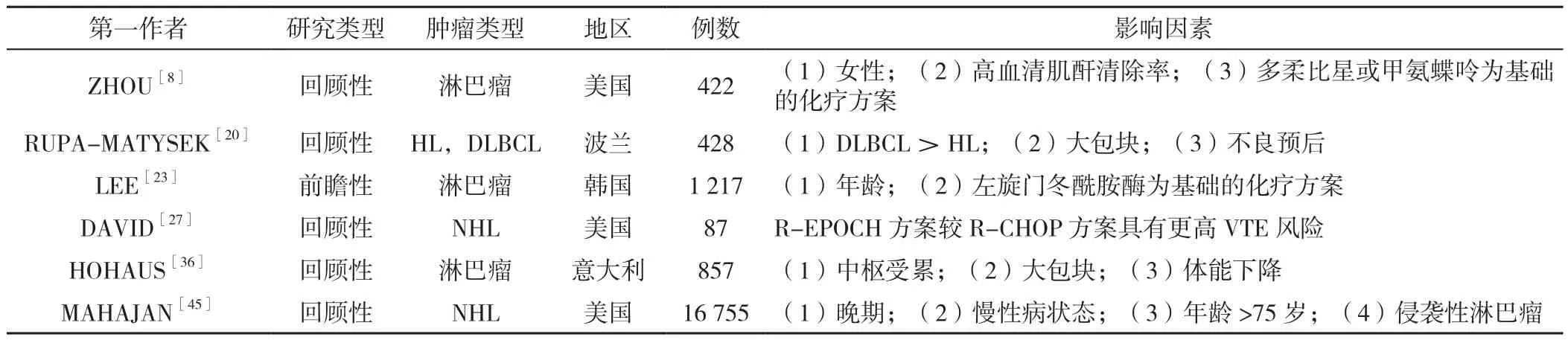
表1 淋巴瘤相关VTE影响因素分析的相关研究Table 1 Studies on influencing factors of lymphoma-associated VTE
作者贡献:杨婧诗、邹立群进行文章的构思与设计,检索文献,撰写论文;邹立群进行论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
本文文献检索策略:
检索数据库为PubMed数据库,检索关键词:lymphoma,venous thromboembolism,venous thrombosis,influence factors,prognostic model,forecasting。检索时间:2008年1月—2020年2月。文献纳入标准:(1)各研究假设和研究方法相似;(2)有研究开展或发表的年限;(3)各研究对样本大小有明确规定;(4)各研究中患者的选择和病例的诊断及其分期有明确标准,干预和对照的措施明确。排除标准:(1)重复报告;(2)存在研究设计缺陷,质量差;(3)数据不完整、结局效应不明确;(4)统计学方法错误且无法修正。
