吉西他滨较丝裂霉素治疗TURBT后非肌层浸润性膀胱癌的复发率低、毒副作用小:基于随机对照试验的荟萃分析
2021-07-12彭磊蒙春杨李金泽李云祥李进铭赵攀韦堂墙伍季
彭磊,蒙春杨,李金泽,李云祥*,李进铭,赵攀,韦堂墙,伍季
膀胱癌(bladder cancer,BC)是侵袭性极强的泌尿系恶性肿瘤之一[1-2]。全球每年约有55万新增的BC患者,20万人因此死亡[3]。除某些特殊的职业暴露外,吸烟是罹患膀胱癌的主要原因,随着女性吸烟率的增高,女性患膀胱癌的归因风险已明显升高[4-5]。非肌层浸润性膀胱癌(non-muscular invasive bladder cancer,NMIBC)约占初发膀胱恶性肿瘤的70%,经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)广泛普及于临床,是治疗NMIBC的标准术式。浅表性膀胱肿瘤术后复发率较高,正确选择术后膀胱内灌注化疗(bladder infusion chemotherapy,BIC)药物,规律及时化疗不仅是预防膀胱癌复发的重要措施,更能明显提高患者术后生存质量,延长患者总体生存时间[6]。
丝裂霉素(mitomycin,MMC)是常用的BIC药物[7]。近年来,吉西他滨(gemcitabine,GEM)也在局部进展和转移性晚期膀胱癌的治疗中取得良好效果[8-9]。MMC和GEM均是影响DNA完整性的细胞毒剂,其分别通过诱导DNA损伤、干扰DNA修复或形成损伤诱导的DNA复合物来影响肿瘤细胞的复制,从而抑制肿瘤的生长[10]。选择控制肿瘤复发效果好且安全有效的灌注药物对于临床意义重大,目前对于两种药物间的临床疗效和毒副作用差异尚无定论。本文通过系统检索国际上已发表的随机对照试验(randomized controlled trials,RCT),评估两种药物治疗TURBT后NMIBC的有效性与安全性,为临床用药提供更好的循证医学依据。
本文创新点:
吉西他滨(GEM)和丝裂霉素(MMC)均是治疗非肌层浸润性膀胱癌(NMIBC)的常用化疗药物,但是两者在肿瘤控制效果与毒副作用的研究上还缺乏循证医学证据,本文从循证医学角度出发,使用系统评价和荟萃分析的方法,发现使用GEM进行灌注的NMIBC患者的2年复发率、总体并发症发生率更低,而在1年复发率、血尿、肝肾功能损害等并发症上,GEM组与MMC组间无统计学差异,因此使用GEM和MMC均是有效的膀胱灌注化疗药物,且GEM引起的并发症更少。
1 资料与方法
1.1 文献检索策略 计算机系统检索PubMed,EMBase,Web of Science,The Cochrane Library,中国知网(CNKI),万方数据知识服务平台,中国生物医学文献数据库(CBM),维普网(VIP),时间设定为从数据库建立到2020-10-01,文献语种设定为英文和中文。中文检索词:“丝裂霉素”“吉西他滨”“膀胱灌注”“化疗”“膀胱恶性肿瘤”“膀胱癌”“非浸润性膀胱癌”“随机对照试验”。英文检索词:“Mitomy cin”“Gemcitabine”“Bladder perfusion”“Bladder infusion chemotherapy”“Bladder tumor”“Bladder cancer”“Nonmuscular invasive bladder cancer”“Non-invasive bladder cancer”“Randomized controlled trial”“RCT”。对所纳入的研究中的参考文献和重要的会议、硕博论文也进行手工检索。
1.2 纳入、排除标准 将对比了GEM和MMC治疗TURBT后NMIBC的研究纳入本研究中,根据Cochrane系统评价手册推荐的PICO原则筛选文献。纳入标准:(1)RCT;(2)研究对象:经病理活检确诊为NMIBC,并进行了TURBT的初发或复发BC患者,且随访时间≥1年;(3)干预措施:在TURBT后使用GEM行BIC为GEM组,使用MMC为MMC组;(4)结局指标应包括患者的肿瘤复发情况、毒副作用等。排除标准:(1)前瞻性非RCT研究、回顾性研究、病案分析、评论、信函综述或书籍;(2)合并其他系统性疾病或转移性恶性肿瘤、除TURBT外同期还施行了其他手术;(3)研究数据不可获取,无所需指标数据,试验数据不全的研究;(4)研究数据来源于动物实验、理论实验、计算机实验。
1.3 所纳入文献的证据质量评价与结局指标的证据级别 所纳入的原始研究均为RCT,故使用改良的Jadad量表对文献质量进行评分,量表总计7分,由随机序列的产生、随机化隐藏、盲法、撤出和退出组成,独立对各个部分进行评分,得分超过4分可视为高质量研究。对最终所得的Meta分析结果使用GEADEpro 3.2版本进行证据质量评级,高等级质量的结局指标使用⊕⊕⊕⊕表示,而⊕○○○则表示极低质量的证据。此步骤由两名研究员单独完成,并通过第三位研究员的介入来核对并解决有争议之处。
1.4 数据提取 使用标准的Excel表格对所纳入的研究进行独立的数据提取和录入。所提取的数据应包含基线数据和结局指标两类,基线数据应包括:第一作者、发表年份、研究设计类型、证据等级、年龄、样本量、肿瘤生长情况、肿瘤WHO分级、TNM分期、药物灌注剂量等。结局指标应包括:肿瘤复发情况(术后1年肿瘤复发率或术后2年肿瘤复发率),发生不良事件(adverse events,AE)的类型(膀胱刺激征、血尿、肝肾功能损害、皮疹、恶心呕吐、耻骨上疼痛等其他并发症)。
1.5 统计学方法 使用Stata 16.0(StataCorp LP,University City,Texas,USA)进行数据的统计学合并及最终的元分析。I2和Q检验来评估各指标所纳入的研究间的异质性,当I2<50%,P≥ 0.10时可认为各研究间异质性显著[11],采用随机效应模型进行Meta分析,反之采用固定效应模型进行Meta分析。根据所提取的数据类型,采用比值比(odds ratio,OR)对二分类变量进行评价,并给出所得OR的95%可信区间(confidence interval,CI);对异质性过高的研究结果(I2<75%)进行敏感性分析和亚组分析,以降低研究间的异质性,使最终荟萃分析结果更具循证医学意义。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果及纳入研究的基本情况 最终有7篇RCT被纳入Meta分析中,其中包括1篇英文研究[12],6篇中文研究[13-18]。图1展示了文献检索及纳入、排除流程;各研究的基线情况详见表1;基于Jadad量表的文献质量评分,其中5分以上(包含5分)的研究共计4项,见表2。
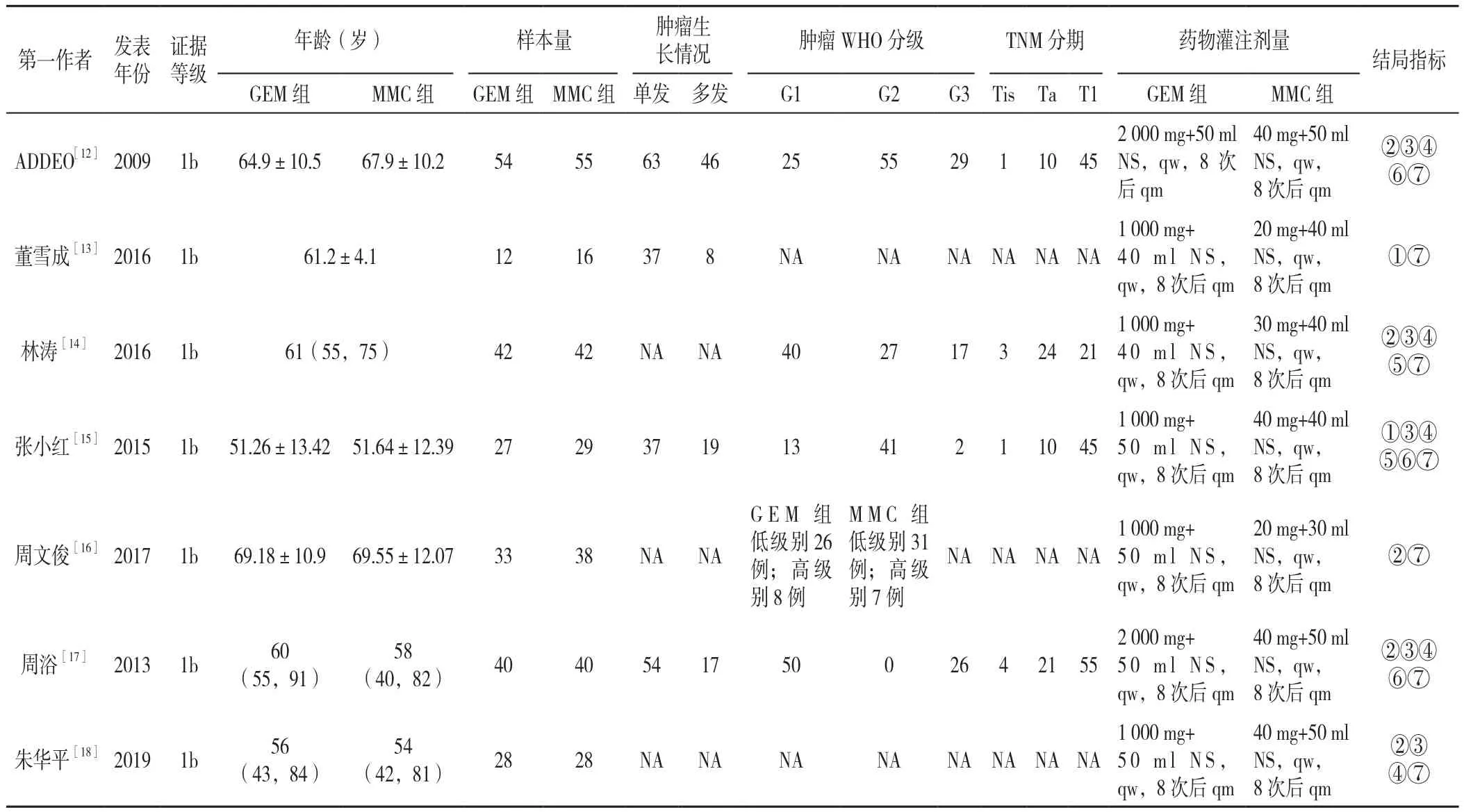
表1 纳入文献的基本情况Table 1 Baseline data for RCTs included in the meta-analysis
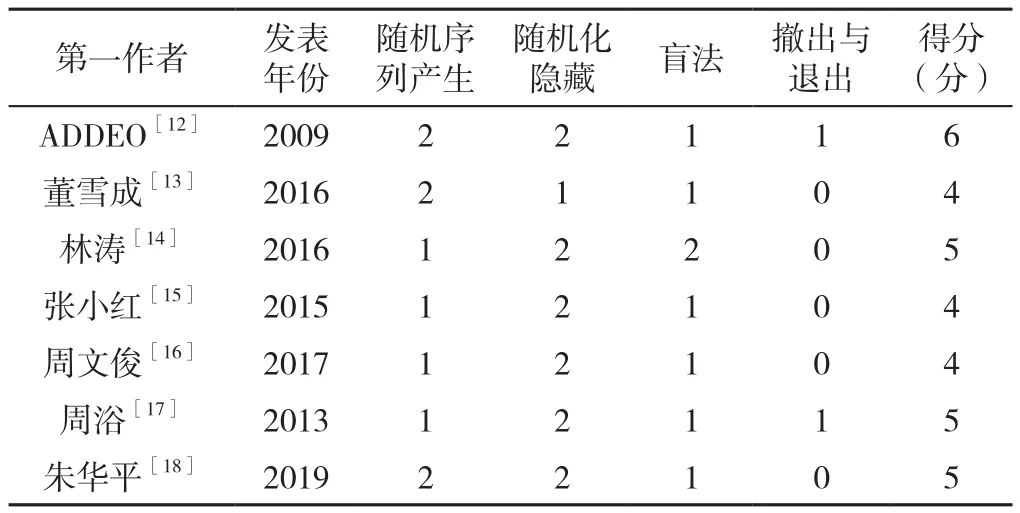
表2 纳入文献的Jadad质量评分Table 2 The Jadad score of included RCTs

图1 文献筛选流程图Figure 1 Flow diagram of RCTs selection and enrollment
2.2 Meta分析结果
2.2.1 Meta分析结果的证据等级评价 将所得的Meta分析结果导入到GRADEpro软件中进行证据等级评价,提示术后1年肿瘤复发率、肝肾功能损害、其他毒副作用为低质量证据;术后2年肿瘤复发率、膀胱刺激征、血尿为中等质量证据;总体毒副作用为高质量证据,见表3。
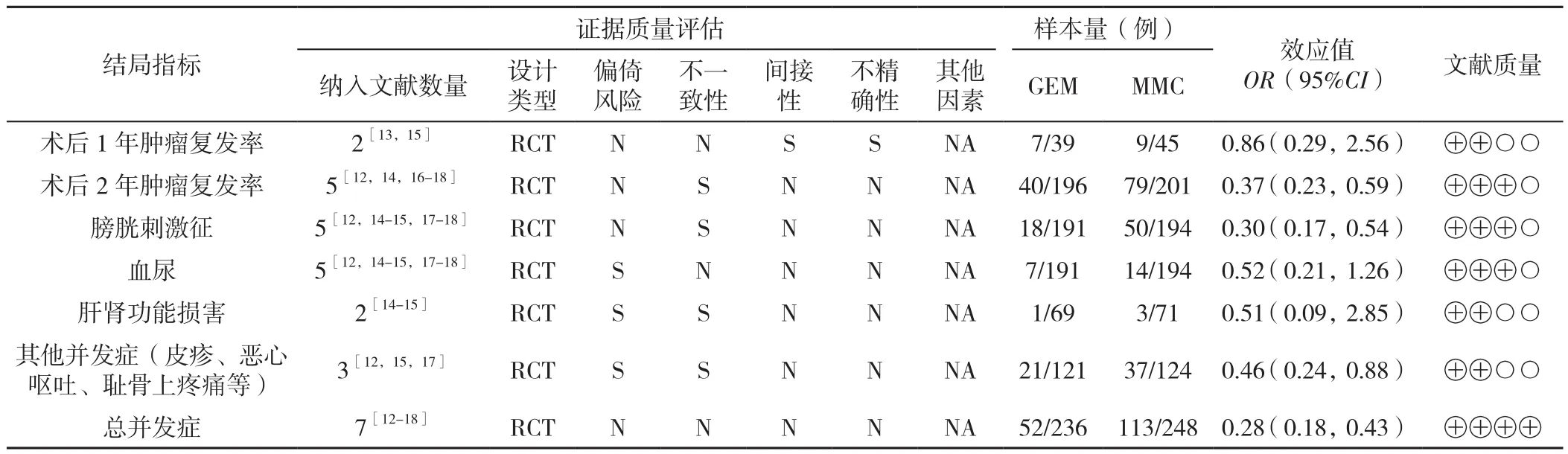
表3 荟萃分析结果在GRADEpro软件中所显示的证据级别Table 3 Evidence level of included RCT in the meta-analysis using GRADEpro software
2.2.2 术后1年肿瘤复发率 2篇文献[13,15]报道了两组患者的术后1年肿瘤复发率,共84例患者被纳入此项分析中。各研究间存在同质性(I2=0,P=0.595),采用固定效应模型进行Meta分析,结果显示,两组患者术后1年肿瘤复发率比较,差异无统计学意义〔OR=0.86,95%CI(0.29,2.56),P=0.17〕,见图2。
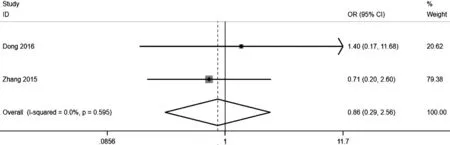
图2 两组术后1年肿瘤复发率Meta分析的森林图Figure 2 Forest plot of one-year recurrence rate in gemcitabine and mitomycin groups of non-muscular invasive bladder cancer patients after transurethral resection of bladder tumor
2.2.3 术后2年肿瘤复发率 5篇文献[12,14,16-18]记录了患者术后2年肿瘤复发率,共纳入患者400例。经异质性检验,提示各研究间存在可接受的异质性(I2=0,P=0.511),采用固定效应模型进行Meta分析,结果显示,GEM组术后2年肿瘤复发率低于MMC组,差异有统计学意义〔OR=0.37,95%CI(0.23,0.59),P=0.01〕,见图 3。
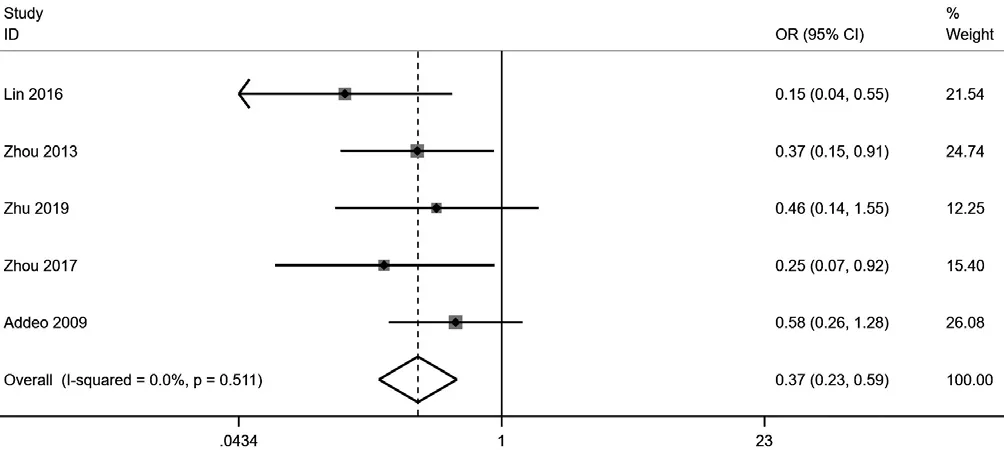
图3 两组术后2年肿瘤复发率Meta分析的森林图Figure 3 Forest plot of two-year recurrence rate in gemcitabine and mitomycin groups of non-muscular invasive bladder cancer patients after transurethral resection of bladder tumor
2.2.4 AE 所纳入的7篇文献[12-18]均对患者行BIC后的总AE发生率进行了报道,共涉及484例患者。由于所纳入的研究间具有可接受的异质性(I2=18.9%,P=0.286),选择随机效应模型进行Meta分析,结果显示,GEM组灌注化疗后总AE发生率低于MMC组,差异有统计学意义〔OR=0.28,95%CI(0.18,0.43),P=0.01〕,见图 4。
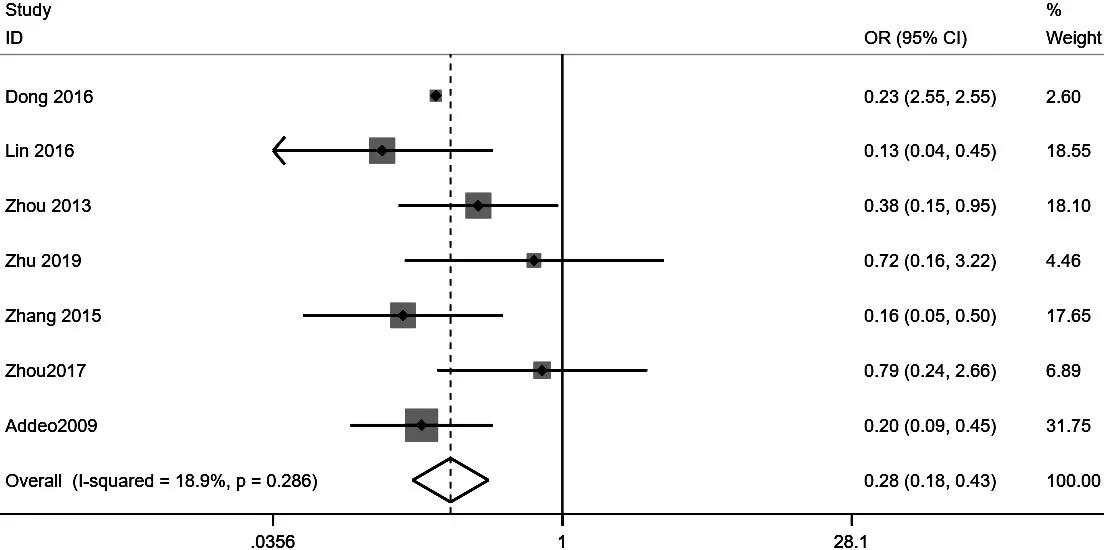
图4 两组术后灌注化疗后总不良事件发生率Meta分析的森林图Figure 4 Forest plot of the overall incidence of adverse events in gemcitabine and mitomycin groups of non-muscular invasive bladder cancer patients after transurethral resection of bladder tumor
2.2.5 亚组分析 根据并发症的类型:膀胱刺激征、血尿、肝肾功能损害、其他并发症(包括皮疹、恶心呕吐、耻骨上疼痛等)进行亚组分析,根据异质性检验结果(I2=25.0%、0、47.8%、11.8%,P=0.255、0.798、0.166、0.322)选用固定效应模型进行Meta分析,结果显示,两组血尿〔OR=0.52,95%CI(0.21,1.26),P=0.22〕、肝肾功能损害发生率〔OR=0.51,95%CI(0.29,0.85),P=0.16〕比较,差异均无统计学意义(P<0.05);GEM组膀胱刺激征〔OR=0.30,95%CI(0.17,0.54),P=0.04〕和其他并发症(皮疹、恶心呕吐、耻骨上疼痛等)发生率〔OR=0.46,95%CI(0.24,0.88),P=0.01〕低于MMC组,差异均有统计学意义,见图5。

图5 两组术后灌注化疗后不良事件发生率Meta分析的森林图Figure 5 Forest plot of adverse events(A:bladder irritation;B:hematuria;C:liver and kidney damage;D:rash,nausea and vomiting,suprapubic pain) in gemcitabine and mitomycin groups of non-muscular invasive bladder cancer patients after transurethral resection of bladder tumor
3 讨论
即使专业的临床医师,对NMIBC患者实施TURBT也仅能够达到肉眼无瘤化,术后需根据病理检查结果选择合适的灌注化疗药物,来彻底杀灭术中遗留的残余肿瘤组织和降低因手术操作游离在膀胱内的肿瘤细胞发生种植转移的概率[19]。通常NMIBC患者均能从规范的手术和术后化疗中明显获益,但仍旧无法避免约50%以上的患者在术后2~5年内进展性复发,且其中10%左右患者处于较晚期的级别和阶段。从远期角度看,NMIBC仍是复发率高的难治性恶性肿瘤[20]。
对于高危的NMIBC患者,TURBT联合术后卡介苗(bacille calmette-gu é rin,BCG)灌注虽在临床常被推荐为一线疗法,但约半数以下的患者在术后灌注无效及因BCG引起的广泛毒副作用使其在临床的应用受到限制[21-22]。MMC现已逐渐替代BCG治疗NMIBC,但并不能消除灌注后引起的膀胱刺激征、血尿、化学性膀胱炎等缺点,解决上述毒副作用的发生使患者获益是泌尿外科医师面临的挑战。GEM作为脂溶性抗肿瘤药物,更容易在肿瘤细胞内达到有效的药物浓度,由于其血浆药物浓度低,患者的耐受性也相应更好[23]。本研究通过纳入已发表包含484例患者的7篇RCT,采用Meta分析的方法,对GEM和MMC治疗TURBT后NMIBC的有效性与安全性进行深入的探讨,以提供循证医学证据。
本研究结果显示,在术后肿瘤复发情况中,两组术后1年肿瘤复发率并无统计学差异,该结果建立在两篇研究之上[13,15],且研究间结论相反,追溯其来源可明确各研究间对MMC的使用剂量并不相同,董雪成等[13]使用20 mg MMC作为基础灌注剂量而获得了更低的术后1年肿瘤复发率,对临床上针对不同类型的患者选择合适的药物剂量以获得更好的临床效果有一定启示。但所纳入的研究过少,样本量较小,两组样本量不对称可能是造成上述结果的主要原因,且不同医疗机构对于患者术后的辅助治疗及灌注药物保留时间、体位的变化和保持均是造成该结果的因素,故对此结果应谨慎对待。GEM组术后2年肿瘤复发率要明显低于MMC组,且结果有统计学意义,这与既往研究结果相符[12,24]。在较长的肿瘤学预后随访中,GEM是有效的抗肿瘤药物,能够使患者在术后生存时间上获益。
AE发生率是评估抗肿瘤药物安全性的重要指标,在灌注化疗后总AE发生率上,GEM组低于MMC组,与所纳入研究的结论相符。从亚组分析的结果可知,接受GEM化疗的患者发生膀胱刺激征、耻骨上疼痛、恶心呕吐、皮疹等AE的可能性更低,而发生血尿、肝肾功能损害的概率与MMC组相比并无统计学差异。GEM是有效的嘧啶类抗代谢药物,拥有相比其他化疗药物更小的毒性[21],Meta分析结果从统计学角度映证了这个结论,尤其是在膀胱刺激征、耻骨上疼痛等主观的毒副作用上,GEM减轻了患者的痛苦。由于抗肿瘤药物作用于上皮细胞的机制,在GEM或MMC使用后,少数患者会出现一过性血尿症状,但在2~3周内可自行恢复,对患者的生活影响并不显著[25]。在报道了肝肾功能损害的两项研究中[14-15],可见两种化疗药物对肝肾功能的影响均较小。但由于缺乏其他研究对照且纳入的样本量较局限,Meta分析结果应由进一步的高质量研究来验证。
GEM在不同危险分层的NMIBC患者的治疗中均有令人满意的表现。MESSING等[26]将215例低度恶性的NMIBC患者随机分为两组,分别予以GEM单药化疗和0.9%氯化钠溶液进行对照并随访4年,结果提示GEM组和0.9%氯化钠溶液对照组的4年肿瘤复发率分别为34%和54%。在周浴等[17]对80例高危NMIBC进行的中位随访21.2个月的RCT中,GEM组和MMC组的肿瘤复发率分别为35.9%和60.0%,且GEM组肿瘤复发率高于MMC组(P<0.05)。同时也有研究证明,对于BCG治疗失败的高危型NMIBC,GEM也展现出良好的疗效。GACCI等[27]对19例BCG难治性T1G3的膀胱癌分别选择了GEM和BCG进行膀胱灌注化疗并随访至少27个月,GEM组与BCG组的总生存率分别为100%和80%。GEM在治疗不同阶段的NMIBC均有重要价值,对于BCG难治型的NMIBC患者,GEM是潜在的替代疗法。
尽管此Meta分析有着严格的纳入、排除标准和统计学处理,但仍然存在一定的局限性:(1)样本量不足,在分析个别指标时所纳入的样本量和研究相对较少,使结果证据力度较低;(2)灌注后患者的体位、膀胱灌注时间,患者其他的辅助治疗是不可控制的混杂因素;(3)纳入的研究虽然均是RCT,但仍缺乏高质量、大样本的RCT,结果说服力弱;(4)所纳入研究多为单一国家单中心研究,缺乏一定代表性。
综上所述,基于目前的循证医学证据,选择GEM进行膀胱内灌注化疗可明显降低NMIBC复发率,在灌注后毒副作用方面,GEM和MMC均可引起化疗相关的毒副作用,但GEM所产生的毒副作用发生率更低,使患者的接受性更高,是安全有效的抗肿瘤化疗药物。对于低危的NMIBC,使用MMC进行BIC仍是重要的治疗手段,但MMC可能会引起更多的膀胱刺激征、消化道反应和疼痛等其他毒副作用,临床医师需根据患者的基础情况进行化疗药物选择。此项Meta分析的结论需要更大样本量、设计更严谨的多中心RCT来证明。
作者贡献:李云祥、伍季进行文章的构思与设计;彭磊进行研究的实施与可行性分析,撰写论文;蒙春杨进行数据收集、整理;李金泽进行统计学处理,结果的分析与解释;韦堂墙进行论文的修订;赵攀负责文章的质量控制及审校;李云祥、李进铭对文章整体负责、监督管理。
本文无利益冲突。
