基于网络药理学探讨犀角地黄汤治疗过敏性紫癜的作用机制∗
2021-07-12王宁丽陈绍斐刘学伟宋纯东
王宁丽 陈绍斐 王 刚 刘学伟 宋纯东
(河南中医药大学第一附属医院,河南 郑州 450000)
过敏性紫癜(HSP)是一种由免疫球蛋白A(IgA)介导的系统性血管炎,每年约有22例/10万例[1]。临床表现主要为皮肤紫癜、关节痛、关节炎、急性肠炎和肾小球肾炎。儿童发病率较成人高,但成人发病症状重,胃肠道和肾脏受累是成人发病率和死亡率的主要原因[2]。目前,西医治疗HSP无特效干预方案,主要以支持性治疗为主,疗效并不显著,且没有证据表明激素或免疫抑制剂改善HSP长期预后[2]。中医药治疗本病具有迅速改善症状、缩短病程、减少复发等优势[3]。
中医学认为,HSP可归属“血证”“葡萄疫”“发斑”等范畴,致病因素不外乎“湿热内侵、瘀血阻络”,热毒血瘀是导致HSP病情反复、迁延难愈的重要因素,贯穿于整个病程之中[4]。通过临床研究及经验总结发现[5],HSP以血热妄行证为主,多以清热解毒、凉血散瘀为治法,方用犀角地黄汤。现代研究表明犀角地黄汤在治疗HSP方面取得较好疗效,它具有缓解临床症状,改善患者肾功能、免疫功能及凝血功能,降低炎症因子表达的作用,且复发率较少[6-8],故其具体的分子机制值得进一步探索。基于中药具有多成分、多靶点及多通路的特点,本研究运用网络药理学的方法探究犀角地黄汤中的有效成分、作用靶点及主要通路,明确其药效物质和HSP的关系,从多层次分析犀角地黄汤治疗HSP的潜在效应机制,为进一步药理研究和临床应用提供依据。
1 资料与方法
1.1 犀角地黄汤活性化合物和靶点的筛选 通过检索TCMSP数据库、ETCM、TCM、TCMID及《中华人民共和国药典》(2015版)等方式,获得犀角地黄汤中4味中药的所有化学成分及分子结构等信息。纳入符合口服生物利用度(OB)≥30%、类药性(DL)≥0.18、Lipin⁃ski五规则(rule of five)[9]、Veber原则[10]及 Druglike⁃ness Weight≥0.4标准的化合物,筛选出候选活性成分。整合符合标准的所有药物作用靶点,并基于Uni⁃prot数据库标准化所有靶点名称。
1.2 疾病靶点预测 以“Henoch-Schonlein purpura”为关键词,在数据库OMI与GeneCards中收集过敏性紫癜的致病靶标,作为疾病的候选靶基因。
1.3 多元网络构建 将获得的犀角地黄汤相关靶点与疾病靶点基因进行Venny图分析,获取药物与疾病的交集靶点基因,再导入在线String蛋白质互作数据库,获得蛋白相互作用关系信息后导入Cytoscape3.7.2,运用“Network Analyze”进行拓扑分析。将潜在活性成分和核心作用靶点共同导入Cytoscape3.7.2软件中,绘制“药物-活性成分-共有靶点-疾病”网络图。
1.4 GO富集分析和KEGG通路富集分析 把上述的核心作用靶点导入DAVID数据库中进行GO富集分析和KEGG通路注释分析,以P<0.05为条件筛选出相应的通路。最后将在Omishare Tools中将GO富集分析、KEGG通路注释分析数据可视化。
2 结 果
2.1 化合物的获取及筛选 检索得到赤芍中化合物78个,生地黄中15个,牡丹皮中30个,水牛角中6个。经筛选符合标准的化合物有水牛角中1个,生地黄中4个,牡丹皮中8个,赤芍中15个,其中牡丹皮与赤芍有相同化合物4个,共24个候选化合物。
2.2 核心靶点的分析 在TCMSP和ETCM等数据库中查找犀角地黄汤的所有作用靶点数据,再通过Uniprot数据库将靶点标准化,最终获得452个潜在作用靶点。在OMIM和GeneCards数据库中收集疾病的致病靶点,获得HSP相关的疾病靶标63个。再运用Veney数据库将潜在活性成分的作用靶点和疾病的致病靶标进行交集,得出共同作用靶点11个,见图1。
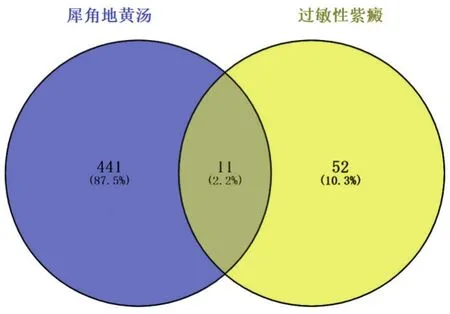
图1 犀角地黄汤治疗过敏性紫癜韦恩图
2.3 活性成分-核心靶点的网络构建 将潜在活性成分和核心作用靶点共同导入Cytoscape3.7.2软件中,绘制出潜在活性成分-靶点图,见图2,并进行分析。此网络一共有40个节点,88个边,可见犀角地黄汤治疗过敏性紫癜具有多成分、多靶点的特点。一个潜在活性成分可以对应多个作用靶点,同理,一个核心靶点也可以对应多个潜在活性成分。
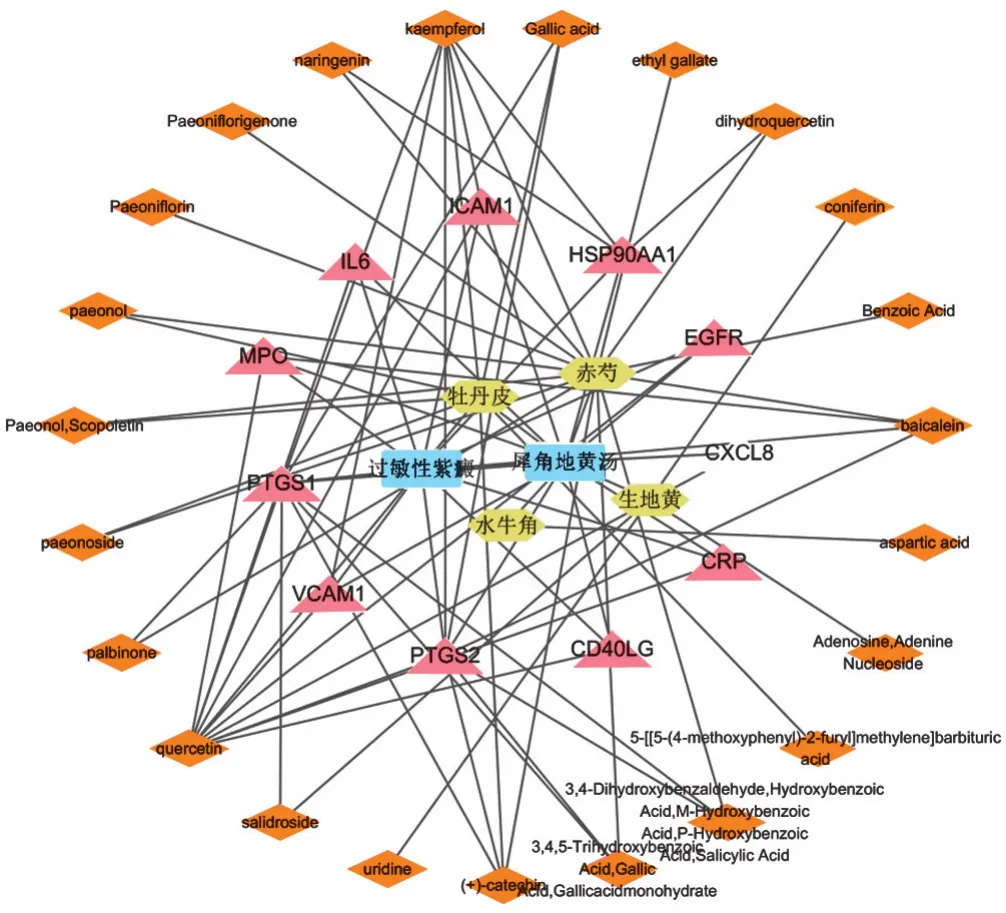
图2 药物-活性成分-靶点-疾病网络图
2.4 核心靶点PPI网络分析 将STRING数据库的核心作用靶点数据导入Cytoscape3.7.2数据库,并进行Analyze Network分析,绘制出PPI网络图,见图3。图中共有11个节点,42个边,其中degree值越大则节点越大、蓝色越深。根据PPI的网络分析可将核心靶点进行degree由大到小的排序:环氧合酶2(PTGS2)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、髓过氧化物酶(MPO)、细胞间黏附分子-1(ICAM1)、血管细胞黏附分子(VCAM1)、C反应蛋白(CRP)、CD40配体(CD40LG)、表皮生长因子受体(EGFR)、热休克蛋白90α家族A类成员1(HSP90AA1)、环加氧酶1(PTGS1),参数详见表1。
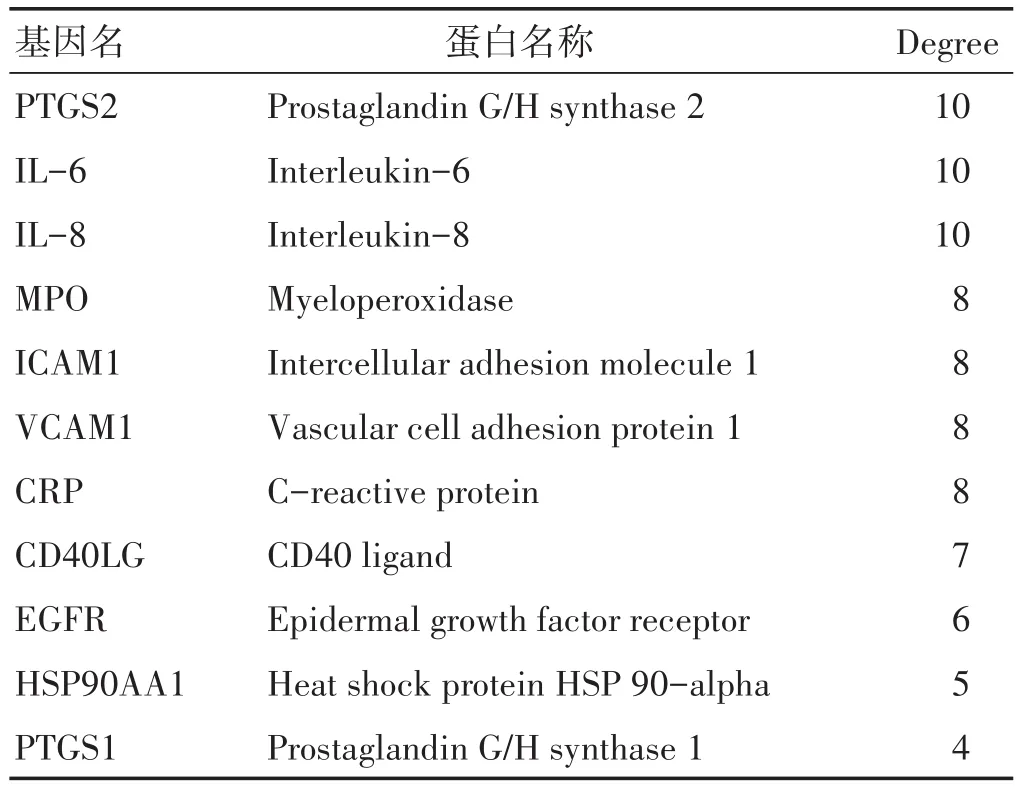
表1 核心靶点参数表
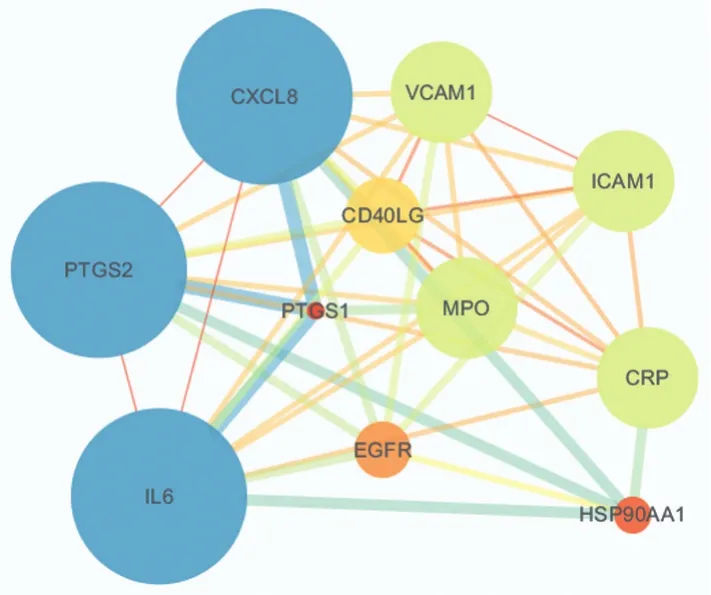
图3 核心靶标PPI网络图
2.5 核心靶点的GO富集分析 利用DAVID数据库对核心靶点进行GO富集分析,按P值从小到大进行顺序筛选前20个,见图4。其中大部分富集结果与生物过程(BP)相关,主要包括:一氧化氮生物合成过程的正调控、细胞外空间、炎症反应、氧化应激反应、细胞对肿瘤坏死因子的反应、过氧化物酶活性、白细胞黏附和信息、细胞表面、血管收缩的正向调节、质膜的外侧、平滑肌细胞增殖的正向调节、正向调节T细胞增殖、药物反应、白细胞介素-1的细胞反应、单个生物细胞-细胞黏附、整合素结合、细胞对脂多糖的反应、凋亡过程的负调控、NF-κB转录因子活性的正调控等。
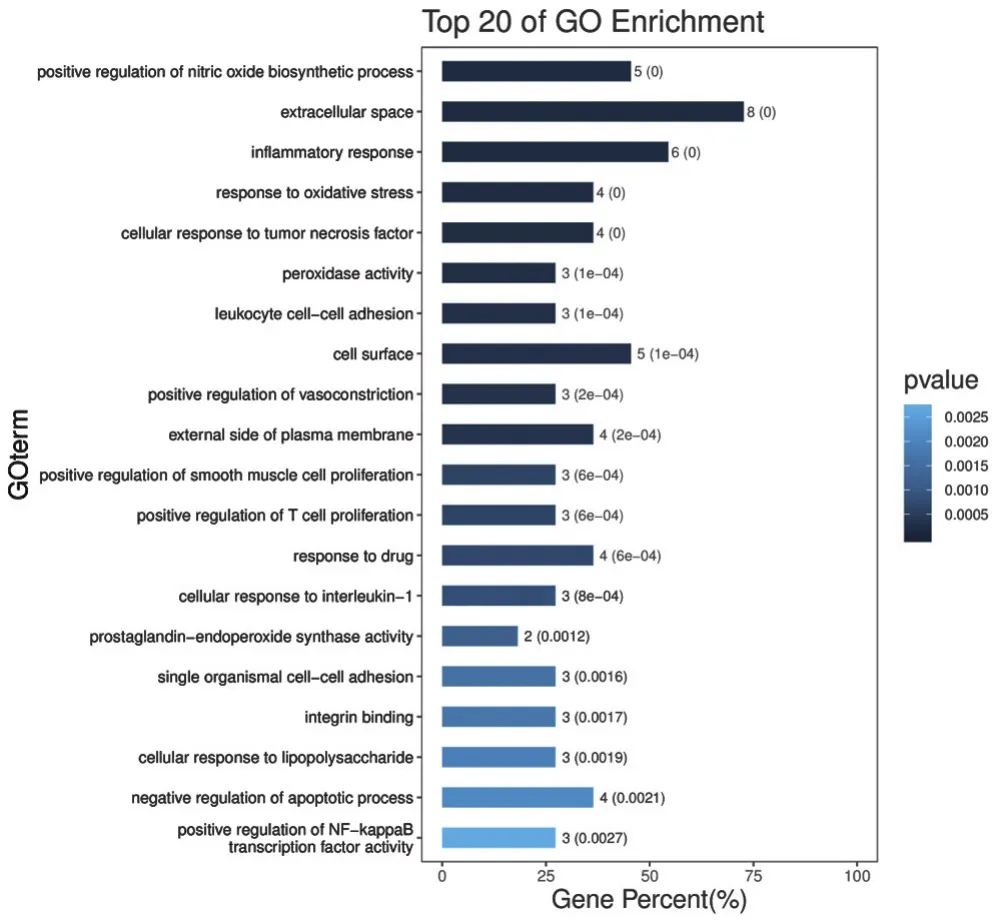
图4 核心靶点的GO富集分析
2.6 核心靶点的KEGG通路注释分析 利用DAVID数据库对核心靶点进行信号通路注释分析,获得靶点参与的所有信号通路,核心作用靶点的KEGG通路注释分析结果见图5。由图5可见,Y轴代表Pathway名称;X轴代表富集因子(RichFoctor);图中气泡的面积越大,代表的基因数就越多;图中气泡越红,代表的富集显著性就越强。在P<0.05的基础上筛选出12条KEGG富集通路,包括疟疾(Malaria)、核心因子-κB信号通路(NF-κB)、肿瘤坏死因子信号通路(TNF)、非洲锥虫病(African trypanosomiasis)、癌症通路(Pathways in cancer)、NOD样受体信号通路(NLR)、类风湿性关节炎(Rheumatoid arthritis)、细胞黏附分子(CAMs)、癌症中的转录调控失调(Transcriptional misregulation in cancer)、甲型流感(Influenza A)、细胞因子与其受体相互作用(Cytokine-cytokine receptor interaction)、人类嗜T细胞病毒Ⅰ型感染(HTLV-I infection)等,具体通路参数见表2。目前治疗HSP相关信号通路中,NF-κB、TNF等信号通路研究较多,其具体信号通路图见图6、图7。
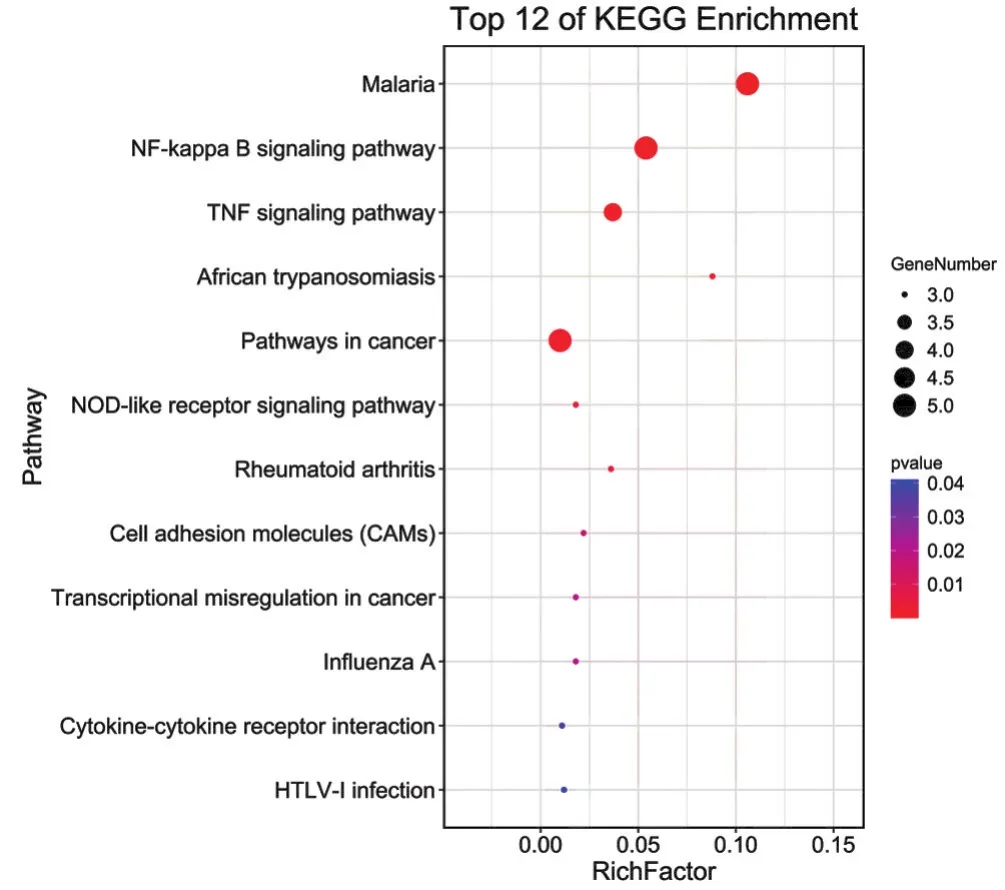
图5 犀角地黄汤KEGG信号通路图
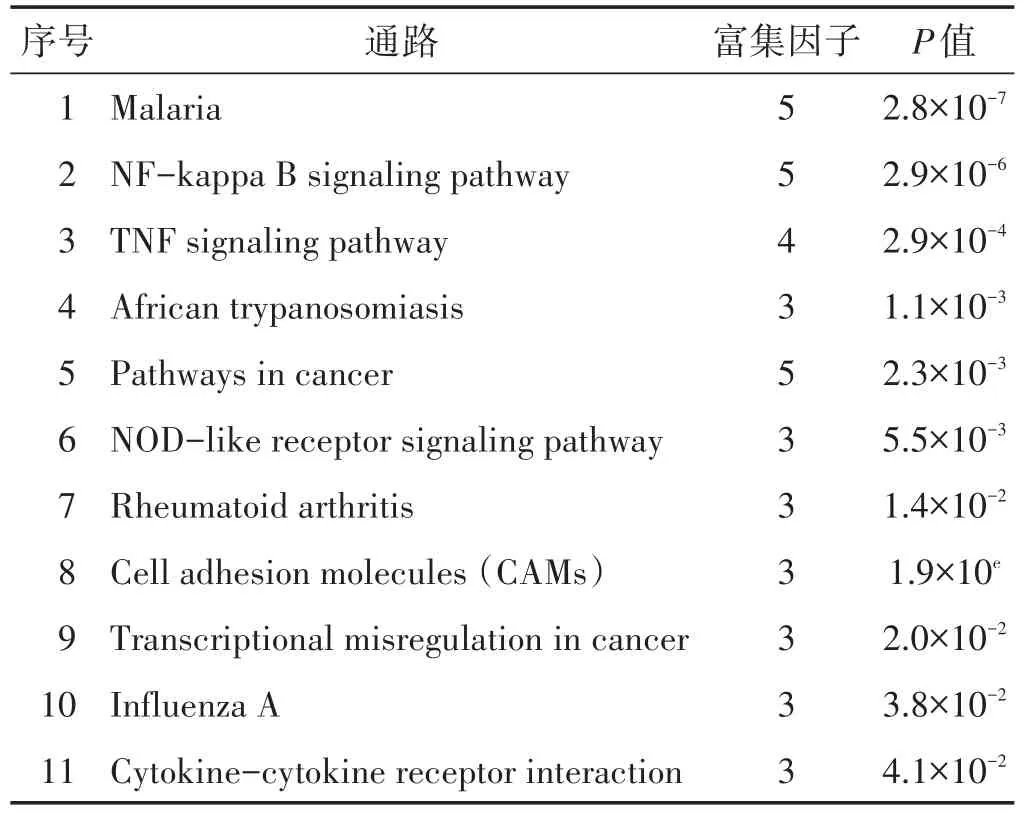
表2 犀角地黄汤通路参数表
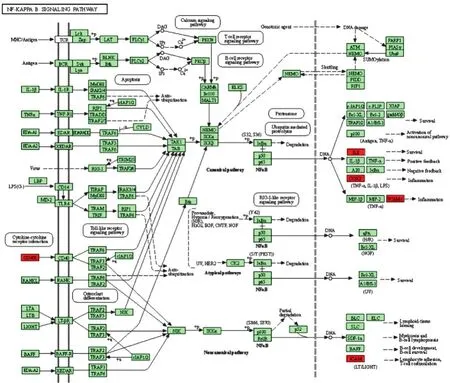
图6 NF-κB信号通路
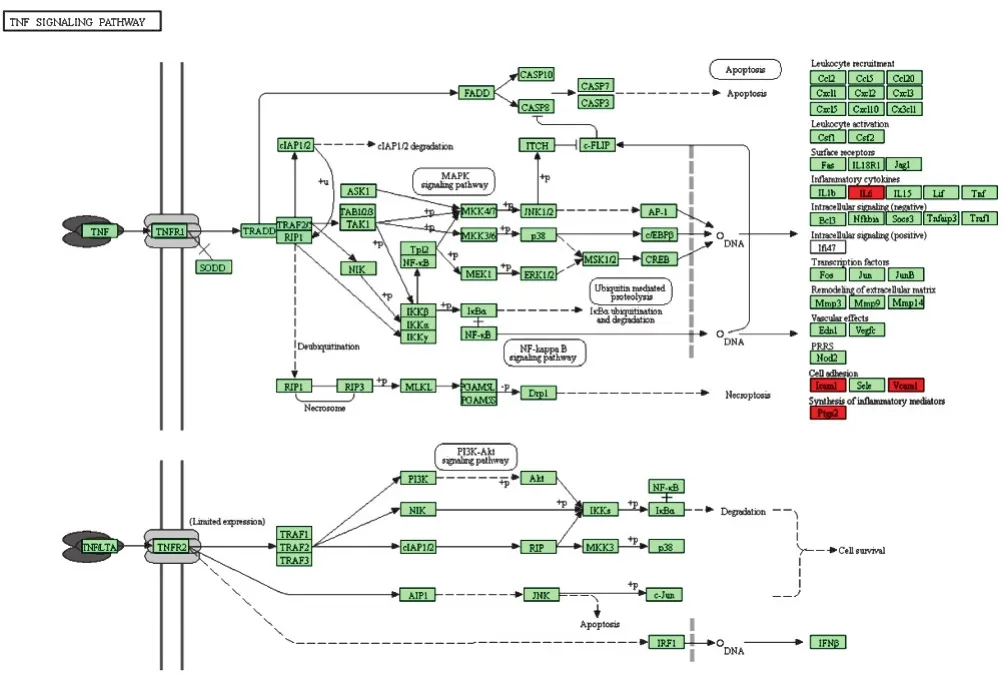
图7 TNF信号通路
3 讨 论
目前,HSP病因及发病机制尚不明确,可能与免疫复合物沉积、体液免疫功能异常、T淋巴细胞亚群平衡失调及白介素介导的细胞因子分泌增加造成组织、器官损伤相关[11]。中医学认为,本病的发病原因包括外感热毒、素体亏虚、饮食失节、瘀血阻络等[12],以热毒血瘀最为常见,《证治汇补》曰“热极沸腾发为斑……热伤血,血热不散,表虚里实,出于皮肤而发斑”。故治疗上选用犀角地黄汤以清热解毒、凉血散瘀。由于犀角稀缺,故以水牛角代替为君,苦寒入血分凉血清解热毒;臣以甘苦寒之生地黄,凉血兼养阴生津,既助水牛角凉血清热止血,又能恢复已损之阴血;赤芍、牡丹皮养血活血、清热散瘀,故为佐药。现代药理研究表明[13-14],犀角地黄汤具有调节炎症反应、降低炎症因子表达,下调抗氧化应激反应、减轻血管损伤,促进免疫平衡、调节免疫状态等功能。
本研究以OB≥30%、DL≥0.18、Druglikeness Weight≥0.4等标准为筛选标准,获得犀角地黄汤活性成分24个,其中水牛角含有天冬氨酸等多种氨基酸,现代研究表明其具有解热、镇静、促凝血以及减少毛细血管通透性等作用[15];生地黄主要含有环烯醚萜苷及二苯乙烯苷类等活性成分为主,具有缩短凝血时间、抗炎、抗过敏的作用[16];赤芍主要活性成分为芍药苷、芍药醇、芍药内酯苷、苯甲酸等,具有消炎镇痛、抑制炎性因子表达、抗氧化、抗内毒素等药理作用[17];牡丹皮活性成分主要有丹皮酚、芍药苷、没食子酸、槲皮素、儿茶素等,具有较强的抗菌消炎、激活免疫、保护血管的作用[18]。通过构建关键靶点PPI网络,得到关键靶点分别为PTGS2、IL-6、IL-8、MPO、ICAM1、VCAM1、CRP、CD40LG等,推测犀角地黄汤可能通过这些靶点发挥作用。PTGS2是合成前列腺素的关键同工酶,它在正常细胞内活性极低,但在炎症反应中表达水平可上升10~80倍,是导致后续炎症反应和血管损伤的关键靶点[19],大量研究表明[20],赤芍有效成分能够抑制炎症因子PTGS2、ICAM1的表达。IL-6、IL-8、CRP均是具有多重效应的细胞炎性因子,IL-6与机体炎症反应和细胞免疫活化程度密切相关,IL-8具有调节免疫与炎症诱导作用的趋化因子,而CRP是经典的炎症指标。研究发现[21]炎症反应在HSP进展中起重要作用,HSP患者体内IL-6、IL-8、CRP、TNF-α等炎症因子均有不同程度升高,同时犀角地黄汤能够降低HSP患者IL-6、IL-8、TNF-α等炎症因子表达,有效改善临床症状[22]。MPO作为中性粒细胞活化的标志物,参与HSP发生发展过程,HSP患儿MPO水平明显升高,且MPO能诱导免疫系统释放更多炎症因子,其水平与IL-6、TNF-α 等炎症因子呈正相关[23]。ICAM-1、VCAM-1是重要的细胞黏附分子,主要黏附在细胞之间,大部分炎症疾病均会升高。临床研究表明[24],HSP患者体内ICAM-1、VCAM-1水平明显高于健康对照组,能够反映HSP的进展程度。CD40LG是体内特异性免疫系统的关键刺激分子,参与体液免疫和细胞免疫反应过程,其表达异常与炎症反应、免疫功能紊乱密切相关[25]。
对共有靶点进行GO富集分析发现,犀角地黄汤治疗HSP起重要作用的有一氧化氮生物合成过程的正调控、细胞外空间、炎症反应、氧化应激反应、细胞对肿瘤因子的反应、过氧化物酶活性、白细胞黏附和信息等,表明核心靶点之间相互影响,作用于炎症反应、氧化应激反应、信号传导等环节,影响细胞的增殖、凋亡、代谢及细胞间黏附等多种生物学功能。KEGG通路富集分析发现,犀角地黄汤治疗HSP的核心靶点主要涉及NF-κB、TNF、NLR等信号通路,NF-κB是一种“快速反应”的初级核转录因子,是有害刺激的第一反应者,目前已知NF-κB信号通路能激活IL-1β、IL-2、IL-6、IL-8、TNF-α、COX-2、ICAM1、VCAM1等细胞因子,这些炎症因子的释放可使NF-κB再激活,产生瀑布式炎症反应,加重组织损伤[26]。NF-κB参与了HSP患者机体血管炎症反应及免疫应答,其激活水平与病情状况有关[27],犀角地黄汤能够通过抑制NF-κB信号通路减轻炎症反应[28]。TNF信号通路可介入多种信号传导,能够通过调节细胞凋亡或控制炎症反应以释放多种炎症介质和促炎因子,造成炎症反应,从而进一步地激活更多的炎症基因,导致HSP患者体内细胞组织损伤[29]。NLR信号通路具有多个效应结构域,能够激活炎症小体,诱导细胞组织发生炎症反应,同时参与启动NF-κB、MAPK等信号通路,在机体抗感染、免疫机制启动调节中发挥重要功能[30]。这些通路均与HSP发生发展密切相关,可能是犀角地黄汤治疗HSP的重要通路,有待后期实验进一步验证。
综上所述,本研究运用网络药理学的方法,初步对犀角地黄汤治疗HSP的活性成分、共有靶点及生物学通路等进行探讨及阐述,为犀角地黄汤的进一步实验研究和临床运用提供了新的思路及理论依据。但是,本研究仅从理论及网络预测角度进行探讨,尚未考虑药物剂量影响,仍需更深入的研究探讨其具体机制。
