半夏泻心汤通过调控HO-1的表达改善脓毒症大鼠肠道损伤的机制研究∗
2021-07-12刘委宏张飞虎
刘委宏 郝 浩 刘 阳 张飞虎 孔 立
(山东中医药大学附属医院,山东 济南 250014)
脓毒症是感染导致宿主内环境失调从而危及生命的器官功能障碍[1-2],胃肠道是人体的中心器官,目前已经证实胃肠道是脓毒症发生时首先受到侵害的器官[3],在脓毒症发生的过程中,组织器官缺血缺氧和全身性的强烈炎症反应可导致肠道损伤,而肠道损伤又可使得肠道屏障功能遭到破坏,从而进一步加重炎症反应。目前认为血红素加氧酶-1(HO-1)是调控炎症反应的关键环节之一,有研究[4-5]显示HO-1对于脓毒症相关的肠损伤具有显著的保护作用。脓毒症肠道损伤中医的根本病机是气机逆乱,因此调理中焦气机是治疗脓毒症肠道损伤的根本治法。半夏泻心汤为《伤寒论》经典方剂,具有辛开苦降、调和脾胃阴阳的作用,切中脓毒症肠道损伤的病机,前期研究发现半夏泻心汤治疗脓毒症肠道损伤有一定的疗效[6-7]。本研究通过盲肠结扎穿孔(CLP)法建立脓毒症模型,并探讨半夏泻心汤通过调控HO-1的表达改善脓毒症大鼠肠道损伤的机制。
1 材料与方法
1.1 实验动物 清洁级6~7周龄SD大鼠60只,体质量220~260 g,购自济南福乐生物技术有限公司(批号:37009200012845)。室温25℃左右,标准饲料喂养,自由进水饲养。
1.2 实验药物 半夏泻心汤:法半夏15 g,干姜9 g,黄芩9 g,黄连6 g,人参9 g,炙甘草9 g,生大黄3 g,熟大黄3 g,大枣4枚。饮片均购自北京同仁堂公司,经鉴定符合《中国药典》相关规定。药材水煎浓缩成含生药1 g/mL药液,置4℃冰箱保存备用。
1.3 试剂与仪器 HO-1、白细胞介素-10(IL-10)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒均购自济南依科赛生物制品有限公司;低速医用离心机型,型号400C型,白洋医疗器械有限公司;-86℃低温冰箱,型号DW-HL388,中科美菱低温科技股份有限公司;电子天平,型号ME235P,上海瑶新电子科技有限公司;微量移液器,型号KJ42278,上海沃元科技有限公司;酶标仪,450 nm检测波长滤光片,570 nm或630 nm校正波长滤光片。
1.4 分组与造模 将60只SD大鼠适应性饲养3 d采用随机数字表法分为假手术组、脓毒症组、半夏泻心汤组,每组20只。手术前12 h禁食不禁水,脓毒症组和半夏泻心汤组采用CLP法[8]制备脓毒症大鼠模型:10%水合氯醛(3 mL/kg)腹腔注射麻醉,上腹部正中切口,探查取出盲肠,分离肠系膜,在所分离盲肠远端1/3处用4号线结扎,用16号针穿2孔,然后轻轻挤出少许肠内容物于腹腔内,回纳盲肠,后分层缝合腹腔,术后6 h成模。假手术组开腹后,探查腹腔后关腹,其他操作相同。
1.5 给药方法 成模后假手术组与脓毒症组术后均予生理盐水按10 mL/kg灌胃,隔6 h 1次,共给药3次;半夏泻心汤组术后予半夏泻心汤10 mL/kg灌胃。本实验中动物处置方法符合动物伦理学标准。
1.6 标本采集与检测 1)成模后24 h用10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,腹主动脉取血后分离血清,采用ELISA法检测血清HO-1及TNF-α、IL-6、IL-10的含量,操作按试剂盒说明书进行。2)采用脊椎脱臼法处死大鼠近回盲端取回肠组织约3~4 cm,清洗后分为2份。一份放入装有10%甲醛溶液中固定,石蜡包埋切片后苏木精-伊红(HE)染色,镜下观察回肠组织病理学变化,并进行病理学评分[9];另一份称重后加入预冷的磷酸盐缓冲液(PBS),按1 g(组织湿重)/mL浓度配制,粉碎器粉碎后10 000 r/min离心10 min取上清液,制得10%肠道组织匀浆,应用ELISA法检测回肠组织HO-1及TNF-α、IL-6、IL-10的含量,操作按试剂盒说明书进行。
1.7 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,组间比较使用单因素方差分析,采用LSD-t检验,若方差不齐则用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 假手术大鼠行为表现未见显著异样反应。脓毒症模型组大鼠在造模后3 h可见蜷缩、反应迟钝、竖毛、泄泻、发热寒战等异常表现。半夏泻心汤组大鼠上述症状较脓毒症组轻微,活动较多。
2.2 各组大鼠肠道标本病理损伤及评分 见图1。假手术组大鼠回肠组织光镜下可见黏膜绒毛排列整齐,上皮细胞结构完整,未见明显病理改变;半夏泻心汤组大鼠肠道组织光镜下可见黏膜绒毛结构相对完整,排列较假手术组略杂乱,上皮细胞轻度水肿,可见炎性细胞浸润,提示其组大鼠肠道病变较轻。脓毒症组大鼠肠道组织镜下可见黏膜萎缩明显,绒毛结构被破坏、排列杂乱,甚至可见断裂、脱落,上皮细胞出现变性、坏死,可见固有层裸露、水肿,炎性细胞浸润加重。与假手术组相比,半夏泻心汤组和脓毒症组大鼠回肠组织病理学评分增高(P<0.05);半夏泻心汤组与脓毒症组相比,肠道损伤评分减低(P<0.05)。见表1。
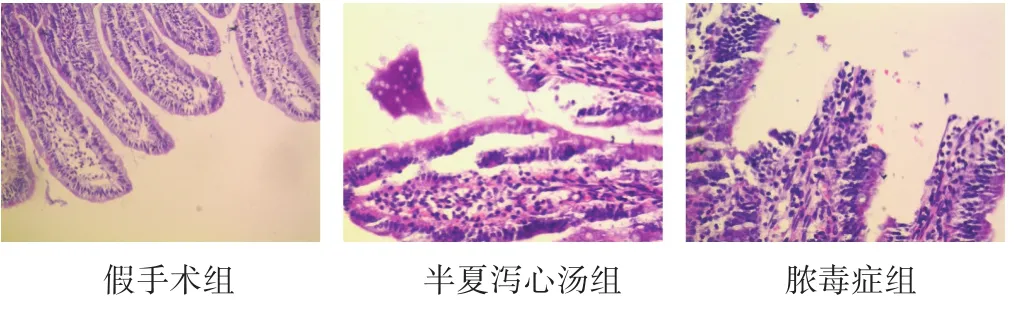
图1 各组大鼠光镜下回肠组织病理(HE染色,400倍)
表1 各组大鼠回肠组织病理学评分比较(分,±s)
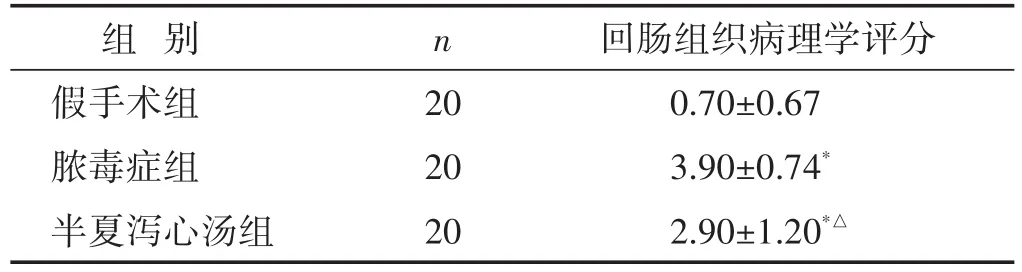
表1 各组大鼠回肠组织病理学评分比较(分,±s)
注:与假手术组比较,∗P<0.05,∗∗P<0.01;与脓毒症组比较,△P<0.05,△△P<0.01。下同。
组别假手术组脓毒症组半夏泻心汤组n 20 20 20回肠组织病理学评分0.70±0.67 3.90±0.74*2.90±1.20*△
2.3 各组大鼠回肠组织HO-1及TNF-α、IL-6、IL-10含量比较 见表2。脓毒症组、半夏泻心汤组大鼠HO-1及TNF-α、IL-6、IL-10水平较假手术组均明显升高(P<0.01)。半夏泻心汤组回肠组织HO-1、IL-10含量均较脓毒症组显著升高,而回肠组织TNF-α、IL-6含量较脓毒症组显著降低(均P<0.01)。
表2 各组大鼠回肠组织HO-1及TNF-α、IL-6、IL-10含量比较(pg/mL,±s)
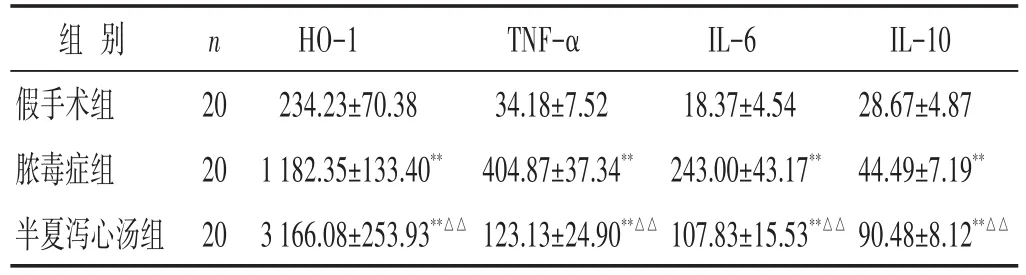
表2 各组大鼠回肠组织HO-1及TNF-α、IL-6、IL-10含量比较(pg/mL,±s)
组别假手术组脓毒症组半夏泻心汤组n 20 20 20 HO-1 234.23±70.38 1 182.35±133.40**3 166.08±253.93**△△TNF-α 34.18±7.52 404.87±37.34**123.13±24.90**△△IL-6 18.37±4.54 243.00±43.17**107.83±15.53**△△IL-10 28.67±4.87 44.49±7.19**90.48±8.12**△△
2.4 各组大鼠血清HO-1及TNF-α、IL-6、IL-10含量比较 见表3。脓毒症组、半夏泻心汤组大鼠血清HO-1及TNF-α、IL-6、IL-10水平较假手术组均明显升高(P<0.01)。半夏泻心汤组血清HO-1、IL-10含量均较脓毒症组显著升高,而血清TNF-α、IL-6含量较脓毒症组显著降低(均P<0.01)。
表3 各组大鼠血清HO-1及TNF-α、IL-6、IL-10含量比较(pg/mL,±s)
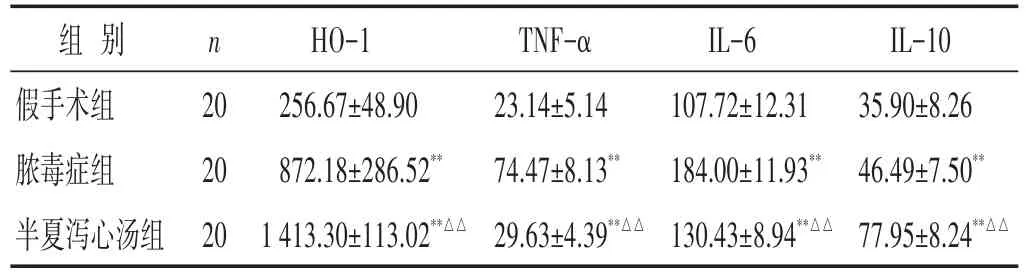
表3 各组大鼠血清HO-1及TNF-α、IL-6、IL-10含量比较(pg/mL,±s)
组别假手术组脓毒症组半夏泻心汤组n 20 20 20 HO-1 256.67±48.90 872.18±286.52**1 413.30±113.02**△△TNF-α 23.14±5.14 74.47±8.13**29.63±4.39**△△IL-6 107.72±12.31 184.00±11.93**130.43±8.94**△△IL-10 35.90±8.26 46.49±7.50**77.95±8.24**△△
3 讨 论
脓毒症是近年重症医学研究领域中的热点及难点,目前已证实胃肠道是脓毒症发生时首先侵犯的器官,也是脓毒症并发和加重多器官功能障碍综合征(MODS)的关键点[10]。因此保护和恢复胃肠道功能是治疗脓毒症的重要手段。脓毒症肠道损伤发生的早期,炎症诱导单核巨噬细胞、中性粒细胞和局部产生的过量TNF-α、白细胞介素-1(IL-1)等促炎细胞因子由局部进入血液循环,这些因子不仅自身激活,还能诱导IL-6、白细胞介素-8(IL-8)等炎症因子的增高,扩大色炎症因子激活引起级联反应,造成炎症介质的过度释放[11]。机体过度放大的炎症反应是导致脓毒症发病及加重的主要根源,研究证实核因子-κB(NF-κB)具有调控复杂的炎症细胞因子网络的重要作用。NF-κB由内毒素激活后,进入细胞核,通过调控TNF-α和IL-1等炎症介质的基因表达,进一步作用于巨噬细胞等产生大量IL-6、IL-8等继发性细胞因子和介质[12],与此同时,机体也开始释放IL-10等抗炎细胞因子,这些炎性介质和细胞因子反过来又可以进一步激活NF-κB,从而形成正反馈的级联放大效应,产生过度的炎症反应,进一步加重组织和细胞的损害[13]。有研究[14-16]显示,HO-1能够抑制NF-κB激活,减轻机体炎症反应。HO-1是一种应激诱导的蛋白,是降解血红素为胆绿素、一氧化碳(CO)和亚铁的限速酶[17]。应激状态下,HO-1通过维持微循环正常功能、抗炎症反应和抗氧化等机制保护细胞[13-22]。目前认为HO-1是调控炎症反应的关键环节之一,HO-1能够抑制NF-κB激活,从而影响级联效应调控炎症因子的表达,从而能减轻机体炎症反应。促炎细胞因子中TNF-α、IL-6是主要的细胞因子,而抗炎细胞因子IL-10具有抑制促炎细胞因子释放的作用。有研究[23-24]显示HO-1对脓毒症相关的肠损伤具有显著的保护作用。
对于脓毒症肠道损伤的治疗,目前主要以保护肠道屏障功能和维持胃肠道菌群分布为主[25],临床疗效较差,难以取得突破性进展。中医学认为脓毒症肠道损伤的根本病机为气机逆乱[31]。脓毒症肠道损伤,病位在脾胃中焦,中焦为沟通上下焦的枢纽,是逆转五脏气机逆乱的关键,中焦气机紊乱,阻碍气血津液的运行,引起全身气机紊乱。因此治疗脓毒症肠道损伤的根本治法为调节中焦气机。半夏泻心汤具有辛开苦降、调和脾胃阴阳的作用,切中脓毒症胃肠功能障碍的病机,临床以半夏泻心汤方加减以促气机之调畅,复肺之升降,从而改善脓毒症胃肠功能障碍患者转归及预后。
前期研究发现半夏泻心汤治疗脓毒症肠道损伤有一定的疗效[6,26],在观察半夏泻心汤治疗脓毒症肠道损伤的临床疗效实验中,发现应用半夏泻心汤组(治疗组)总有效率高于对照组,治疗组胃肠功能障碍评分、肠内营养耐受率、中医症状改善率、急性生理与慢性健康Ⅱ(APACHEⅡ)评分及血清白细胞计数、血清降钙素原水平均优于对照组[27]。进行动物实验发现,对SD大鼠进行脓毒症造模后,应用半夏泻心汤治疗,血清中反映肠道机械屏障损伤的指标(细菌内毒素、二胺氧化酶、D-乳酸)明显降低,小肠病理改变减轻[28]。本研究以前期研究为基础,利用ELISA法对血清及肠道组织中HO-1及炎症因子TNF-α、IL-6、IL-10进行水平检测,在蛋白水平进行分析研究,并通过分析HO-1的表达对炎症因子TNF-α、IL-6、IL-10的影响,进一步明确半夏泻心汤对肠道损伤的调控机制。结果发现半夏泻心汤组大鼠肠道组织黏膜损伤症状明显轻于脓毒症组,血清及肠道组织中HO-1水平升高,抗炎因子IL-10水平明显升高、促炎因子TNF-α、IL-6水平明显降低。综上所述,半夏泻心汤可上调脓毒症大鼠HO-1表达,抑制炎症反应,减轻肠道损伤。
本实验按照临床常规用药剂量进行研究,在前期预实验中进行药物剂量分组观察大鼠死亡率,证实本文研究剂量死亡率最低,但未证实其炎症因子及肠道损伤等指标相关性,后期实验需进一步完善。本实验研究已初步验证半夏泻心汤对脓毒症肠道损伤的保护与上调HO-1的表达有关,但药物与HO-1表达、肠道损伤之间的因果关系以及其他作用机制尚需进一步研究。
