初产妇足月前胎膜早破与基质金属蛋白酶-7及OAS1基因多态性的关系
2021-07-12潘瑞琪廖明星江梦曦陈玲娟艾承锦
潘瑞琪,廖明星,江梦曦,陈玲娟,艾承锦
0 引 言
妊娠37周(足月)前发生胎膜破裂称作未足月胎膜早破(preterm prelabor rupture of membranes,PPROM),约占所有早产比例的1/4,是导致围产儿死亡的重要原因[1]。目前PPROM发病机理尚未阐明;以往多围绕机械力学、感染及炎症等因素展开[2-3]。近年来越来越多国内外报道指出,遗传因素在PPROM发生中关键作用[4-5]。研究发现,PPROM所致自发性早产存在明显家族聚集性与种族差异性特点[6]。基质金属蛋白酶(matrix metalloproteinases,MMPs)属锌依赖性蛋白酶,系维持胎膜机械结构的重要因子,在妊娠期间通过介导胶原蛋白分解、细胞外机制重塑等维持胎膜结构完整性,同时可切割细胞外基质底物,调控妊娠重塑、血管生成[7]。MMP-7位于11 q21-22染色体,属MMPs家族成员,可降解蛋白多糖、弹性蛋白及纤维连接蛋白等,参与细胞外基质降解、介导炎症反应及细胞凋亡等过程[8]。前期研究发现MMP-7 rs1156818位点G等位基因启动子活性较A等位基因活性高,可引起MMP-7基因转录水平提升,介导炎症及细胞外基质降解过程,与PPROM患病存在一定的关联[9]。2′,5′-寡腺苷酸合成酶1(2′,5′ oligoadenylate synthetase 1,OAS1)属干扰素诱导内源性抗病毒蛋白,位于12号染色体,已证实与病毒感染性疾病发生密切相关[10]。而PPROM已证实与感染、炎症及自身免疫因素有关[11]。OAS1基因多个位点单核苷酸多态性可影响OAS1蛋白酶抗病毒活性,导致核苷转移酶活性转变,调节细胞因子分泌,而rs10774671位点为OAS1基因功能性单核苷酸位点,系基因启动子最关键功能性单核苷酸多态性,属第7外显子剪切受体,直接决定mRNA的剪接,可通过影响剪接影响产物酶活性,与多种感染性疾病发病及转归存在一定的关联[12]。因此,推测OAS1功能性单核苷酸多态性位点rs10774671基因多态性可能与PPROM遗传易感性有关。为验证以上结论,本研究采集PPROM初产妇与正常足月妊娠初产妇MMP-7、OAS1基因多态性,以明确以上基因多态性与PPROM发生的关系,总结胎膜早破的分子生物学机制,以期为胎膜早破病因学研究提供证据,旨在为PPROM预防提供参考。
1 资料与方法
1.1 研究对象回顾性分析2018年5月-2019年7月82例PPROM初产妇(PPROM组)临床资料。入组标准:①初产妇;②单胎、头位;③孕周明确;④符合参考文献[13]中关于PPROM诊断标准;⑤通过临床表现(阴道胎脂样液体流出或外阴异常湿润)、超声检查(羊水量少)、羊膜镜检查(直视胎儿先露部,但无法直视前羊膜囊)、实验室检查(胎儿纤连蛋白≥0.05 mg/L,胰岛素样生长因子结合蛋白1阳性)、阴道pH值(pH值>6.5)检查等确诊;⑥汉族;⑦无其他产科并发症或内外科合并症;⑧阴道分娩或剖宫产(非择期剖宫产);⑨临床资料完善。排除标准:①人为因素(人工破膜、应用催产素等)所致PPROM;②骨盆畸形者;③原因不明发热;④无吸烟饮酒史;⑤合并其他内外科疾病。另按1∶1比例选取同期于医院住院及分娩且年龄与之相仿的82例足月妊娠后分娩的初产妇作为对照。
1.2方法
1.2.1 标本采集①脐血标本:均于胎儿分娩后立即抽取脐带血4 mL,枸橼酸钠抗凝后4℃低温保存;②胎盘组织标本:胎盘娩出5 min内自近宫颈口胎膜破口处剪取约1 cm× 1 cm胎膜组织,无菌盐水冲洗,含RNA保护液冻存管保存,采血1周内提取DNA。
1.2.2基因型检测采用聚合酶链反应(polymerase chain reaction ,PCR)-限制性片段长度多态性(restriction fragment length polymophism,RELP)法测定MMP-7、OAS1基因型及等位基因分布。采集胎膜组织标本,参照美国Promega公司Trizol抽提试剂盒说明提取总RNA,组织标本加入少量液氮,快速研磨;组织变软后再加入液氮,研磨,重复3次。按每50~100 mg/mL标准加入Trizol,室温放置4 min,充分裂解,以12 000×g离心力离心5 min,弃沉淀,加入200 μL氯仿,振荡均匀,室温放置15 min;84 ℃下以12 000×g离心力离心15 min,吸取上层水相,加入异丙醇混合均匀,室温放置5~10 min,4 ℃ 8 000×g离心5 min,弃上清,干燥5~10 min,加入50 μL H2O(55~60℃)溶解RNA样品5~10 min,Namedrop 2000c型紫外分光光度计(美国Thermo Sci公司)确定纯度及浓度满意后,1%琼脂糖凝胶电泳(美国Bio-Rad公司YLN-200A型凝胶成像系统)检测DNA完整性,上GenBank查询MMP-7基因、OAS1基因引物序列,Primier 5.0软件设计目的基因引物,由上海生工生物工程有限公司设计及合成。MMP-7基因(rs1156818位点)引物序列:上游 5′-TGGTACCATAATGTCCTGAATG-3′,下游 5′-TCGTTATTGGCAGGAAGCACACAATGAATT-3′;OAS1基因(rs10774671位点)引物序列:上游5′-TCGTCGGTCTCATCGTCTGTACTGTTGCTTTAAGC-3′,下游5′-CCCCTACGTGGATCACTGACT-3′。PCR仪(美国ABI公司)进行PCR反应,MMP-7 PCR反应体系:DNA模板1.0 μL+10×buffer 2.5 μL+上下游引物各0.5 μL+dNTP10 mmol/L 0.5 μL+Taq-DNA聚合酶0.2 μL+双蒸水补足至25 μL,反应条件:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环,72℃修复延伸5 min;OAS1 PCR反应体系:模板DNA 1.0 μL+上下游引物各1.0 μL+2×Taq PCR Master Mix 12.5 μL+双蒸水水补足至25 μL,PCR反应体系:94℃预变性3 min,94 ℃变性30 s,64 ℃退火30 s,72 ℃延伸45 s,12个循环,72 ℃延伸12 min,94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸45 s,20个循环,72 ℃延伸12 min。均取PCR扩增产物10 μL加入上样缓冲液2 μL混合均匀,1.5%琼脂糖凝胶电泳(90 V,45 min),紫外分光光度计观察并拍照确定扩增成功,以灭菌去离子水作为阴性对照,获得PCR扩增产物参照PCR产物纯化试剂盒(美国Sigma公司)进行纯化,取PCR产物10 μL(多次重复获得稳定PCR产物),加入限制性内切酶(美国R&D公司)10 U及10×buffer 1 μL,37 ℃水浴消化过夜,反应终止后3%琼脂糖凝胶电泳分析基因型,MMP-7 rs1156818位点A等位基因无EcoR Ⅰ识别位点,消化后仍为150 bp完整片段;G等位基因EcoRⅠ识别位点别切开,消化后产物存在120 bp、30 bp两条光带;A/A纯合基因型为150 bp基因片段,G/G纯合型表现为120 bp、30 bp两条光带,G/A杂合基因型表现为150 bp、120 bp与30 bp三条光带。OAS1 rs10774671位点A等位基因经酶切后产物为264 bp与36 bp两条光带,G等位基因表现为300 bp一条光带,每批PCR扩增产物均以蒸馏水替代DNA作为阴性对照,均重复检测3次确定分型准确性。
1.2.3脐血MMP-7、OAS1测定采用酶联免疫吸附试验法(enzyme-linked immunosorbent assay,ELISA)测定脐血MMP-7表达(试剂盒购自美国Sigma公司);放射免疫法测定OAS1表达(试剂盒购自Eiken chemical公司),脐带血样本1500 r/min离心5 min,取上清液进行试验,严格按照试剂盒使用说明操作。美国Bio-Rad公司全波长酶标仪于450 nm波长处测定各孔光密度值(optical density,OD),绘制标准曲线计算MMP-7浓度;OAS1以DFM-96型放射免疫γ计数器(合肥众成机电技术开发有限公司)测定其浓度。
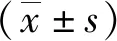
2 结 果
2.1 一般资料比较PPROM组与对照组孕妇年龄、体重指数差异无统计学意义(P>0.05)。PPROM组新生儿出生体重、新生儿出生1 min阿氏评分低于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 未足月胎膜早破与足月初产妇一般资料比较Table 1 Comparison of general data between primiparas with PPROM and full-term primiparas
2.2基因组DNA电泳结果DNA样品浓度范围在85~100 ng/μL之间,A260/A280在1.85~1.95之间,浓度、纯度均满足试验要求,见表2。样本均进行1%琼脂糖电泳发现各条带显示清晰,样品完整度好,满足试验要求,PCR扩增电泳发现各位点PCR扩增产物引物条带清晰,与预计产物片段大小基本一致。

表2 部分基因组NDA浓度及纯度测定结果Table 2 Concentrations and purity of NDA in some genomes
2.3基因位点基因型及等位基因频率分布依据基因测序结果,MMP-7基因 (rs1156818位点)、OAS1基因(rs10774671位点)基因型分布频率均满足Hardy-Weinberg遗传平衡要求(P>0.05),表明群体代表性较高。PPROM组、对照组MMP-7基因rs1156818位点基因型分布差异有统计学意义(P<0.05)。PPROM组携带AG型基因型所占比例高于对照组(P<0.05),携带G型等位基因比例高于对照组(P<0.05),见表3。PPROM组、对照组OAS1基因rs10774671位点基因型及等位基因频率分布比较差异无统计学意义(P>0.05),见表4。
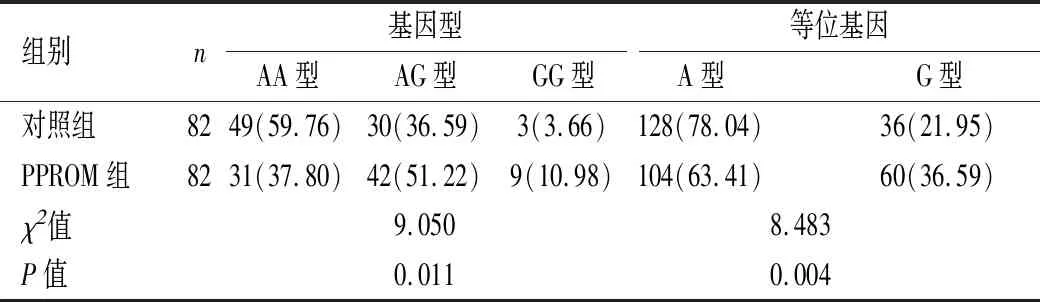
表3 MMP-7基因 (rs1156818位点)基因型及等位基因频率分布[n(%)]Table 3 Distribution of genotype and allele frequencies onMMP-7 gene (rs1156818 locus) n(%)
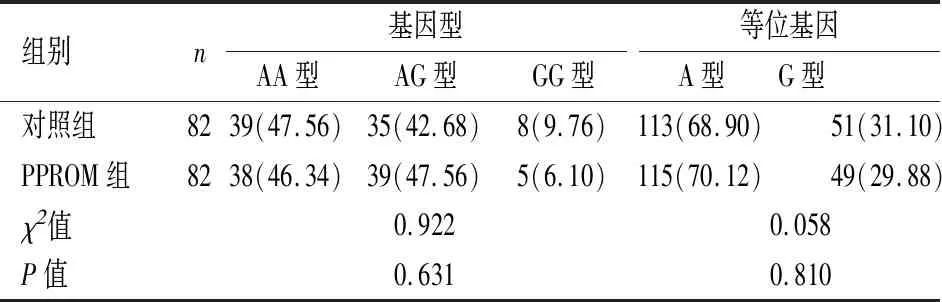
表4 OAS1基因(rs10774671位点)基因型及等位基因频率分布[n(%)]Table 4 Distribution of genotype and allele frequencies on OAS1 gene (rs10774671 locus) n(%)
2.4脐血MMP-7、OAS1浓度比较两组脐血OAS1浓度比较差异无统计学意义(P>0.05),PPROM组脐血MMP-7浓度高于对照组(P<0.05),见表5。

表5 两组脐血MMP-7、OAS1浓度比较Table 5 Comparison of the concentrations of MMP-7 and OAS1 in cord blood between the two groups
2.5MMP-7基因(rs1156818位点)多态性分布与PPROM关系Logistic回归分析显示:携带AG基因型可能使PPROM发生风险增加2.128倍(校正OR=2.128,95%CI:1.623~2.788);携带等位基因G可能使PPROM发生风险增加2.149倍(校正OR=2.149,95%CI:1.719~2.387),见表6。
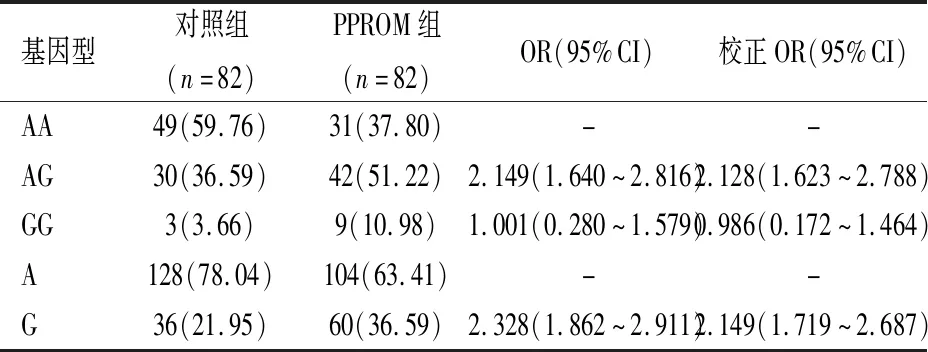
表6 MMP-7基因(rs1156818位点)多态性分布与PPROM关系[n(%)]Table 6 Relationship between polymorphism distribution of MMP-7 gene (rs1156818 locus) and PPROM n(%)
3 讨 论
胎膜系保护妊娠期间胎儿免受机械或物理因素影响的屏障,由胎膜细胞与细胞外基质组成,其中细胞外基质均由细胞自身合成,分泌至细胞外,为各类细胞提供支点与附着点[14]。足月前胎膜早破并早产是影响围产期新生儿预后的主要原因[15]。本研究发现,PPROM组新生儿出生体重、出生1 min阿氏评分均较对照组低,推测PPROM与新生儿低出生体重及新生儿窒息等不良事件存在关联。以往对PPROM的机制多围绕感染、羊水过多、胎位、多胎及营养因素等展开[16-17]。但部分未暴露于以上因素内孕妇仍可发生胎膜早破,提示除上述环境因素外,有其他因素参与PPROM发生过程[18]。近年来较多证据显示,遗传背景在PPROM发病中有关键作用[19-20]。流行病学资料调查发现,PPROM发生存在种族差异与家族聚集性。家族有早产史女性PPROM发生风险较无家族史女性更高[21]。较多国外报道显示,胎膜破裂过程中大量细胞外基质被降解;而MMPs可广泛切割细胞外基质分子,可能在胎膜早破中发挥一定的作用[22-23]。
MMP-7为一类锌依赖蛋白水解酶,属降解细胞外基质的主要酶类,由内皮细胞、巨噬细胞、粒细胞胶原细胞及结缔组织细胞等分泌,可将基质金属蛋白酶原形式转化为具活性基质金属蛋白酶,加速细胞外基质降解,破坏胎膜屏障[24]。MMP-7基因分子量较小,据报道,其启动子-181位点存在A/G基因多态性,认为该位点A→G突变可提升该基因转录活性,启动MMP-7基因转录,促进MMP-7蛋白表达[25]。尹玲凤等[26]发现,早产患者脐血、羊水、胎膜内MMP-7浓度均明显上调。张赐敏等[27]报道,MMP-7与肿瘤坏死因子-α等可通过协同介导炎症反应、细胞外基质降解,导致胎膜早破发生。本研究发现,PPROM组胎膜组织MMP-7 基因rs1156818位点基因型及等位基因频率分布与对照组正常足月产孕妇有明显差别,PPROM组携带AG型基因型比例及G型等位基因比例高于对照组;同时Logsitic回归分析发现,携带G等位基因女性较携带A等位基因女性PPROM发病风险高约2倍,肯定了PPROM发病与MMP-7的关系,支撑侯国花等[28]研究结论,但更进一步说明MMP-7基因rs1156818位点基因型及等位基因频率分布与PPROM易感性有关,提示与携带A型等位基因相比,携带G等位基因女性更易发生PPROM;提示G等位基因可能为PPROM易感基因。同时检测脐血MMP-7浓度发现,PPROM组脐血MMP-7浓度水平明显高于对照组,证实MMP-7可能与胎膜早破发生密切相关。分析机制可能为:MMP-7基因rs1156818位点A→G突变导致MMP-7转录活性上升,MMP-7蛋白释放进入血液,导致细胞外基质降解增多;同时其可降解促防御素、Fas-配体、上皮钙附着蛋白等细胞因子,刺激细胞迁移,介导炎症反应,破坏胎膜防御屏障,影响胎膜组织代偿性修复,增加胎膜早破发生风险。
已证实宫内或全身性感染与PPROM所致早产发生密切相关[29]。但最新报道发现,无论有无宫内感染,促分泌炎性因子肿瘤坏死因子-α、IL-6等均可从绒毛膜、蜕膜分离,认为感染仅为PPROM诱导因素而非必要条件[30]。OAS1系由I型干扰素诱导释放的内源性抗病毒蛋白,与病毒感染性疾病发生密切相关[31]。陈禄彪等[32]发现,肝炎病毒感染患者OAS1基因位点3′UTR区GG基因型所占比例较非肝炎低,认为OAS1基因多态性与肝炎发生有关。但对OAS1基因多态性与PPROM的关系尚未明确。本研究发现,PPROM组与对照组干扰素抗病毒蛋白OAS1 rs10774671位点基因型分布及等位基因频率与对照组无显著差异,两者等位基因分布规律类似,同时两组脐血OAS1浓度比较无明显差异,故本研究认为OAS1 rs10774671位点基因多态性与PPROM遗传易感性无关,推测PPROM可能更倾向为无感染的炎症性反应引起,而宫内感染并非PPROM发生的必要条件。但OAS1基因启动子区域含rs3741981、rs2285934、rs2660、rs1051042等单核苷酸多态性,均位于同一连锁不平衡区域,与rs10774671共同调节细胞因子平衡,仅分析rs10774671位点基因多态性与PPROM的关系存在一定的局限[33]。后续需对OAS1基因启动子区域其他位点单核苷酸多态性与PPROM的关系进行研究,以明确OAS1基因与PPROM发病是否存在一定的关系。
综上,MMP-7基因rs11568818位点单核苷酸多态性可能与初产妇PPROM易感性有关,携带等位基因G可能为PPROM发生的危险因素;而OAS1基因rs10774671位点单核苷酸多态性与PPROM易感性无明显关联。但本研究所有对象均为汉族女性,日后需扩大样本量,研究MMP-7基因多态性与不同民族PPROM发生的关系,以期为不同地区PPROM预防提供指导。
