茶树草螺菌促生剂的发酵制备与促生效果研究
2021-07-12雷佳倪雪晨程伟刘伟林尤恒丁坤明王行国
雷佳,倪雪晨,程伟,刘伟林,尤恒,丁坤明,王行国
(1.湖北大学生命科学学院, 湖北 武汉 430062; 2.咸宁市芽旗香茶叶研究中心,咸宁市农业科学院, 湖北 咸宁 437100)
0 引言

1 材料与方法
1.1 细菌菌株与培养茶树草螺菌(Herbaspirillumcamelliae) WT00C 由本实验室分离并保存. 细菌日常在含有5 μg /mL 壮观霉素和 10 μg /mL 氨苄青霉素的营养肉汤(NB) 培养基(蛋白胨10 g、牛肉膏3 g、NaCl 5 g、加水至1 L,pH 7.2) 中34 ℃培养,-80 ℃贮存. 放大培养时,先用NB 培养基活化,再用LB 培养基(胰蛋白胨10 g、NaCl 10 g、酵母提取物5 g、加水至1 L, pH 7.2) 37 ℃培养[1,4].
1.2 茶树内生草螺菌小规模发酵在上海保兴生物设备有限公司5 L发酵罐(Biotech)中加入3 L LB液体培养(1%蛋白胨,0.5%酵母提取物,1%氯化钠),121 ℃灭菌30 min. 待LB培养基冷却后,按照1%的接种量接入30 mL 活化过夜的茶树内生草螺菌WT00C种子液.依据早前研究的优化培养条件[1,4], 制定发酵条件,即温度为34 ℃、转速200 r/min、pH控制为7.0、通气量为1 vvm. 每隔一段时间进行一次取样并测定菌液OD600,待发酵菌液OD600值趋于平稳后停止发酵.
1.3 茶树内生草螺菌规模化发酵首先制备发酵种子液.使用小型发酵罐(5 L), 加入3 L LB液体培养(1%蛋白胨,0.5%酵母提取物,1%氯化钠)后121 ℃灭菌30 min. 待LB培养基冷却后,按照1%的接种量接入30 mL 活化过夜的茶树内生草螺菌WT00C.发酵条件设定温度34 ℃、转速200 r/min、pH 7.0、通气量为1 vvm、发酵6 h,OD600=1.0即为种子液.随后进行大规模发酵,配制200 L LB液体培养基,加入250 L发酵罐(上海齐瑞生物科技有限公司,QRTN-200)内,在线121 ℃灭菌30 min. 待罐内培养基温度降低至34 ℃时,按照1%的接种量加入种子液. 设定转速为200 r/min、 温度34 ℃、通气量1.0 vvm并发酵12 h.发酵12 h后停止发酵并下罐,OD600值可达 2.2.
1.4 促生剂的制备茶树内生草螺菌小规模发酵或规模化发酵时,发酵液的OD600值通常在2.0左右. 发酵液用新鲜LB培养基稀释至OD600=1.0,再加1%甘油即为促生剂.使用时通常用水稀释促生剂以获得工作液,如1∶1(V水∶V促生剂=1∶1)稀释的工作液用于茶树扦插杆的浸泡,而1∶2(V水∶V促生剂=1∶2)稀释的工作液用于大田修剪茶树的顶端喷洒.
1.5 促生剂存放条件试验18个500 mL培养瓶中分别加入500 mL发酵液并密封瓶口,然后分2组实验, 每组9瓶,一组加入1%甘油, 另一组不加甘油.每组分别置3瓶于4、25、37 ℃存放. 在不同时间取样并检测活细菌数,同时参照文献[1,4]的方法检测发酵液中IAA浓度.
1.6 促生剂对扦插苗的促生检测在咸宁市芽旗香茶叶研究中心、崇阳县白霓镇石山村茶园茶苗育种棚内选用两块地,每块7.5 m2(7.5 m×1 m),其中2.5 m2为对照组,剩余的5 m2为实验组.参照早前研究方法[4,6],将促生剂用清水按1∶1比例稀释,浸泡碧香早和福鼎大白扦插杆(5 mm)1 h. 然后按常规的扦插方法进行扦插. 对照组则用清水作相同的处理.扦插的行距为 8~10 cm,株距为 1~2 cm. 实验组和对照组的日常管理相同.扦插 160 d后观察结果.
1.7 促生剂对茶树促生的小规模测试在咸宁市芽旗香茶叶研究中心、崇阳县白霓镇石山村茶园选取一块栽种有机茶鄂茶1号的茶地, 其中8垄为实验用地,每垄长15 m ×1.5 m (22.5 m2). 8垄地块中, 其中2垄为对照组,其他为实验地块.待春茶采收完后,立即修剪并在实验组地块上按3 000 mL/m2喷洒促生菌剂.茶树内生草螺菌促生剂制备采用小型发酵罐发酵,并制备OD600=1的促生剂.按比例(V水∶V促生剂=2∶1、1∶1和1∶2)稀释后使用喷雾器喷洒.对照地块则喷洒等量的清水.然后,所有地块均按日常茶园管理法进行管理. 对照地和实验地分开单独采集样本(包括夏茶和秋茶),分别收集每类茶叶采收量的数据并进行统计分析.
1.8 促生剂对茶树促生的大田实验示范地设阳性对照地、 阴性对照地和实验示范地,其具体规划见表1.年前冬季按照规划准确、均匀地完成菜籽饼肥的施用.待春茶采收完后,立即修剪并在实验用地中的茶树上按64.5 mL/m2喷洒1∶2稀释的促生菌剂.尔后按日常茶园管理法进行管理.对照地和实验地分开单独采集样本(包括夏茶和秋茶).分别收集每类茶叶采收量的数据并统计单位亩产量.

表1 示范地规划与饼肥施用
采用大规模发酵生产茶树内生草螺菌促生剂. 细菌发酵液完成发酵后,用新鲜的LB稀释至OD600=1.0,然后加入1%甘油即为茶树内生草螺菌促生剂.制备完成后,第二天运输至茶叶基地.当天修剪茶园后,将茶树内生草螺菌促生剂按比例(V水∶V促生剂=1∶2)稀释后使用喷雾器喷洒,喷酒量为64.5 mL/m2.对照地不喷酒.
1.9 数据采集及分析制作0.5 m2的塑料框(长×宽=0.5 m×1 m).然后按照茶地形状随机在每块地内选取9个点,将框放在每个点上,并将框内全部的嫩芽枝条剪下,计数和称重.然后计算出0.5 m2内嫩芽平均数目、嫩芽平均总质量(g)以及单个嫩芽平均质量(g).实验数据使用SPSS软件分析,P≤ 0.05即为显著性差异.茶叶质量检测由农业部茶叶质量监督检验测试中心完成.
2 实验结果
2.1 茶树草螺菌促生剂的制备与稳定性在转速为200 r/min、 温度34 ℃、通气量1.0 vvm发酵条件下,用LB培养基发酵茶树内生草螺菌WT00C,无论是小规模化发酵还是规模化发酵,细菌的发酵生长类似,细胞密度为OD600=2.0~2.2. 细菌的发酵生长曲线见图1(A). 细胞生长良好、分布均匀、呈革兰氏阴性且无其他细菌污染(见图1(B)).
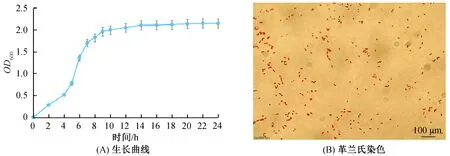
图1 发酵罐发酵时茶树草螺菌WT00C的生长曲线和革兰氏染色
为了检测茶树草螺菌促生剂的稳定性,将促生剂置于不同温度(4、25、37 ℃)条件下存放,结果见图2.图2(A)显示促生剂中的茶树草螺菌在4 ℃似乎不再增殖且随着时间的延长活细菌逐渐减少,21 d时活细菌减少一半. 与4 ℃不同,置于25和37 ℃的细菌在15 d内活细菌数明显增加. 只是15 d后活细菌急速减少. 18 d时活细菌数减少至15 d时的一半,23 d后细菌几乎完全无活性. 另外, 加入1%甘油似乎对细菌的活性无影响. 同时,我们也检测了促生剂中IAA的浓度. 置于4、25、37 ℃条件下存放30 d,促生剂内的IAA含量稍有增加但无显著性差异(见图2(B)).这些结果显示,茶树草螺菌促生剂可在常温条件下存放15 d.也就是说,常温条件下存放茶树草螺菌促生剂应在15 d内使用完.
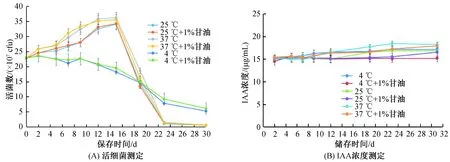
图2 茶树草螺菌促生剂在4、25和37 ℃存放不同时间的活细菌和IAA浓度测定结果
2.2 茶树草螺菌促生剂对扦插杆生根长芽的促生效果使用茶树草螺菌促生剂对扦插杆处理后进行扦插,160 d后观察结果. 图3(A)显示促生剂处理后扦插苗的生长状况.与对照相比,促生剂处理后扦插苗生长旺盛,不定根数目和株高都优于对照组.碧香早和福鼎大白扦插杆的成活率都达到88.5%,比对照组高15.3%. 随机取1 000 株进行统计分析,碧香早和福鼎大白扦插苗的根数目明显增多,比对照组增加40%~50%. 根的长度也明显增加,碧香早扦插苗根的长度比对照组增长62.5%.新生苗的长度也显示增加,福鼎大白扦插苗的长度比对照组增加30% (见图3(B)). 这些结果说明茶树草螺菌促生剂对扦插杆不定根的形成和顶芽的生长具有明显的促生作用,促生剂的促生效果与早前报道的摇瓶培养的茶树草螺菌菌液的效果[4,6]一致.

图3 茶树草螺菌促生剂处理碧香早和福鼎大白扦插杆的扦插苗生长比较与数据统计
2.3 茶树草螺菌促生剂对茶树生长的促生作用为了检测茶树草螺菌促生剂对对茶园茶树生长的促生作用,首先在咸宁市芽旗香茶叶研究中心、崇阳县白霓镇石山村茶园选取栽种有机茶鄂茶1号的茶地进行小规模测试.分别使用不同比例稀释的细菌培养物喷洒机械修剪后的大田茶树,菌液喷洒量为63 mL/m2.60 d后采样收集夏茶数据.图4显示喷洒细菌后茶树生长旺盛,无任何病症.采样时,每组分6区采集新长出的幼嫩茶枝,每区100株,称湿重和测量长度,共计600株.统计分析显示每组6个区采集的样本重量和长度之间无明显差异(P> 0.05).不同比例稀释的内生草螺菌喷洒的茶树修剪枝,长出的新生幼枝平均长度和100株平均重量均大于清水喷洒对照组(P> 0.05) (见图5(A、B)). 春茶采收后进行机械修剪,60 d后进行秋茶采样.每组600株,称湿重并测量长度(见图5(C、D)).统计分析显示秋茶的采样结果与春茶相似,1∶2和1∶1稀释喷洒组中,新生幼枝平均长度和100株平均重量虽略有下降但均大于对照组,尤其在2∶1稀释喷洒组中,新生幼枝平均长度和100株平均重量都大于对照组,差异极显著(P< 0.01). 茶树草螺菌促生剂有效促进大田茶树修剪后新生芽的生长,提高茶叶产量(每666.67 m2鲜重增加约8 kg).这些结果与早前摇瓶培养的实验结果[4]相似.同时,我们检测了2次取样样本的茶叶组分.与对照组比较,实验组茶叶中茶多酚、咖啡碱、氨基酸等主要成分均无显著性变化(P>0.05),说明茶树内生草螺菌促生剂处理不会影响茶叶的质量.

图4 茶树内生草螺菌喷洒修剪茶树后60 d的生长状况

图5 茶树内生草螺菌喷洒修剪茶树的实验结果
2.4 50亩大田示范效果在咸宁市芽旗香茶叶研究中心、崇阳县白霓镇石山村茶园选取栽种有机茶鄂茶1号的茶地33 333.5 m2(50亩)作为大田示范用地, 其中3 333.35 m2(5亩)为阴性对照,3 333.35 m2(5亩)为阳性对照,另26 666.8 m2(40亩)为大田实验地. 在实验用地中的茶树上按64.5 mL/m2喷洒1∶2稀释(V水∶V促生剂=1∶2)的促生剂后,60 d采集的夏茶数据和统计结果见图6. 图6显示喷洒细菌后的茶树生长旺盛、叶片碧绿且无任何病理症状. 表2和图7(A)的统计结果显示,同样施用0.337 kg/m2饼肥,喷洒组嫩芽平均数目、平均总重量及单个嫩芽平均重量等各项指标均明显优于阴性对照组. 喷洒组中的嫩芽总数目虽稍少于阳性对照组但单个嫩芽平均重量却高于阳性对照. 尽管喷洒组嫩芽平均数目和平均总重量弱小于阳性对照组,但与阴性对照组比较各项指标仍显著提升. 每666.67 m2(1亩)嫩芽重量呈37.4%的增加说明,喷洒茶树草螺菌促生剂可显著促进茶树的生长.

图6 喷酒实验组修剪喷洒后60 d的茶树长势

表2 喷洒草螺菌促生剂后夏茶采集数据结果
喷洒后所有地块都不再追加任何肥料,夏茶采收完后进行再次修剪但不再喷洒促生剖.修剪后60 d再次采集秋茶数据,统计结果见表3和图7(B).喷洒组嫩芽平均数目、平均总重量及单个嫩芽平均重量等各项指标不仅大于阴性对照组而且也超过阳性对照组.与夏茶相比,3个组秋茶嫩芽平均数目差异变化不显著但嫩芽平均总重量及单个嫩芽平均重量差异显著(P< 0.01). 与阳性对照组类似,喷洒组在春茶生长时既增加嫩芽的数目又增加嫩芽的重量,而在秋茶生长时主要增加嫩芽的重量. 每666.67 m2(1亩) 增加44.3%的嫩芽重量说明使用茶树草螺菌促生剂喷洒不仅显著增加嫩芽的重量而且促生剂的促生效果可维持约一年.喷洒一次茶树草螺菌促生剂的大田促生效力优于每m2多施0.113 kg饼肥的效力.

表3 喷洒草螺菌促生剂后秋茶采集数据结果

图7 喷酒实验组修剪喷洒后60 d的茶树夏秋茶采样的数据分析
3 讨论
前期实验室研究发现,茶树内生草螺菌不仅具有强的硒酸盐还原能力与硒酸盐耐受性而且对茶树也具有显著的促生作用[4-9].因此,离体发酵规模化生产十分必要.依照前期的优化条件,使用5 L小发酵罐和200 L大发酵罐在LB培养基、温度34 ℃、转速为200 r/min、通气量1.0 vvm发酵条件下发酵12 h,细菌OD600值可达2.2,比摇瓶培养的OD600值(1.2)高1.0. 由于茶树草螺菌是内生菌,较低的细菌OD600值是不难理解的,因为LB培养基的成分并不能满足细菌的最佳生长.由此可见,体外培养茶树内生草螺菌的培养基仍需进一步深入研究探讨.
茶树内生草螺菌促生剂由OD600值为1.0的茶树内生草螺菌发酵液加1%甘油. 1%甘油不影响细菌的生长繁殖,只是用来增加细菌对茶树切口处粘附,使细菌容易经切口进入茶枝或茶杆内定殖. 细菌定殖后才能有效地发挥其促生作用[4].茶树草螺菌促生剂在常温下的稳定性为15 d,促生剂制备后应在15 d内使用. 另外,大田使用时茶树内生草螺菌促生剂应按 1∶2稀释(V水∶V促生剂=1∶2),并按64.5 mL/m2喷洒.
与实验室前期摇瓶培养的细菌一样,茶树内生草螺菌促生剂对扦插杆不定根的形成和顶芽的生长都具有明显的促生作用. 使用茶树内生草螺菌促生剂喷洒顶端修剪后的茶树,明显促进大田茶树修剪后新生芽的生长并提高茶叶产量.茶叶质量检测显示使用茶树草螺菌促生剂的茶叶中茶多酚、咖啡碱、氨基酸等主要成分均与未使用促生剂的茶叶组分相似、无显著性变化.在33 333.5 m2(50亩)大田示范中,使用茶树草螺菌促生剂喷洒,获得了每666.67 m2(1亩)嫩芽重量增加82%的绩效,比阳性对照组(78%)还高4%. 再次说明茶树草螺菌促生剂可显著促进茶树生长、提高茶叶产量.这些结果表明,茶树草螺菌促生剂值得在茶场的茶树生产中推广应用.尤其是有机茶的生产中,施用肥料主要为各种饼肥[10],容易造成茶树生长时缺少氮源.应用茶树草螺菌促生剂不仅降低饼肥的使用、提高产量而且可解决有机茶生产中氮肥不足的问题.
