A位掺杂的LaFeO3纳米颗粒电化学性能的研究
2021-07-12闫鑫穗刘佳维顾磊周子健常豪然杨辅军
闫鑫穗,刘佳维,顾磊,周子健,常豪然,杨辅军
(湖北大学物理与电子科学学院, 铁电压电材料与器件湖北省重点实验室, 湖北 武汉 430062)
0 引言
燃料电池是一种可以直接将存储在燃料和氧化剂中的化学能转变为电能的装置,具有能量转换效率高、污染小及噪音很小等优势.其中,氧析出(OER)以及ORR性能是燃料电池和水解氢等可再生能源技术的核心.虽然Pt及其合金是催化效果很好的ORR催化剂,但它的价格非常昂贵不利于推广,并且Pt及其合金催化剂的稳定性不强,很难满足商用的需求.
作为典型的钙钛矿材料,LaFeO3因其环境友好、富含电子转移所需的氧空位、价格低、易制备、碱性环境中稳定等特点而成为催化领域的研究热点[1-3].经研究发现,钙钛矿材料的ORR反应催化效果取决于表面吸附性、内在活性和电子转移速率等诸多因素.钙钛矿材料的结构通式为ABO3,其中A位可能被稀土、碱土等大离子占据,而B位通常为过渡态金属阳离子.由于钙钛矿骨架的高度稳定性,在容忍因子范围内多种三价金属阳离子可以占据A和B位.而且,也可以用其他价态金属阳离子取代A和B位阳离子中的一个或两个.在这种情况下,为了保持电中性,钙钛矿材料可能形成阴离子、阳离子空位等结构缺陷.这些都可以改变B—O键以及增加氧空位含量从而提升钙钛矿材料的催化性能[4-6].本文中主要对比研究A位Bi离子不同替代比例下LaFeO3的ORR性能.
1 实验方法
本研究采用溶胶-凝胶法制备La1-xBixFeO3纳米颗粒.按照A位离子不同的掺杂量,确定硝酸铋和硝酸镧共0.02 mol/L、硝酸铁0.02 mol/L以及柠檬酸0.04 mol/L的实验方案.由于Bi元素在高温800 ℃下易挥发[7],所以本实验额外添加5%的硝酸铋.
La1-xBixFeO3纳米颗粒的制备主要包括三个步骤,溶胶的制备、预处理以及退火处理.首先,按计算好的比例将硝酸铁、硝酸铋和硝酸镧溶解在50 ml的乙二醇甲醚中,然后将装有上述试剂的锥形瓶放在磁力搅拌器上搅拌到完全溶解.待试剂全部溶解后再将柠檬酸加入其中,继续搅拌至完全溶解,此时得到澄清的红褐色溶胶.接下来进行预处理,将红褐色溶胶放在干燥箱内进行长时间高温干燥,最终形成褐色块状固体.然后将其在玛瑙研钵中研磨30 min,再将研磨的粉末在800 ℃下退火,最终制备出La1-xBixFeO3纳米颗粒.
为了研究La1-xBixFeO3材料的ORR催化性能,需要用三电极体系进行测试,玻碳电极、Ag/AgCl电极和铂丝分别作为工作电极、参比电极和对电极.首先将15 mg的La1-xBixFeO3粉末、10 mg乙炔黑和100 μL Nafion溶液(5%,质量分数)溶解在1 mL无水乙醇中超声分散1 h,然后取5 μL滴到玻碳电极上并在室温下干燥1 h.ORR性能需要在O2饱和的1 mol/L的KOH溶液中进行测量.测试之前需要将KOH电解质溶液进行通氧处理,氧通量为50 mL/min,时间为30 min.在之后的电化学测试中将氧通量变为20 mL/min.循环伏安(CV)测试在-0.7~0.6 V之间以50 mV/s的扫描速率进行,线性伏安(LSV)测试在-1 ~ 0 V之间以5 mV / s的扫描速率进行.
2 实验结果分析与讨论
在800 ℃空气气氛下退火的La1-xBixFeO3(x=0, 0.10, 0.15, 0.20)粉末XRD图谱如图1所示.Bi掺杂的La1-xBixFeO3(x=0, 0.10, 0.15, 0.20)粉末衍射峰与LaFeO3的PDF标准卡片(#37-1493)基本一致.Bi元素的掺杂没有产生任何杂峰,这表明实验通过溶胶-凝胶法将Bi3+离子成功引入了LaFeO3材料的晶体结构中.通过对比发现,随着Bi3+离子含量的增加,(121)衍射峰峰位逐渐向左移动,这一现象符合布拉格方程:2dsinθ=nλ.因为Bi3+的半径为0.117 nm,La3+的半径为0.116 nm,随着Bi3+掺杂量的增加使得d增大,于是使得衍射峰向低角度移动[8].衍射峰的偏移幅度很低主要是因为Bi3+和La3+的半径相差非常小且Bi3+掺杂量不大.
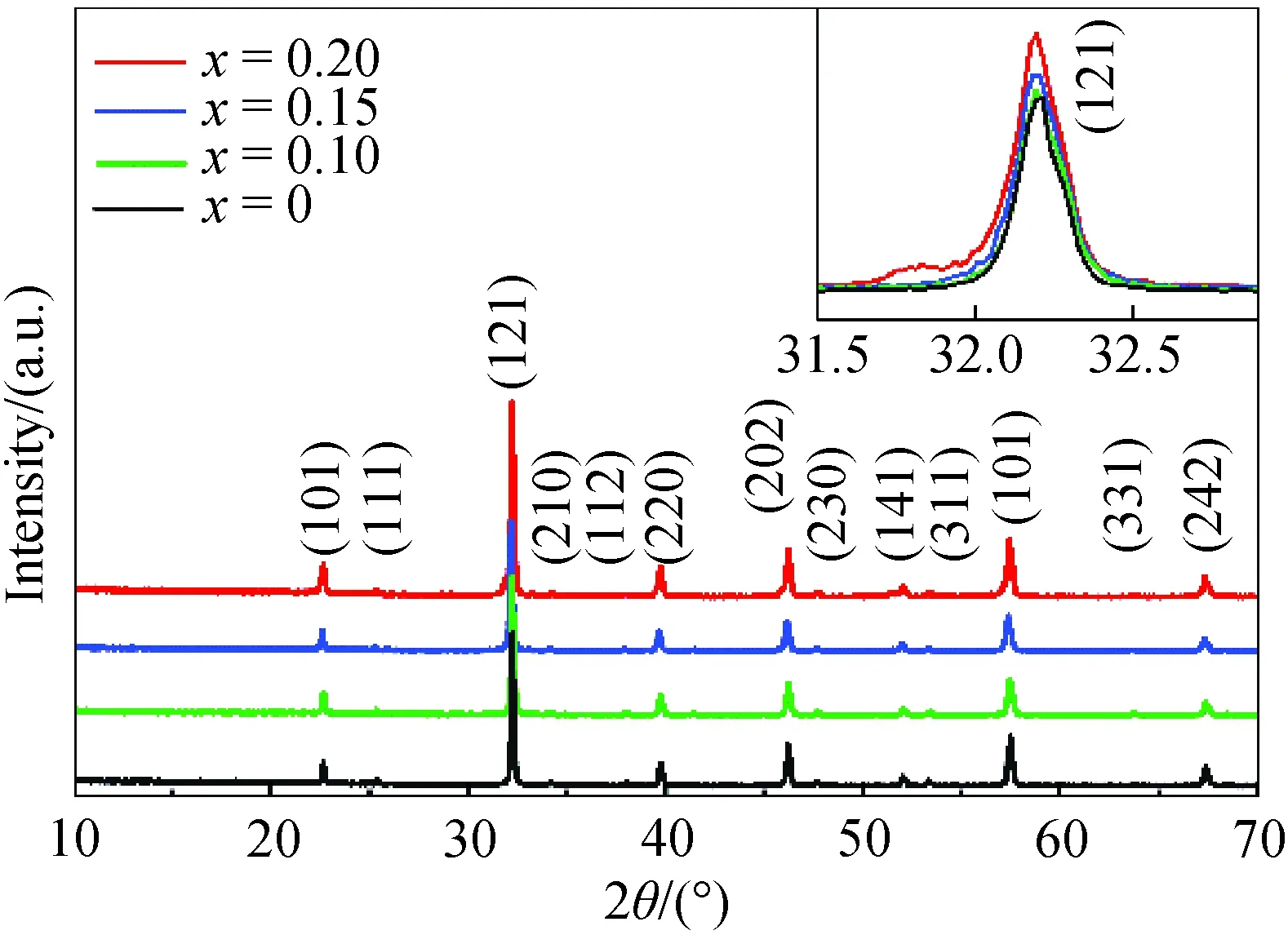
图1 La1-xBixFeO3粉末样品在空气中800 ℃退火后的XRD图
图2为La1-xBixFeO3(x=0, 0.10, 0.15, 0.20)粉末的SEM图.可以发现随着Bi3+离子掺杂量的增加,样品的晶粒尺寸逐渐增大并且出现团聚.据报道,LaFeO3的最佳烧结温度为800 ℃[9],而BiFeO3的最佳烧结温度为500 ℃[10].因此Bi元素的掺杂势必降低La1-xBixFeO3的最佳烧结温度,从而诱导晶粒的长大与团聚[11-12],这也导致样品比表面积的减少.

图2 La1-xBixFeO3粉末样品(a) x=0; (b) x=0.10; (c) x=0.15; (d) x=0.20在800 ℃退火后的SEM图
图3为50 mV/s扫速下La1-xBixFeO3(x=0, 0.10, 0.15, 0.20)粉末的循环伏安图.图3中-0.28 V的阳极峰以及-0.5 V的阴极峰分别对应Fe2+/Fe3+放电过程和Fe3+/Fe2+的充电过程,见公式(2)和(5),而0.28 V的阳极峰和0.35 V的阴极峰则对应于Fe3+/Fe4+放电过程和Fe4+/Fe3+的充电过程[13],见公式(1)和(4).氧化还原反应如下[14-15]:

图3 La1-xBixFeO3粉末样品在空气中800 ℃退火后的循环伏安曲线
Fe4++O2-→Fe3++O2
(1)
Fe3++ e-→ Fe2+
(2)
O2+2H2O+ 4e-→4OH-
(3)
Fe3+→Fe4++ e-
(4)
Fe2++ O2→Fe3++ O2-
(5)
4OH-→2H2O+ O2+4e-
(6)
可以看出,La1-xBixFeO3与未掺杂Bi元素的LaFeO3材料相比,La1-xBixFeO3材料的氧还原峰的强度明显增加.从图1的分析可知,因为Bi3+离子的半径比La3+离子的半径大,所以Bi3+离子的掺杂导致样品晶格的拉伸和扭曲,这将降低氧空位的形成能从而引起氧空位含量的变化[16-17],并进一步增强La1-xBixFeO3的ORR活性.虽然比表面积的减小将导致样品的催化活性减小,但Bi3+离子的掺杂更显著地增强样品的ORR活性.
图4显示旋转圆盘电极转速为1 600 r/min时,La1-xBixFeO3催化剂的线性伏安曲线,相应的起始电位,极限电流密度以及-1 V(vs.Ag/AgCl)电势下由KL斜率得到的转移电子数n.利用下列公式可以将 Ag/AgCl电极电位转化为标准氢电极电位[18]:
E(vs. RHE)=E(vs.Ag/AgCl) + 0.197 + 0.059 1 pH
其中,E(vs.RHE)是标准氢电极电位,E(vs.Ag/AgCl)是利用电化学工作站测得的 Ag/AgCl电极电位,pH是电解液的pH值,1 M的KOH溶液的PH值为14. Anchu Ashok等[19]在5 mv/s下测得LaFeO3的LSV,其极限电流密度仅为-1.9 mA/cm2.与其相比,本实验中La1-xBixFeO3催化剂的极限电流密度均相对较大(图4(c)).并且与LaFeO3催化剂相比,Bi掺杂的La1-xBixFeO3催化剂表现出更优的起始电位和更大的极限电流密度.这说明La1-xBixFeO3催化剂催化活性更高,催化反应更容易进行.图4(d)显示材料ORR动力学反应的转移电子数,可以看到La0.85Bi0.15FeO3的转移电子数显著增加,这可能是由于Bi3+离子的成功引入使得样品晶格发生拉伸和扭曲,从而引起氧空位含量的变化,并进一步增强其ORR活性[20].

图4 La1-xBixFeO3催化剂的(a) ORR线性伏安图;(b) ORR起始电位;(c) ORR极限电流密度;(d) 转移电子数n
根据Langmuir等温线模型[21],好的催化剂的Tafel斜率更低,此时电流密度随电位的增大而增大的速度越快,催化活性越好.塔菲尔斜率由下列公式可以计算得出[22]:
η=blog(J)
其中,b是塔菲尔斜率,J是电流密度,η为过电位.过电位的计算公式如下:
η=E(vs.RHE) - 1.23
根据以上公式对实验数据进行处理得到的塔菲尔斜率如图5所示.由图5可知随Bi元素的掺杂,La1-xBixFeO3材料的Tafel斜率逐渐降低.La0.85Bi0.15FeO3的Tafel斜率为74 mV·dec-1,略小于其他催化剂,这表明La0.85Bi0.15FeO3的ORR催化活性更好.

图5 1 600 r/min转速下La1-xBixFeO3催化剂ORR性能的Tafel图
3 结论
本文中研究Bi掺杂对La1-xBixFeO3(x=0, 0.10, 0.15, 0.20)催化性能的影响.Bi3+逐渐取代La3+导致材料晶体结构、氧空位以及表面积的变化,从而引起氧还原活性的显著增强.这4种催化剂中,La0.8Bi0.2FeO3电极有最优的起始电位0.773 V(vs. RHE),La0.85Bi0.15FeO3表现出最大的ORR极限电流密度以及最低的Tafel斜率.这些结果表明,Bi掺杂是一种优化晶体结构、提高表面氧空位、从而增强钙钛矿型电催化剂活性的有效方法.
