miR⁃32⁃5p靶向FOXN3调控EMT通路影响子宫内膜癌细胞迁移和侵袭
2021-07-10董艳杜安飞辛本勤曹佳伟
董艳 杜安飞 辛本勤 曹佳伟
作者单位:1.日照市妇幼保健院检验科,山东,日照276800
2.日照市莒县中医医院检验科,山东,日照276800
3.日照市中心血站,山东,日照276800
4.青岛市胸科医院检验科,山东,青岛266000
子宫内膜癌(endometrial cancer,EC)是最常见的妇科恶性肿瘤之一,发病率呈上升趋势[1]。标准治疗包括原发性子宫切除术和双侧输卵管卵巢切除术[1],为提高复发或转移患者的生存质量,个性化的分子靶向治疗也在进行研究和试验。研究显示胰腺癌中miR⁃32⁃5p 表达上调,并通过下调第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted onchro⁃mosome ten,PTEN)表达促进胰腺癌转移[2]。宫颈癌中miR⁃32⁃5p 低表达,miR⁃32⁃5p 通过靶向同源盒B8(homeobox B8,HOXB8)抑制宫颈癌细胞恶性行为[3]。有报道称EC 中miR⁃32⁃5p 高表达[4],但其在EC 中的作用并未阐明。叉头蛋白N3(Fork head Box N3,FOXN3)是一种转录抑制因子,参与细胞周期调控和肿瘤发生等过程[5]。研究显示FOXN3 在肝癌、肺癌、乳腺癌等恶性肿瘤中显著下调,上调FOXN3 可抑制癌细胞的上皮⁃间充质转化(epithelial mesenchymal transition,EMT)进程,抑制肿瘤转移,在癌症进展中充当抑癌基因角色[6]。本研究通过Starbase 预测发现,miR⁃32⁃5p与FOXN3可能存在靶向关系。
1 材料与方法
1.1 材料
人正常子宫内膜上皮细胞hEEC 购自北纳生物,EC 细胞JEC 由本院子宫内膜癌患者自愿捐赠,EC 细胞系Ishikawa 和HEC⁃1A 购自美国ATCC;McCoy's 5a 培养基、杜尔伯格伊戈尔培养基(dulbecco's modified eagle medium,DMEM)和胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;引物、miR⁃32⁃5p 模拟物(miR⁃32⁃5p)、miR⁃32⁃5p抑制剂(anti⁃miR⁃32⁃5p)、FOXN3 过表达载体(pcDNA⁃FOXN3)、FOXN3 抑制剂(si⁃FOXN3)和对照(miR⁃con、anti⁃miR⁃con、si⁃con 和pcDNA⁃con)、FOXN3 的野生型(wild type,WT)和突变型(mutant type,MUT)双荧光素酶报告载体购自上海吉玛制药有限公司;FOXN3 抗体、E⁃钙粘蛋白(E⁃Cadherin)抗体、N⁃钙粘蛋白(N⁃Cadherin)抗体和波形蛋白(Vimentin)抗体购自英国Abcam 公司;β⁃actin 抗体购自上海碧云天生物技术有限公司;双荧光素酶报告系统购自美国Promega 公司;Lipofectamine 2000 转染试剂、总RNA 提取试剂盒、real⁃time PCR 试剂盒、反转录试剂盒购自美国Invitrogen 公司;光学显微镜、全自动酶标仪、发光仪和Real⁃time PCR 仪购自美国Bio⁃Rad 公司。
1.2 方法
1.2.1 细胞培养、转染
在DMEM 高糖培养液中分别培养hEEC、Ishi⁃kawa 和JEC 细胞,在McCoy's 5a 培养液中培养HEC⁃1A 细胞,培养液中均添加10%FBS、100 U/mL青霉素和100 μg/mL 链霉素,培养条件:在饱和湿度、37℃5%CO2培养箱中培养细胞,消化传代。以2×l06个细胞/mL 接种Ishikawa 细胞于6 孔板培养,当细胞基本融合为一层时根据Lipofectamine 2000转染试剂说明书进行转染。未转染细胞记为正常对照(NC)组(①组)。根据转染物不同分为anti⁃miR⁃32⁃5p 组(②组)、anti⁃miR⁃con 组(③组)、pcDNA⁃con组(④组)、pcDNA⁃FOXN3 组(⑤组)、miR⁃con 组(⑥组)、miR⁃32⁃5p 组(⑦组)、anti⁃miR⁃32⁃5p+si⁃con组(⑧组)、anti⁃miR⁃32⁃5p+si⁃FOXN3组(⑨组)、miR⁃con+WT⁃FOXN3 组(⑩组)、miR⁃32⁃5p+WT⁃FOXN3组(○1组)、miR⁃con+MUT⁃FOXN3 组(○12组)、miR⁃32⁃5p+MUT⁃FOXN3 组(○13组)。转染48 h,收集细胞,qRT⁃PCR 检测Ishikawa 细胞中miR⁃32⁃5p 或FOXN3 表达水平来验证转染效果,进行后续实验。
1.2.2 qRT⁃PCR 检测RNA 的表达
用Total RNA 提取试剂盒从EC 细胞中提取细胞总RNA,然后反转录合成cDNA,反应程序为30℃10 min,42℃30 min,99℃5 min;4℃5 min。cDNA 并检测,然后以cDNA 为模板,按照real⁃time PCR 试剂盒的说明书进行反应,合成miR⁃32⁃5p 和FOXN3 mRNA,反应程序为:95℃2 min;95℃30 s、60℃40 s、72℃45 s,35 个循环;72℃5 min。运用2⁃ΔΔCt方法进行数据分析。
1.2.3 Transwell 检测细胞迁移和侵袭能力
用无血清DMEM 培养液稀释细胞至浓度2×105个细胞/mL,Transwell 上室加100 μL 细胞悬液,下层加含20% FBS 的培养液。培养箱孵育24 h,用无菌棉签拭去上层小室未迁移细胞,5%甲醛固定迁移细胞,0.1%结晶紫染色,显微镜随机选择5个视野拍照、计数,以平均值表示Ishikawa 细胞侵袭数量。采用Matrigel 基质胶包被的Transwell 装置,其他步骤同迁移实验。
1.2.4 Western blot 实验
RIPA 裂解液室温裂解各组Ishikawa 细胞,BCA试剂盒检测蛋白浓度。以β⁃actin 为内参照,分析蛋白水平。
1.2.5 双荧光素酶报告系统实验
将构建的WT⁃FOXN3 和MUT⁃FOXN3 分别与miR⁃con 或miR⁃32⁃5p 共转染Ishikawa 细胞,转染48 h,裂解细胞,离心收集上清,直接检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
1.3 统计学处理
用SPSS 19.0 软件进行数据统计分析;计量资料以()表示,两组间采用独立样本t检验,多组间采用单因素方差分析;以P<0.05为差异有统计学意义。
2 结果
2.1 EC 系中miR⁃32⁃5p 和FOXN3 的表达情况
与hEEC 细胞相比,Ishikawa、HEC⁃1A 和JEC组细胞中miR⁃32⁃5p 表达量均显著升高,差异有统计学意义(P<0.05),FOXN3mRNA 和蛋白表达量均显著下降,差异有统计学意义(P<0.05)。见表1。
表1 EC 细胞系中miR⁃32⁃5p 和FOXN3 的表达情况(±s)Table 1 Expression levels of miR⁃32⁃5p and FOXN3 in EC cell lines(±s)
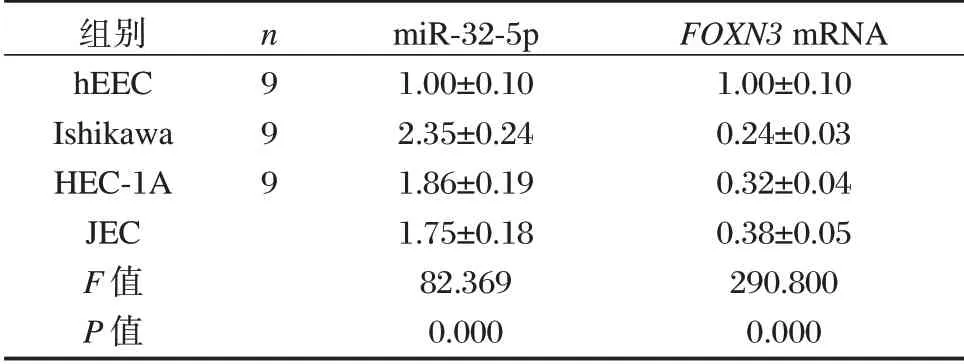
表1 EC 细胞系中miR⁃32⁃5p 和FOXN3 的表达情况(±s)Table 1 Expression levels of miR⁃32⁃5p and FOXN3 in EC cell lines(±s)
组别hEEC Ishikawa HEC⁃1A JEC F 值P 值n9 9 9 miR⁃32⁃5p 1.00±0.10 2.35±0.24 1.86±0.19 1.75±0.18 82.369 0.000 FOXN3 mRNA 1.00±0.10 0.24±0.03 0.32±0.04 0.38±0.05 290.800 0.000
2.2 miR⁃32⁃5p 低表达对Ishikawa 细胞迁移和侵袭的影响
与anti⁃miR⁃con 组相比,anti⁃miR⁃32⁃5p 组的Ishikawa 细胞中miR⁃32⁃5p 表达量显著降低,差异有统计学意义(P<0.05);E⁃Cadherin 表达升高,N⁃Cadherin 和Vimentin 表达量均降低(P<0.05),迁移和侵袭细胞数均显著降低(P<0.05)。见表2。
表2 miR⁃32⁃5p 低表达对Ishikawa 细胞迁移和侵袭的影响(±s,n=9)Table 2 Effects of miR⁃32⁃5p low expression on migration and invasion of Ishikawa cells(±s,n=9)

表2 miR⁃32⁃5p 低表达对Ishikawa 细胞迁移和侵袭的影响(±s,n=9)Table 2 Effects of miR⁃32⁃5p low expression on migration and invasion of Ishikawa cells(±s,n=9)
组别①组②组③组F 值P 值miR⁃32⁃5p 1.00±0.11 1.00±0.10 0.38±0.04 145.975 0.000 E⁃Cadherin 0.32±0.03 0.30±0.04 0.75±0.08 196.079 0.000 N⁃Cadherin 1.10±0.12 1.15±0.13 0.45±0.05 121.820 0.000 Vimentin 0.90±0.10 0.92±0.09 0.38±0.04 128.467 0.000细胞迁移数量223.05±22.50 225.46±22.34 102.78±10.38 119.350 0.000细胞侵袭数量150.43±15.27 146.45±13.65 81.16±8.11 84.173 0.000
2.3 FOXN3 高表达对Ishikawa 细胞迁移和侵袭的影响
与pcDNA⁃con 组相比,pcDNA⁃FOXN3 组的Ishikawa 细胞中FOXN3 表达量显著升高(P<0.05),E⁃Cadherin 蛋白表达水平显著升高(P<0.05),N⁃Cadherin 和Vimentin 蛋白表达水平显著降低(P<0.05),细胞迁移和侵袭数量显著降低(P<0.05)。见表3。
表3 FOXN3 高表达对Ishikawa 细胞迁移和侵袭的影响(±s,n=9)Table 3 Effects of FOXN3 overexpression on migration and invasion of Ishikawa cells(±s,n=9)

表3 FOXN3 高表达对Ishikawa 细胞迁移和侵袭的影响(±s,n=9)Table 3 Effects of FOXN3 overexpression on migration and invasion of Ishikawa cells(±s,n=9)
组别①组④组⑤组F 值P 值FOXN3 0.30±0.03 0.35±0.04 0.85±0.09 235.613 0.000 E⁃Cadherin 0.35±0.04 0.36±0.05 0.72±0.07 133.300 0.000 N⁃Cadherin 1.08±0.11 1.05±0.12 0.45±0.06 113.292 0.000 Vimentin 0.88±0.08 0.90±0.09 0.41±0.04 128.963 0.000细胞迁移数量225.01±22.51 224.18±22.52 98.25±9.91 129.195 0.000细胞侵袭数量153.28±15.39 148.07±15.03 72.18±7.50 107.199 0.000
2.4 miR⁃32⁃5p 靶向FOXN3
FOXN3 的3'⁃UTR 与miR⁃32⁃5p 的结合位点,见图1。与miR⁃con+WT⁃FOXN3 组相比,miR⁃32⁃5p+WT⁃FOXN3 组Ishikawa 细胞的荧光素酶相对活性显著降低(P<0.05);而与miR⁃con+MUT⁃FOXN3 组比较,miR⁃32⁃5p+MUT⁃FOXN3 的荧光素酶相对活性无明显变化。与anti⁃miR⁃con组比较,anti⁃miR⁃32⁃5p 组Ishikawa 细胞中FOXN3表达量显著升高(P<0.05)。见表4、表5。

图1 miR⁃32⁃5p 靶向调控FOXN3 表达Figure 1 miR⁃32⁃5p targets and regulates the expression of FOXN3
表4 双荧光素酶活性检测(±s,n=9)Table 4 Double luciferase activity assay(±s,n=9)
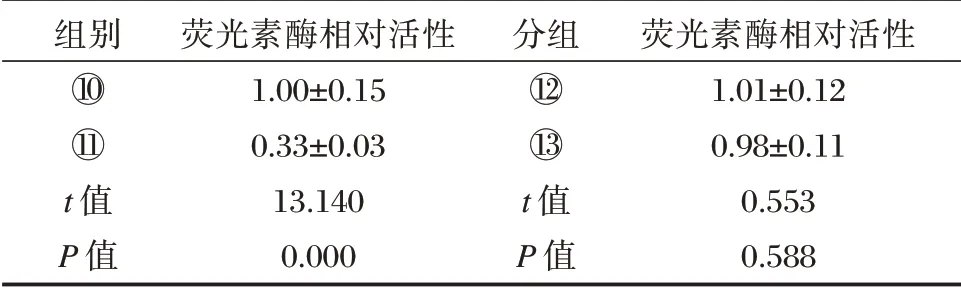
表4 双荧光素酶活性检测(±s,n=9)Table 4 Double luciferase activity assay(±s,n=9)
组别分组⑩○1○12○13 t 值P 值荧光素酶相对活性1.00±0.15 0.33±0.03 13.140 0.000 t 值P 值荧光素酶相对活性1.01±0.12 0.98±0.11 0.553 0.588
表5 Western Blot 检测FOXN3 的表达(±s,n=9)Table 5 The expression level of FOXN3 was detected by Western blot(±s,n=9)
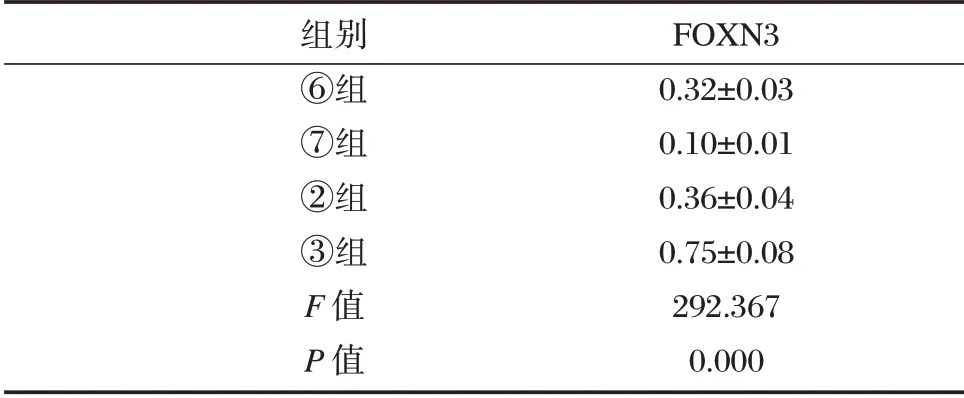
表5 Western Blot 检测FOXN3 的表达(±s,n=9)Table 5 The expression level of FOXN3 was detected by Western blot(±s,n=9)
组别⑥组⑦组②组③组F 值P 值FOXN3 0.32±0.03 0.10±0.01 0.36±0.04 0.75±0.08 292.367 0.000
2.5 敲减FOXN3 逆转miR⁃32⁃5p 低表达对Ishika⁃wa 迁移和侵袭的影响
与miR⁃32⁃5p+si⁃con 组相比,miR⁃32⁃5p+si⁃FOXN3 组的FOXN3 和E⁃cadherin 表达量显著降低(P<0.05),N⁃cadherin 和Vimentin 表达显著上升,迁移和侵袭细胞数均显著上升(P<0.05)。见表6。
表6 敲减FOXN3 逆转miR-32⁃5p 低表达对Ishikawa 迁移和侵袭的影响(±s,n=9)Table 6 Knockdown of FOXN3 reversed the effect of downr⁃expression of miR⁃32⁃5p on migration and invasion of Ishikawa cells(±s,n=9)

表6 敲减FOXN3 逆转miR-32⁃5p 低表达对Ishikawa 迁移和侵袭的影响(±s,n=9)Table 6 Knockdown of FOXN3 reversed the effect of downr⁃expression of miR⁃32⁃5p on migration and invasion of Ishikawa cells(±s,n=9)
组别②组③组⑧组⑨组F 值P 值FOXN3 0.35±0.04 0.76±0.08 0.78±0.09 0.42±0.05 97.339 0.000 E⁃Cadherin 0.30±0.03 0.70±0.10 0.72±0.08 0.38±0.04 89.079 0.000 N⁃Cadherin 1.10±0.13 0.40±0.04 0.42±0.05 1.00±0.10 160.568 0.000 Vimentin 0.90±0.10 0.36±0.04 0.40±0.05 0.80±0.09 122.541 0.000细胞迁移数223.67±22.37 113.46±11.35 110.32±11.04 200.49±20.05 107.308 0.000细胞侵袭数151.37±15.16 80.42±8.05 82.14±8.25 131.09±13.11 85.329 0.000
3 讨论
EC 多发于老年妇女,其发病率和死亡率呈上升趋势,发病年龄较前几年有所下降[7⁃8]。研究EC的分子抑制靶点,对患者的个性化靶向治疗具有重要意义。
miR⁃32⁃5p 在多种癌症中出现差异表达,在癌细胞的凋亡、化学敏感性、转移和耐药性中起着重要作用。前列腺癌中顺铂治疗后miR⁃32⁃5p 表达下调,参与调节前列腺癌化学敏感性[9]。透明细胞肾细胞癌中miR⁃32⁃5p 高表达促进癌细胞侵袭和迁移,舒尼替尼也通过调控miR⁃32⁃5p 发挥抑癌作用[10]。肝癌多药耐药细胞中miR⁃32⁃5p 表达升高,诱导多药耐药[11]。miR⁃32⁃5p 在EC 中表达上调,其具体作用和机制尚不清楚。本研究结果表明,EC细胞系Ishikawa、HEC⁃1A 和JEC 中miR⁃32⁃5p 表达均显著升高,与上述研究结果[7]一致;采用表达差异较大的Ishikawa 细胞进行功能分析,结果表明低表达miR⁃32⁃5p 可抑制Ishikawa 细胞迁移和侵袭。说明miR⁃32⁃5p 在EC 的发展中具有重要作用。
Starbase 预测发现FOXN3 的3'⁃UTR 与miR⁃32⁃5p 存在结合位点,提示两者存在调控关系。FOXN3 编码叉头/翼螺旋转录因子家族的一个成员,可通过与Ski 相互作用蛋白(Ski interacting protein,SKIP)结合参与细胞基本过程调控,在肿瘤发生和对癌症治疗的反应中起重要作用[12]。结直肠癌中FOXN3 显著下调,被证实是N⁃cadherin的直接转录抑制因子,对肿瘤的迁移、侵袭和转移均具有重要作用[13]。FOXN3 在骨肉瘤中下调,上调FOXN3 抑制骨肉瘤迁移和侵袭[14]。FOXN3 在EC中的表达和作用尚不清楚。本研究结果说明FOXN3 在EC 细胞的转移中具有重要作用。此外,miR⁃32⁃5p靶向负调控FOXN3表达,敲减FOXN3部分逆转了抑制miR⁃32⁃5p 表达对Ishikawa 细胞迁移和侵袭的影响,证实了在EC 中两者存在调控关系。
EMT 是肿瘤细胞转移的重要前提,在此过程中上皮细胞极性丧失,形成了一种以细胞骨架重塑和迁移活动为特征的间充质样特性[15]。本研究发现,Ishikawa 细胞中miR⁃32⁃5p 低表达和FOXN3过表达均可抑制间质标志物N⁃cadherin 和Vimentin表达,促进上皮标志物E⁃cadherin 表达,抑制EMT进程,而敲减FOXN3 部分逆转了抑制miR⁃32⁃5p表达对细胞EMT 的影响,这与Chen 等[16]报道FOXN3 在舌鳞癌中的抗EMT 作用吻合。
综上所述,本研究证实,miR⁃32⁃5p 靶向FOXN3 可能通过抑制EMT 通路抑制EC 细胞的迁移和侵袭。miR⁃32⁃5p 可能是EC 的潜在分子靶点。
