活动性结核病铁过载小鼠模型建立及相关指标分析
2021-07-09李军丽石亚男占玲俊
李军丽,石亚男,占玲俊
中国医学科学院 北京协和医学院 1医学实验动物研究所 2新发再发传染病动物模型研究北京市重点实验室 3北京市人类重大疾病实验动物模型工程技术研究中心 4国家卫生健康委员会人类疾病比较医学重点实验室 5结核病中心,北京100021
铁是人体必需的微量元素之一,广泛分布于全身各种组织器官,对维持人体的各种生理功能和新陈代谢起重要作用。电子传递、细胞呼吸、细胞增殖与分化等过程中均需要铁的参与[1]。研究显示,铁是病原体毒力和生长的必需微量营养元素[2-4],机体铁负荷过载与结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)感染宿主后结核病(tuberculosis,TB)的发生发展密切相关,机体铁过载为胞内Mtb生长繁殖和毒力维持提供充足铁源,可促进体内Mtb增殖,加速活动性TB患者疾病进程[5-7]。Isanaka等[8]研究发现,TB-人类免疫缺陷病毒(human immunodeficiency virus,HIV)共感染者中,高血浆铁蛋白TB-HIV共感染者死亡风险是非高血浆铁蛋白TB-HIV共感染者的3倍。对比活动性TB患者、非活动性TB患者及健康人群中血清铁相关水平发现,TB的活动性与血清铁水平存在显著负相关[9]。此外研究显示,铁过载可通过诱导羟基自由基产生,激活巨噬细胞氧化应激或凋亡信号通路[10-12],下调TB患者抗Mtb防御型Th1反应[13-14],削弱机体抗Mtb保护性免疫应答,从而重新激活休眠的Mtb,促使潜伏性结核感染(latent tuberculosis infection,LTBI)的复燃。尽管铁过载对机体抗结核免疫应答损伤得到了部分阐明,但铁过载如何促进巨噬细胞内Mtb的生长及其在TB的发生发展机制尚需进一步探讨。然而,由于临床患者个体差异大,取材受限,难以深入研究铁过载与TB之间的关系。本研究拟采用外源性铁过载动物模型模拟临床情况,建立铁过载TB感染小鼠模型并分析铁代谢及Mtb相关指标,以期为后续铁过载与TB发病机制研究提供实验模型。
材料和方法
材料6~8周龄SPF级雌性C57BL/6N小鼠44只(体质量18~20 g)购自北京维通利华[SCXK(京)-2016-0006]。右旋糖酐铁注射液购自江西创导动物保健品有限公司,血清铁(serum iron,SI)、血清铁蛋白(serum ferritin,SF)、转铁蛋白(transferrin,TRF)及可溶性转铁蛋白受体(transferrin receptor,TfR)检测试剂盒购自江苏酶免实业有限公司,组织铁检测试剂盒购自南京建成生物工程研究所,普鲁士蓝染色试剂盒购自北京Solarbio公司,Mtb标准株H37Rv为本室保存(菌株号:93009),中性罗氏培养管购自珠海贝索生物,BACTEC MGIT 7H9分枝杆菌快速培养管购自美国BD公司。
铁过载小鼠模型建立采用完全随机法将20只C57BL/6N小鼠分为阴性对照、低剂量、中剂量和高剂量4组,每组5只。低、中、高剂量组分别经腹腔注射右旋糖酐铁3.75、7.50、15.00 mg/次,阴性对照组则经腹腔注射等体积生理盐水,3 次/周,共计4周。定期观察小鼠生长及精神状态,称重并记录。本研究获中国医学科学院医学实验动物研究所实验动物管理和使用委员会(IACUC)批准,批准号为:ZLJ2019002。
血清生化指标与组织铁含量测定建模完成后,小鼠采血并安乐死。外周血4 ℃凝结过夜,2000g4 ℃离心10 min,分离小鼠血清并检测 SI、SF、TRF及TfR含量。解剖取小鼠心脏、肝脏、脾脏、肺、肾脏及小肠等组织器官,称重后加1 ml生理盐水充分研磨并裂解组织碎片,12 000g4 ℃离心20 min,取上清并测定总蛋白浓度。血清生化检测按试剂盒说明书进行,组织铁测定则按试剂盒测定方法计算相同蛋白浓度下各组织铁含量。
铁过载小鼠Mtb感染采用完全随机法将24只C57BL/6N小鼠分成空白对照组、Mtb感染对照组、中剂量铁过载模型组和中剂量铁过载模型Mtb感染组,每组6只。其中,Mtb感染组小鼠经尾静脉注射对数生长期H37Rv单细胞菌悬液100 μl(1×106CFU/ml),空白对照组注射等剂量无菌生理盐水,于ABSL-3实验室(国卫ABSL3-059)正常饲喂,观察并记录小鼠临床表现,感染后4周解剖小鼠。
小鼠组织荷菌量测定ABSL-3实验室动物解剖台中解剖感染小鼠,取小鼠肺、脾脏和肝脏组织;拍照记录肺、脾脏和肝脏等器官大体病变情况,取小鼠左肺、脾头及肝小叶于生物安全柜内称重,依次经2%稀硫酸溶液、生理盐水分别漂洗30 s,1 ml生理盐水温和匀浆后进行10倍倍比稀释,分别取10-3、10-4和10-5稀释液50 μl均匀涂布于中性罗氏培养管内,37℃培养4周,计算相应的组织器官荷菌量。另取10-1稀释液500 μl 接种于BD BACTEC MGIT 960培养系统,通过记录报阳时间进行Mtb的快速检测。
组织切片HE染色与铁染色小鼠各组织器官用10%中性福尔马林溶液固定48 h,组织按长轴最大横切面修块、梯度乙醇脱水、石蜡包埋并切成5 μm厚度切片,HE染色后扫描载玻片并保存为NanoZoomer数字病理图像,不同视野下拍照并进行组织病理学分析。铁染色组织切片脱蜡至水,切片入Perls染液浸染20 min,蒸馏水充分冲洗切片5 min,入核固红染色液,淡染细胞核10 min,自来水冲洗5 s。常规脱水透明,中性树胶封固,晾干后拍照观察其病理形态改变及铁沉积程度。
统计学处理采用SPSS 16.0统计软件,结果以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
铁过载小鼠组织形态及体质量评估铁过载小鼠外观与正常小鼠无明显区别,自主活动稳定,精神状态平稳。解剖后正常小鼠各脏器组织表面光滑,无充血、水肿。铁过载小鼠肝脏颜色呈暗褐色,且随着右旋糖酐铁剂量增加而逐渐加深(图1),其他脏器组织无明显颜色及形态改变。阴性对照组,低、中、高剂量组的体质量增长百分比分别为25.47%、25.22%、24.74%、21.36%,其中,高剂量组的体质量增长明显低于阴性对照组(F=17.235,P=0.027)和低(F=15.206,P=0.031)、中剂量组(F=11.061,P=0.036)。

图1 不同剂量铁过载小鼠肝脏颜色及形态变化Fig 1 Liver color and morphology in mice with different doses of iron overload
铁过载小鼠组织铁含量变化铁过载小鼠以肝组织中含铁量最高,高剂量组的铁含量较阴性对照组增加近7倍(F=23.902,P=0.001),其余组织由高至低依次为脾脏、肾脏、小肠、心脏、肺。中剂量组心脏(F=19.023,P=0.002)、肝脏(F=16.501,P=0.001)、脾脏(F=10.098,P=0.003)、肺(F=12.956,P=0.001)、肾脏(F=17.224,P=0.005)、小肠(F=19.313,P=0.006)组织铁含量均显著高于阴性对照组。
低剂量组小鼠各组织铁含量中,肝脏(F=20.075,P=0.004)、脾脏(F=11.579,P=0.031)、肾脏(F=10.955,P=0.008)和小肠(F=14.671,P=0.027)显著高于阴性对照组,而心脏(F=19.023,P=0.715)和肺(F=23.193,P=0.902)组织铁含量与阴性对照组相比差异无统计学意义(图2)。

与阴性对照组比较,aP<0.05,bP<0.01aP<0.05,bP<0.01 compared with negative control图2 不同剂量铁过载小鼠组织铁含量(n=5)Fig 2 Iron content in tissues of mice with different doses of iron overload(n=5)
铁过载血生化指标变化铁过载小鼠分别于铁剂注射4周后取外周血血清进行 SI、SF、TRF及TfR检测,结果显示,阴性对照组SI水平为(19.95±5.64)μmol/L,明显低于低剂量组的(43.00±6.82)μmol/L(F=23.012,P=0.021)、中剂量组的(65.84±9.31)μmol/L(F=17.479,P=0.007)和高剂量组的(108.45±9.90)μmol/L(F=27.129,P=0.004);阴性对照组SF水平为(773.82±161.51)μg/L,明显低于低剂量组的(1063.68±65.15)μg/L(F=11.057,P=0.031)、中剂量组的(1344.08±168.57)μg/L(F=20.187,P=0.006)和高剂量组的(1694.73±44.45)μg/L(F=17.983,P=0.002)。低(F=10.106,P=0.071;F=23.179,P=0.231)、中(F=9.291,P=0.189;F=11.083,P=0.412)、高剂量组(F=13.102,P=0.271;F=9.232,P=0.397)小鼠的TRF及TfR水平与阴性对照组相比差异均无统计学意义(图3)。
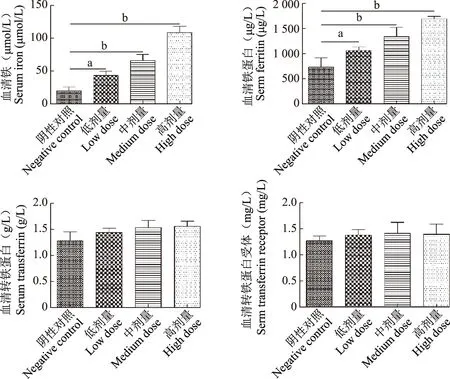
与阴性对照组比较,aP<0.05,bP<0.01aP<0.05,bP<0.01 compared with negative control图3 不同剂量铁过载小鼠血清铁、铁蛋白、转铁蛋白和转铁蛋白受体水平Fig 3 Serum iron,ferritin,transferrin,and transferrin receptor levels in mice with different doses of iron overload
铁过载小鼠组织HE染色与铁染色铁过载模型高剂量组小鼠肝脏、脾脏和肾脏组织HE染色均可见大量团状含铁血黄素沉积。肝细胞核固缩、溶解,胞浆内满布蛋白微粒;脾小体与红髓区界限不清;小肠及心脏组织可见部分含铁血黄素沉积,心肌纤维出现排列异常,炎性细胞浸润,充血水肿、出血等病理变化;肺部可见少数铁蛋白微粒,支气管和血管周围及其管腔内炎性细胞浸润,嗜酸性粒细胞及淋巴细胞渗出,并可见肺泡不均匀扩张,肺泡间隔断裂等。中剂量组和低剂量组仅肝脏和脾脏可见含铁血黄素沉积,且含铁血黄素沉程度与铁剂量呈正相关;心脏、肺、肾脏及小肠等组织未见明显含铁血黄素沉积及炎性细胞浸润,与阴性对照组相比无明显变化(图4)。普鲁士蓝染色与组织铁含量测定结果一致,阴性对照组小鼠各组织铁染色为阴性,高剂量组小鼠心脏、肝脏、脾脏、肺、肾脏和小肠等组织大量胞外铁和胞内铁呈颗粒状、块状亮蓝色铁沉积。中剂量组肝脏和脾脏组织铁沉积较明显,心脏、肺、肾脏和小肠仅可见少量铁沉积,均未见组织形态改变。低剂量组小鼠脾脏、肾脏和小肠可见微量铁沉积,而心脏和肺组织则未见明显铁沉积(图5)。
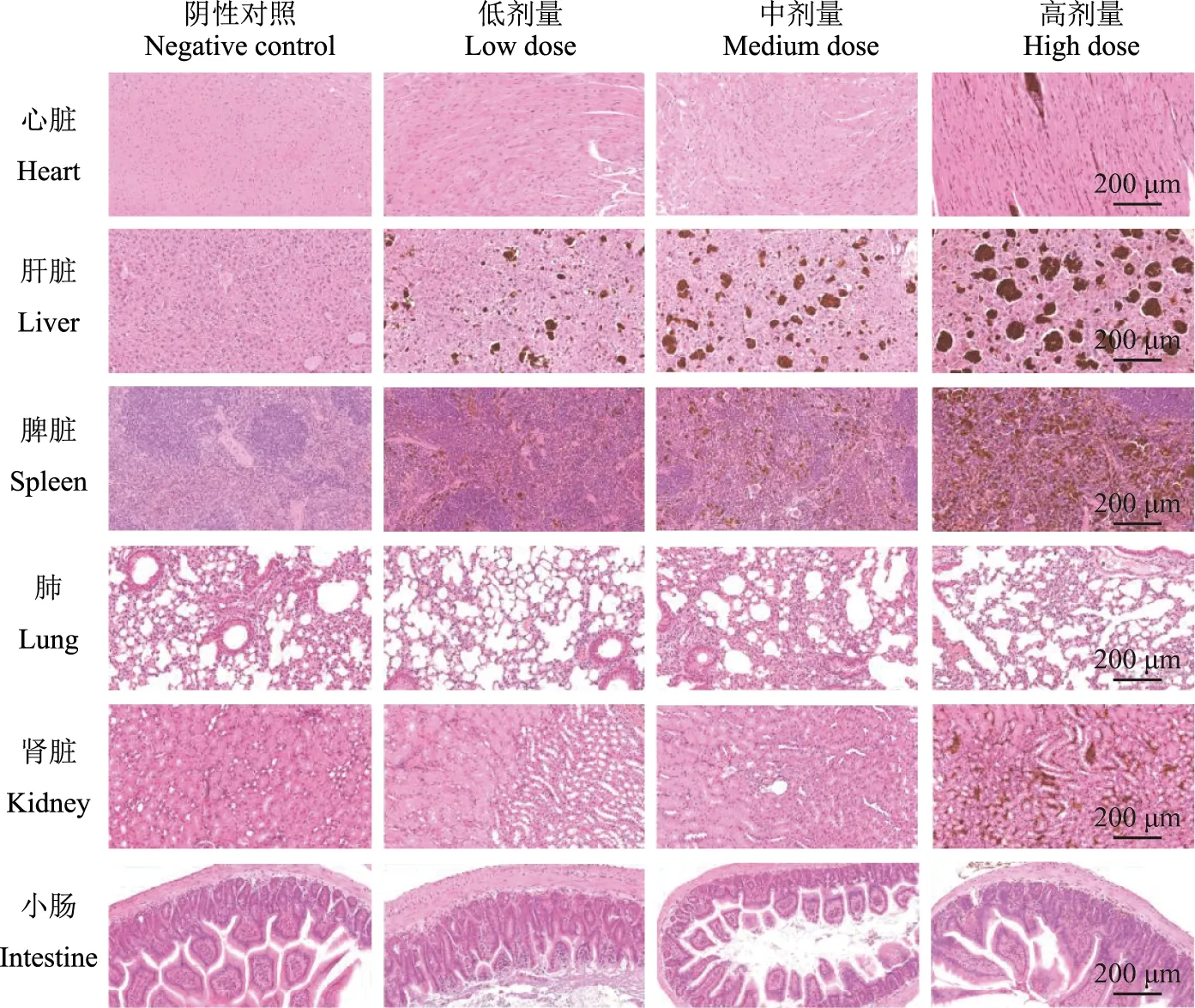
图4 不同剂量铁过载小鼠各组织HE染色Fig 4 HE staining of tissue sections of mice with different doses of iron overload

图5 不同剂量铁过载小鼠各组织普鲁士蓝染色Fig 5 Prussian blue staining of tissue sections of mice with different doses of iron overload
铁过载结核病小鼠组织荷菌量中剂量右旋糖酐铁建立的铁过载小鼠模型进行Mtb感染实验,感染后4周解剖并进行肺、脾脏和肝脏病理分析和荷菌量检测,结果显示,铁过载结核病小鼠模型构建成功。肺、脾脏及肝脏组织病理HE染色中铁过载Mtb感染组肺组织出现多处结核感染性炎症反应,呈实变趋势,其中肺泡壁增厚,肺泡腔被淋巴细胞等炎症细胞填充,结核性病变显著增加且多于Mtb感染对照组。脾脏白髓呈结核感染样病变,可见炎症细胞聚集,且病变较Mtb感染对照组严重。同样,铁过载Mtb感染小鼠肝脏可见水肿、淤血,光镜下肝细胞内可见团块状铁褐色沉积,Mtb感染后出现多个散在小肉芽肿样病变,可见铁过载肝脏病理改变和结核感染性病理特征(图6)。铁过载Mtb感染组的肺(F=23.227,P=0.017)、脾脏(F=19.023,P=0.021)和肝脏(F=17.392,P=0.009)的细菌培养报阳时间明显低于Mtb感染对照组,肺(F=21.012,P=0.007)、脾脏(F=20.173,P=0.002)和肝脏(F=19.091,P=0.005)的荷菌量明显高于Mtb感染对照组(图7)。
讨 论
随着对铁代谢的深入研究,铁缺乏不再是被关注的唯一问题,人们对机体铁负荷过载所引发的健康问题也越来越重视。临床上先天性代谢障碍可导致体内铁过度蓄积,持续性大量输血、长期内服铁剂或某些血液性疾病也可导致机体铁负荷过载[15-16]。铁作为催化剂在氧化还原反应中进行电子交换,这既是机体许多生命活动的基础,也是铁毒性作用的基础[17]。铁过载不仅严重影响患者的生活质量,对于疾病治疗效果、生存及预后也极为不利[18-19]。研究发现,机体铁过载与许多疾病的发生发展密切相关,特别是铁过载与TB发病机制目前已成为一个新的研究热点[20-23]。
本研究通过给小鼠定期定量腹腔注射右旋糖酐铁以构建铁过载模型。铁剂注射量最高达到15.00 mg/次,小鼠均未出现高铁不耐受导致死亡的情况,说明给铁剂量和小鼠品系选择的可行性。从SI、SF及各组织铁元素测定结果来看,小鼠体内铁沉积量随着铁剂注射量的增加而明显增高,且组内小鼠之间的铁含量检测结果重复性良好,与相关文献报道一致[24-25]。不同剂量铁过载小鼠TRF及TfR水平未见明显变化,推测与长期铁剂注射致机体对铁元素的吸收和利用达到饱和,同时与体内铁反应元件和铁调节蛋白等活性改变,进而在转录后水平调控TfR1的表达有关。铁过载小鼠肝脏、脾脏等组织均可见一定量的铁沉积,符合铁过载疾病临床患者的肝脾病理表现[26]。模型实验中,高剂量铁导致小鼠体质量增长减缓,同时出现肝脏和肾脏等病理损伤,而低剂量组小鼠心脏和肺组织经普鲁士蓝染色并未观察到明显的铁沉积,与阴性对照组无明显差异。因此,建议后续铁过载小鼠造模中给予中等剂量铁剂注射,特别是构建铁过载模型用于肺部疾病等研究。

箭头指示结核感染病变处Arrows show the lesions of tuberculosis infection图6 结核感染铁过载小鼠肺脾肝组织病理变化(HE)Fig 6 Pathological changes of lung,spleen and liver in iron-overloaded mice with tuberculosis infection(HE)

与右旋糖酐铁结核感染组比较,aP<0.05,bP<0.01aP<0.05,bP<0.01 compared with H37Rv+iron dextran group图7 结核感染铁过载小鼠肺、脾脏、肝脏组织荷菌量分析Fig 7 The bacterial loads in the lung,spleen and liver of iron-overloaded mice with tuberculosis infection
大量铁元素在重要脏器组织内沉积,尤其是肝脏、脾脏和肾脏等,导致各个脏器功能障碍和结构损伤[27-28]。这种损伤可进一步加重原发性或继发性铁过载,如地中海贫血、骨髓增生异常综合征、再生障碍性贫血等人群对Mtb的易感性[29]。为了进一步阐明铁过载与TB发生发展的机制关系,本研究在铁过载小鼠模型构建成功的基础上进行了活动性TB铁过载小鼠模型的建立。从Mtb感染小鼠的肺、脾脏和肝脏病理表征来看,活动性TB模型构建成功。感染后4周,小鼠肺、脾和肝脏均出现明显结核样病变,且各靶器官组织分离出大量Mtb。同时,铁过载Mtb感染组荷菌量高于Mtb感染对照组靶器官,这也符合铁过载人群TB易感的临床特征。
综上,本研究采用腹腔注射右旋糖酐铁成功建立了与临床上原发性铁过载患者情况基本相符的铁过载小鼠模型。通过血生化、组织铁以及组织病理检测分析等手段验证了该模型,进一步Mtb感染后成功构建了活动性TB铁过载小鼠模型。这为以后深入研究铁过载与其他复杂和异质性疾病发病机制以及推进新药发展和临床新治疗方案的评估奠定基础。同时,也为铁过载与活动性TB发生发展机制的深入研究提供了可靠的实验模型。
