基于GC-TOF/MS技术分析肾性高血压大鼠血清代谢组学变化
2021-07-09陈慧霞闫宇涵于慧王占黎胡海
陈慧霞,闫宇涵,于慧,王占黎,胡海
高血压是心脑血管疾病的常见危险因素,可诱发卒中、心力衰竭、心肌梗死和肾功能衰竭等[1]。肾性高血压是继发性高血压的一种,主要由肾动脉病变及肾脏实质性病变导致,病理改变包括结缔组织或间质组织增生、肾小球玻璃样变性、肾小管萎缩及肾细小动脉狭窄等,且易造成肾脏供血不足[2]。该病受遗传、生活方式和环境因素等影响,但其潜在的分子机制尚未充分阐明[3]。代谢组学通过定量检测体内小分子化合物水平,研究人体内基础代谢变化,为探索代谢性疾病的病因提供可靠依据[4]。目前对肾性高血压的代谢组学研究十分有限,本研究利用气相色谱-质谱(GC-TOF/MS)技术,探讨两肾一夹(2K1C)肾性高血压大鼠血清代谢物的变化趋势及其相关代谢通路,为肾性高血压的治疗提供新思路。
1 材料与方法
1.1 主要仪器与试剂 清洁级4周龄SD大鼠20只,体质量200~220 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK-(京)2016-0006。全自动无创血压测量系统(BP-300A,成都泰盟);安捷伦7890气相色谱仪(Agilent),飞行时间质谱仪(LECO);离心机、超低温冰箱(Thermo Fisher Scientific)、分析天平(Sartorius)、研磨仪(上海净信科技有限公司),超声仪(深圳市方奥微电子有限公司),烘箱(上海一恒科学仪器有限公司),真空干燥仪(太仓市华美生化仪器厂)。甲醇(CNW Technologies),氯仿、吡啶(Adamas),甲氧铵盐(TCI),核糖醇(SIGMA),BSTFA(REGIS Technologies),饱和脂肪酸甲酯(Dr.Ehrenstorfer)。
1.2 2K1C肾性高血压大鼠模型的建立 大鼠适应性饲养1周后尾套法测定大鼠尾动脉收缩压和体质量基线值。根据体质量编号后按照随机数字表法分成假手术(Sham)组和2K1C组,每组10只。大鼠以仰卧位四肢固定于手术台,剪去腹部毛发,碘伏消毒后沿正中腹白线切开腹部肌肉层约2 cm,棉签轻轻分离双侧皮下浅筋膜及肌肉,暴露左肾,钝性分离左肾动脉[5-6]。2K1C模型组在左肾动脉中段套内径0.2 mm的银夹,Sham组分离左侧肾动脉但不钳夹。动态观察大鼠生命体征36 h,术后3 d给予青霉素V钾片0.5万U/d[7]。术前及术后1~4周用尾套法测定尾动脉收缩压,称量大鼠体质量。术后4周末大鼠尾动脉收缩压较术前基线值上升30 mmHg(1 mmHg=0.133 kPa)视为模型建立成功。
1.3 样本前处理及GC-TOF/MS检测 在术后4周末处死大鼠,收集其血清样本,放于液氮中速冻2 h后放置-80℃冰箱直到后续分析,每组选择3只进行代谢组学分析。取血清样本50μL于1.5 mL EP管中,加入200μL预冷甲醇和5μL核糖醇,涡旋30 s后冰浴超声10 min;将样本4℃、10 000 r/min离心15 min,移取180μL上清液于1.5 mL EP管中,每个样本取30μL混合成质控(QC)样本。样本在真空浓缩器中干燥提取物,加入30μL甲氧胺盐试剂,混匀后放入烘箱中80℃烘干30 min;向每个样品中加入40μL BSTFA(含1%TMCS,V/V),将混合物70℃孵育1.5 h;冷却至室温,向混合的样本中加入5μL FAMEs(溶于氯仿)。检测系统采用DB-5MS毛细管柱,以无分流模式注入1μL样品。使用氦气作为流动相,前部入口吹扫流量为3 mL/min,通过色谱柱的气体流速为1 mL/min。初始温度50℃1 min,然后以20℃/min的速率升至310℃,然后在310℃下保持6 min。注入、传输线和离子源温度分别为280、280和250℃,电子碰撞模式下,能量为-70 eV。在溶剂延迟4.8 min后,以每秒扫描12.5张质谱图的速率在m/z范围50~500的全扫描模式下获得质谱数据。
1.4 数据处理 利用Chroma-TOF(v4.3x,LECO)软件对原始数据进行分析,包括峰提取、基线校正、反褶积、校正和积分,并利用LECO-Fiehn-Rtx5数据库对质谱和保留指数进行匹配,进行代谢物鉴定。
1.5 正交偏最小二乘法-判别分析(OPLS-DA)组间模式识别采用OPLS-DA。使用SIMCA软件(V16.0.2)对每个样本鉴定到的代谢物的相对含量值数据进行对数(Log)转换加UV格式化(Unit Variance Scaling)处理,根据结果构建相应的OPLS-DA得分图。
1.6 差异代谢物的筛选 根据OPLS-DA模型的第一主成分变量重要性(VIP)值,结合2组代谢物相对定量比较的P值,以VIP值>1且P<0.05为条件进行筛选。
1.7 差异表达代谢物的层次聚类分析 通过分析得到的差异表达代谢物,在生物学上往往具有结果和功能相似性或互补性,或者受同一代谢通路的正调控或负调控,表现为在不同实验组间具有相似或相反的表达特征。对此类特征进行层次聚类分析,有助于将具有相同特征的代谢物归为一类,并发现代谢物在实验组间的变化特征。计算差异表达代谢物定量值的欧式距离矩阵(Euclidean distance matrix),以完全连锁方法对差异表达代谢物进行聚类,并以热图进行展示。
1.8 差异表达代谢物的代谢通路分析 使用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库搜索差异表达代谢物的相关代谢通路。
1.9 统计学方法 实验数据使用SPSS 20.0统计软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2组间比较采用独立样本t检验,同组术后4周和建模前比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2K1C高血压大鼠模型建立 术后4周,2K1C组大鼠左侧肾脏体积明显缩小、形态萎缩,见图1。术后4周2K1C组大鼠尾动脉收缩压较建模前明显升高(t=9.990,P<0.05),且上升>30 mmHg,7只2K1C高血压大鼠模型建立成功。建模前及术后4周2组大鼠体质量差异均无统计学意义,见表1。
2.2 OPLS-DA结果 2K1C组与Sham组OPLS-DA模型得分散点图分析结果显示,2组样本区分明显,见图2。

Fig.1 Comparison of kidney between 2K1C group and sham group图1 2K1C组大鼠肾脏对比图
Tab.1 Results of systolic blood pressure and body weight of rats in the two groups表1 2组大鼠建模前及术后4周尾动脉收缩压、体质量变化(±s)
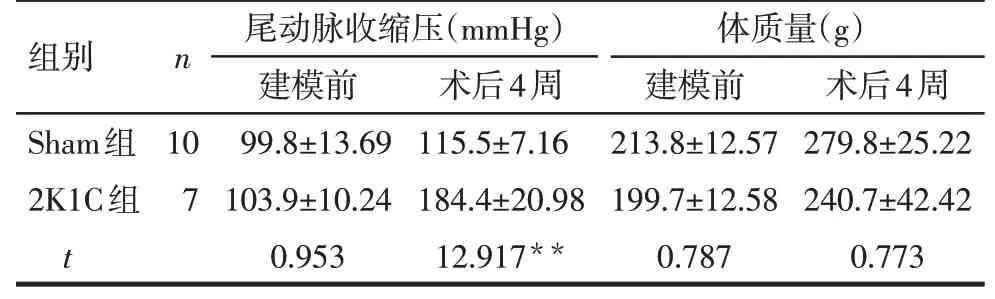
Tab.1 Results of systolic blood pressure and body weight of rats in the two groups表1 2组大鼠建模前及术后4周尾动脉收缩压、体质量变化(±s)
**P<0.01;术后2周2K1C组3只大鼠出现消瘦、瘫痪、最终死亡,予以剔除
?
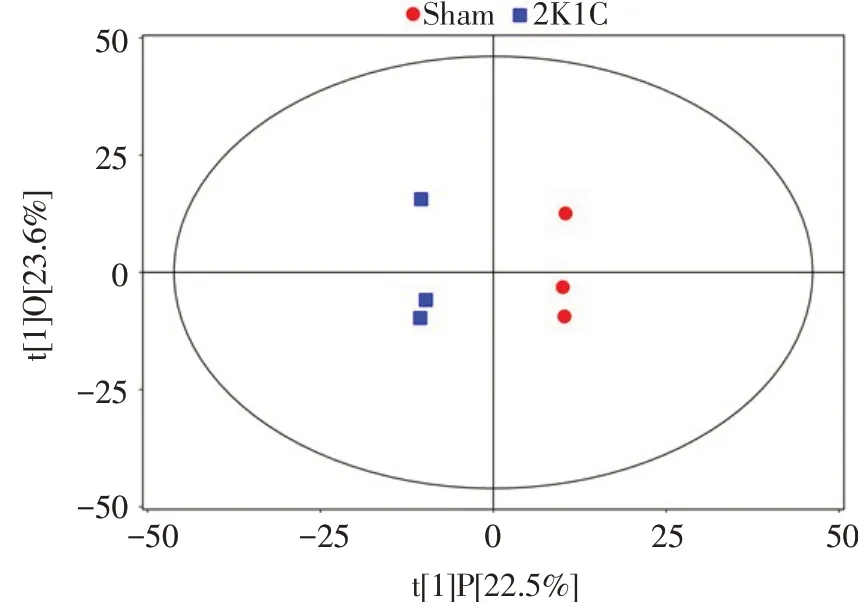
Fig.2 Scatter plot of OPLS-DA model scores in the sham group and 2K1C group图2 2K1C组对Sham组的OPLS-DA模型得分散点图
2.3 差异表达代谢物的筛选 质谱数据定性后,共得到31种差异表达代谢物。与Sham组相比,2K1C组中有21种上调,10种下调。依据代谢物与质谱检测峰的匹配度(similarity)打分及其count值,将部分代谢物进行删减和合并,最终2K1C模型组有14种差异表达代谢物,其中3种下调,11种上调,见图3,表2。
2.4 差异表达代谢物的聚类分析 酪氨酸、胆酸、豆甾醇3种代谢物经过聚类分析归为一类,在2K1C组低表达;胞苷-磷酸、乳酰胺、花生四烯酸、富马酸、双缩脲、马尿酸、木糖、七烷酸、2-羟基-3-异丙基丁二酸、吲哚乳酸酯、顺-巨头鲸鱼酸11种代谢物经过聚类分析归为一类,在2K1C组高表达。见图4。
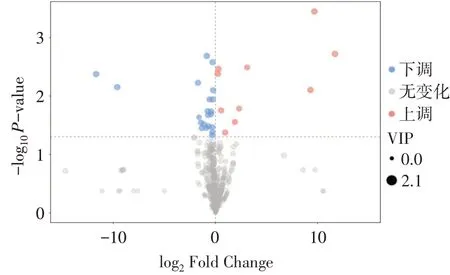
Fig.3 Differential expression metabolites screening volcano plot图3 差异表达代谢物筛选火山图
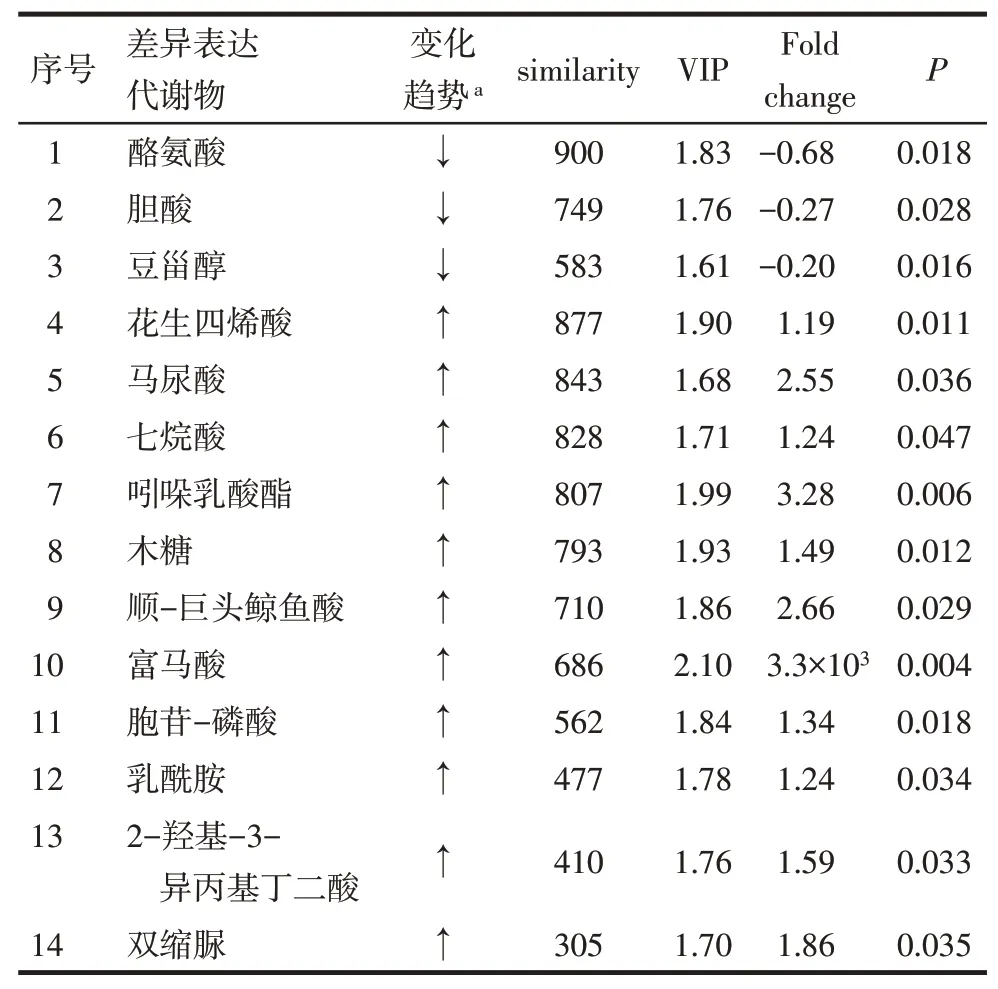
Tab.2 Fourteen differentially expressed metabolites in 2K1C model group表2 2K1C组14种差异表达代谢物

Fig.4 Heatmap of hierarchical clustering analysis for differentially expressed metabolites in 2K1C group and sham group图4 2K1C组与Sham组差异表达代谢物的层次聚类分析热力图
2.5 差异表达代谢物的KEGG通路分析 在取得差异表达代谢物的匹配信息后,利用KEGG通路数据库进行搜索和代谢通路分析。发现差异表达代谢物共涉及柠檬酸盐(TCA)循环,丙氨酸、天门冬氨酸和谷氨酸代谢,花生四烯酸代谢,嘧啶代谢,酪氨酸代谢,不饱和脂肪酸的生物合成,精氨酸和脯氨酸代谢,初级胆汁酸生物合成等通路,具体结果以气泡图展示,见图5。
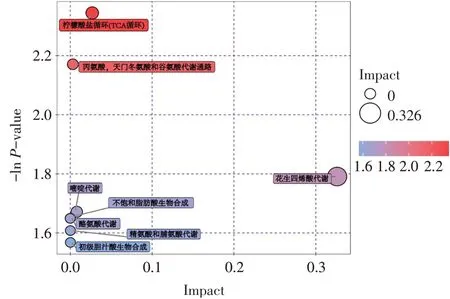
Fig.5 Bubble diagram of KEGG pathway analysis of differentially expressed metabolites图5 差异表达代谢物的KEGG通路分析气泡图
3 讨论
本研究通过建立2K1C肾性高血压大鼠模型,采用GC-TOF/MS代谢组学方法,系统研究2K1C肾性高血压大鼠潜在生物标志物的变化趋势及代谢通路,同时通过增设Sham组排除损伤对大鼠的影响,进而通过对2K1C肾性高血压大鼠血清进行检测。与Sham组比较,2K1C组血清中有14种差异表达代谢物水平出现明显变化,其中11种呈上升趋势,3种呈下降趋势。上述差异表达代谢物参与了体内能量代谢、氨基酸代谢、脂质代谢、初级胆汁酸生物合成等生物途径。
富马酸是一种有机酸,是TCA循环的关键中间产物[8],而TCA循环是调节能量稳态和细胞代谢的核心[9]。富马酸二乙酯可透过细胞膜进入细胞后转化为富马酸。Tian等[10]发现以1 mmol/(kg·d)静脉注射富马酸二乙酯可明显加重高盐诱导的大鼠高血压。此外,van Deventer等[11]运用液相色谱-质谱(LC-MS)和气相色谱-质谱(GC-MS)技术测定非洲男性高血压患者与健康人的尿液代谢图谱,发现高血压患者富马酸水平明显升高。另有研究通过GCTOF/MS法分析年轻高血压患者和健康对照者的血浆样本后发现,高血压患者血浆富马酸含量增加[12]。本实验中2K1C组富马酸含量明显上调,与上述研究结果相一致。胞苷-磷酸水平与氨基酰-tRNA生物合成和嘧啶代谢有关[13]。在本研究中,2K1C肾性高血压大鼠血清中胞苷-磷酸水平显著增加,提示胞苷-磷酸参与的能量代谢发生紊乱。马尿酸由肠道微生物将饮食中的芳香族化合物转化而来,马尿酸的排泄量与肾小球滤过和肾小管重吸收减少有关[14]。本研究观察到2K1C肾性高血压大鼠血清马尿酸含量升高,这可能是由于2K1C肾性高血压大鼠肾脏损伤导致马尿酸代谢减弱。本实验还发现,2K1C肾性高血压大鼠血清木糖含量升高,与Hao等[15]发现木糖水平越高,高血压风险越高的结果一致。
氨基酸代谢与机体血压的变化密切相关。酪氨酸作为去甲肾上腺素的前体可促使大脑中儿茶酚胺类神经递质的分泌,从而降低心血管交感神经张力[16]。也有研究显示,较高的酪氨酸摄入量(0.3%的蛋白质)有助于降低血压[17]。Lu等[18]采用GC-TOF/MS检测自发性高血压大鼠(SHR)的血浆代谢谱变化,分析发现SHR酪氨酸代谢物含量降低。本研究中,与Sham组相比,2K1C肾性高血压大鼠血清中酪氨酸含量明显下降,提示大鼠体内氨基酸代谢异常,进而升高心血管交感神经张力,促使血压上升。
脂质代谢变化是高血压的潜在发病机制,在血脂异常与高血压患者中,都可发现血管功能异常[19]。本研究发现,相比Sham组,2K1C组血清花生四烯酸含量明显升高。花生四烯酸可通过环氧合酶途径产生血栓素A2(TXA2),能够促进血小板聚集和血管收缩[20]。在高血压发生的病理过程中,由于血管内皮受损,内皮下层胶原纤维暴露,与血小板结合,激活并释放TXA2[21]。
胆酸是初级胆汁酸生物合成的代谢物,抑制血管系统中11β-羟基类固醇脱氢酶基因(11β-HSD2)和醛固酮合成酶基因(CYP11B2)的转录,导致血管中醛固酮含量降低,皮质酮生成增加,血管收缩反应增强。本研究中,2K1C组血清中胆酸含量下降,提示可能在肠道中胆酸吸收增加。
综上所述,与Sham组比较,2K1C肾性高血压大鼠血清中有多种代谢物水平出现明显变化,这些差异表达代谢物参与了体内能量代谢、氨基酸代谢、脂质代谢、初级胆汁酸生物合成等生物途径,进而造成代谢紊乱。
