索拉菲尼对肾癌细胞的抑制作用与STC-1调控细胞内钙稳态的关系研究
2021-07-09沈亚楠张永春罗浩鸣
沈亚楠 谷 江 张永春 罗浩鸣
靶向药物在靶向抑制肾癌细胞时,肾癌细胞会产生一定的抵抗作用,导致药物的抑制效果逐渐减弱,但具体的抵抗机制尚未明确[1]。研究发现肾癌细胞中有STC-1蛋白的存在[2]。STC-1即斯钙素蛋白1,是最早在鱼类体内发现的一种糖蛋白激素,主要调节体内钙磷代谢[3]。STC-1以浓度依赖的方式刺激线粒体钙转运[4]。有研究指出,STC-1调节钙稳态的过程可能参与肾癌细胞对靶向药物的抵抗[5]。
所谓钙稳态是指细胞内液和细胞外液的离子钙水平稳定[6]。钙稳态是影响肿瘤细胞增殖和存活的重要因素[7]。索拉菲尼能够抑制肿瘤血管生成,引起肿瘤细胞缺氧,容易导致细胞内Ca2+超载,造成细胞损伤,而STC-1可能是一种抗凋亡和致癌因子,所以创新性地将STC-1调控钙稳态引入到肾癌细胞抵抗靶向药物的研究中,观察这种抵抗作用是否与STC-1调节钙稳态相关,或能为逆转肾癌细胞的耐药性提供新的思路[4,8]。
材料与方法
1.主要材料与仪器:1640培养基、青链霉素混合液、PBS(磷酸缓冲盐溶液)购自美国Hyclone公司;胎牛血清、0.25%胰蛋白酶+0.02%EDTA购自美国Gibco公司;MTT试剂盒购自凯基生物体;DMSO(二甲基亚砜)购自美国AMRESCO公司;索拉菲尼购自德国拜耳公司;总RNA提取试剂盒购自美国Fermentas 公司;ELLSA试剂盒购自美国R&D公司;9孔板、15ml及50ml离心管购自康宁公司;酶标仪(elx808)购自美国Thermo公司;低速离心机(SC-3612型)购自中佳公司;Fura-2 AM钙离子探针购自碧云天生物技术研究所;人肾癌GRC-1细胞购自上海弗雷堡生物公司。
2.培养液的配制:在50ml的离心管中加入500μl的青霉素、链霉素混合物、5ml的胎牛血清以及1640培养基,制备含有1%青霉素链霉素和10%胎牛血清的1640培养液。
3.细胞培养:在1640培养基中培养人肾癌GRC-1细胞,置于37℃和5%CO2饱和湿度的培养箱中,细胞附壁后,每2天传代1次,培养至对数生长期进行实验。
4.MTT法检测索拉菲尼对肾癌细胞增殖的影响:取对数生长期的肾癌细胞,以5×103个/孔的密度接种于96孔板中,培养24h并加入药物。实验分为:索拉非尼(1.25、2.5、5、10、20、40μmol/L)用药组和不加药的对照组。为每个剂量设置5个重复孔,添加药物后培养24h,然后向每个孔中添加20μl MTT(5mg/ml),继续培养4h,然后终止培养,弃上清液,向每孔加入DMSO 150μl,低速振荡10min以完全溶解晶体。最后,使用酶标仪在490nm处测量每个孔吸光度(A)值,并计算每组药物对细胞增殖的抑制率,抑制率(%)=(1- 实验组A值/对照组A值)×100%。
5.反转录PCR测定STC-1基因表达:采用RT-PCR法测定各组细胞的STC-1基因表达水平,用试剂盒提取各组细胞的总RNA,取1μg RNA进行反转录并合成cDNA。引物序列β-actin,正向5′-CCCTGGACTTCGAGCAAGAGAT-3′,反向5′-GTTTTCTGCGCAAGTTAGG-3′,片段长度531bp;STC-1,正向5′-TGAGGTCGTCCAGCTCCCAATC-3′,反向5′-GGCACAGTGGTCTGTCTGCAGGATG-3′,片段长度142bp。RT-PCR 反应条件:预变性94℃ 3min,变性94℃ 30s,退火53℃ 30s,延伸72℃ 1min,35个循环后,终止反应72℃ 5min;以β-actin作为内部参照,PCR产物在2%琼脂糖凝胶上电泳,并用凝胶成像仪照相。
6.采用ELLSA法测定各组细胞STC-1蛋白表达:使用PMSF和细胞裂解液裂解每组细胞,以12000 r/min转速离心5min,取上清液,并以50微升/孔滴加到酶标板中,设置空白孔、标准孔和样品孔分别进行测试。按试剂盒说明书(美国R&D公司)操作,并使用酶标仪进行检测,根据获得的标准曲线计算STC-1蛋白表达水平。
7.荧光分光光度法测各组细胞内Ca2+含量:不同浓度索拉非尼干扰肾癌细胞24h并消化成细胞悬液,以1000r/min离心5min,弃上清液,将细胞重悬于含0.2%小牛血清白蛋白的D-Hanks溶液中,调整细胞数约为8×105/ml。加入Fura-2/AM,37℃避光孵育45min。用D-Hanks溶液洗涤细胞2次,再将细胞重悬于3ml D-Hanks溶液中,双波长荧光分光光度计测量细胞荧光强度。
8.化学比色法测定Ca2+-ATP酶活性:ATPase可以分解ATP产生ADP和无机磷,通过测试无机磷的含量来确定ATPase的活性水平,以1mg/h的ATP酶分解ATP产生1μmol的Pi量为1个ATP酶活力单位,即1μmol/(mg·h)。严格按照试剂盒说明书进行检测。
结 果
1.索拉菲尼对肾癌细胞增殖的影响:MTT法的结果表明,随着药物浓度的增加,抑制率逐渐增加,但以药物浓度10μmol/L为转折点,抑制率趋于稳定,但均高于中低浓度组,中低浓度组之间比较,差异有统计学意义(P<0.05,表1)。肾癌细胞抑制率呈逐渐上升趋势,但以10μmol/L为浓度转折点,细胞抑制率逐渐趋向平稳。
表1 不同浓度索拉菲尼对肾癌细胞增殖的抑制作用
2.RT-PCR检测肾癌细胞内STC-1mRNA表达水平:各组细胞中STC-1mRNA的表达逐渐增加,从10μmol/L药物浓度开始增加更为明显,差异有统计学意义(P<0.05,图1,表2)。

表2 各组细胞内STC-1mRNA与STC-1蛋白表达水平
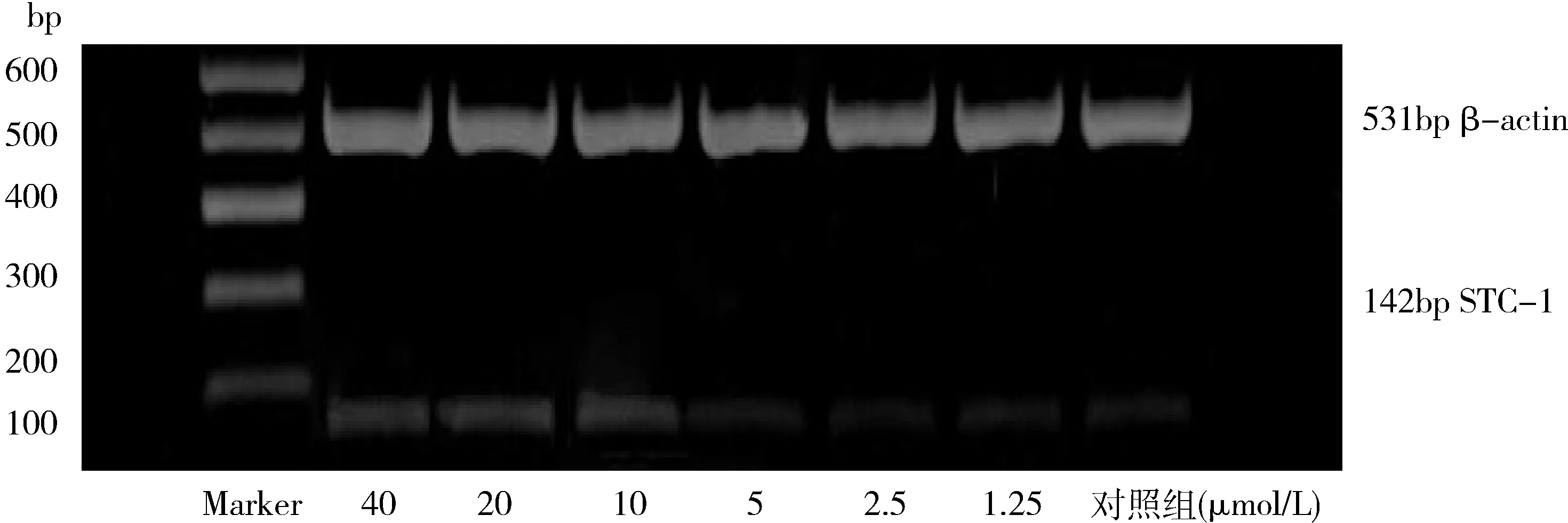
图1 索拉菲尼干预肾癌细胞后STC-1的基因表达
3.ELISA法检测STC-1蛋白表达量:各组细胞内STC-1表达量逐渐增高,并在10μmol/L药物浓度时增量较明显,差异有统计学意义(P<0.05,表2)。
4.荧光分光光度法测各组细胞内Ca2+含量:各组细胞内Ca2+逐渐增加,从10μmol/L的药物浓度开始趋于稳定,中低浓度组两两比较后差异均有统计学意义(P<0.05,表3)。
5.化学比色法测定各组细胞内Ca2+-ATPase 活性:各组细胞内钙酶活性逐渐下降,从10μmol/L药物浓度开始趋于稳定,中低浓度组两两比较后差异均有统计学意义(P<0.05,表3)。

表3 各组细胞内Ca2+含量与Ca2+-ATPase 活性
结 果
目前,靶向治疗可显著延长晚期肾癌患者的无进展生存期和总体生存期,并显著改善患者的预后[9]。索拉菲尼因其自身在抗肿瘤活性及药物耐受性上表现优异,是晚期肾癌靶向治疗的一线用药,但相关研究发现,索拉菲尼的长期使用会伴随耐药性的出现,严重影响治疗效果[10,11]。结合索拉菲尼在抑制肾癌细胞时出现STC-1异常变化及钙稳态改变的相关报道,本实验以STC-1作为切入点,研究索拉菲尼抑制肾癌细胞时STC-1与细胞钙稳态变化之间的关系,并探讨对肾癌细胞增殖的影响。
索拉菲尼抑制肾癌细胞时,会引起细胞内钙离子的变化,钙离子受到STC-1的调控[12]。STC-1在促进肾癌的发生和发展中起着重要作用,但尚未明确[13]。STC-1调节钙稳态机制是否参与了索拉菲尼对肾癌细胞的抵抗作用亦不清楚,因此通过本次实验进行了研究,笔者研究发现随着索拉菲尼浓度的依次递增,细胞内Ca2+含量、钙酶活性及STC-1围绕浓度转折点发生规律性变化。这表明,STC-1可能通过调控Ca2+水平,避免钙超载引起的细胞凋亡。
作为储存Ca2+的主要场所,线粒体支持的生物学功能通常由Ca2 +控制,Ca2+水平紊乱可能会加剧线粒体功能障碍和能量衰竭,从而促进细胞死亡[14]。作为细胞中重要的第二信使,Ca2+参与调节细胞增殖、凋亡、基因转录、细胞分泌,并能调节血管内皮细胞功能[15,16]。Ca2+通过启动内皮细胞中信号,对控制血管张力和内皮通透性有重要作用[17]。血管内皮细胞通过质膜Ca2+-ATPase和Na+/Ca2+交换将细胞质中过量的Ca2+移至细胞外,从而维持细胞的钙稳态[18]。Ca2+-ATPase(PMCA)活性的降低导致钙离子在细胞质中积累,而肾细胞中PMCA是主要的钙输出蛋白,因此可以测定肾癌细胞PMCA活性反映钙稳态情况[19]。
钙离子水平增高可能会引起STC-1的变化。STC-1被证明在肾脏中高表达,并关键性地调节细胞生长、增殖和分化,以及调节钙稳态[20]。STC-1可以下调钙离子水平,维持钙离子稳定,促进细胞生长[21]。因此,随着索拉非尼浓度的递增,可能会引起STC-1升高以拮抗过多的Ca2+水平,使钙离子代谢趋向稳定,因为钙离子代谢可以影响细胞能量代谢,而能量代谢也可能是STC-1直接影响所致,这种影响会反映到对细胞的抑制作用逐渐趋向平稳甚至减弱,这也可能是肾癌细胞对索拉菲尼产生抵抗的原因之一。
本实验研究提示肾癌细胞对靶向药物产生的抵抗作用可能与STC-1调控钙离子稳态有关,也可能直接与STC-1相关,故STC-1可能是肾癌治疗的有效靶点,抑制STC-1可能会逆转肾癌细胞对靶向药物的耐药性。然而本实验仅是针对基因进行检测,而没有进行干预,而且细胞实验脱离了全机体的综合调控,因此只是提供一个依据;而其中深层机制的确定,可能需要培养耐药细胞进行更细致的检测和验证,因此后续尚需开展深入的研究予以进一步证实。
