空间贴壁细胞培养模块研制及特性测试
2021-07-09郭飞马3李3王小雪3李
郭飞马 3李 明 3王小雪 3李 飞
(1.中国空间技术研究院航天神舟生物科技集团有限公司,北京 100080;2.中国航天科技集团有限公司空间生物工程研究中心,北京 100080;3.北京市空间生物工程技术研究中心,北京 100080)
1 引言
随着中国航天技术的不断发展以及载人航天、深空探测等一系列空间探索任务的成功实施,特别是空间站的落成进入倒计时,为空间生命科学的飞速发展提供了良机。空间细胞生物学研究是空间生命科学的重要分支,研究空间环境下细胞的生物学过程及变化规律,对于探索空间特殊环境对人体系统的影响具有重要意义,并可为利用空间环境进行生物医药创新提供理论基础与技术手段。
由于空间环境的特殊性,常规的地面细胞培养设备不能满足在空间飞行条件下开展细胞实验的需求,因此,需要研制特殊的、适合空间使用的细胞培养装置。
目前国际空间站中的细胞培养系统主要有BioServe、GAP-FPA、Kubik和Bioculture等细胞培养系统。BCA(BioServe Culture Apparatus)主要用于悬浮细胞培养,它实现了自动气体交换、定时取样、手动换液和固定功能。TGAP-FPA(The Group Activation Pack-Fluid Processing Apparatus)在国际空间站中用于抗生素生产和细胞培养,由外壳、玻璃管、橡胶塞组成,利用橡胶塞的推进实现空间液体混合。Kubik在空间站中主要用于免疫细胞、淋巴细胞的培养和干细胞分化,在空间实现温控和样品冷冻。Bioculture是自动化的、在轨可操控的细胞培养实验系统。该系统采用独立灌注和计算机控制液体流速体系的组合技术,完成多种细胞培养基输送及维持,并实现了温度控制和气体交换。
近年来,中国科研人员在细胞空间搭载方面取得了一些研究成果:王红晖等通过神舟六号搭载心肌细胞和原代成骨细胞,实现了小载荷、多细胞搭载;刘红菊等通过神舟十号搭载小鼠成肌细胞,证实空间飞行期间骨骼肌成肌细胞增殖分化的可塑性显著降低;陈钰等研制的空间微流控芯片生物培养和分析载荷由天舟一号货运飞船送入太空,用于研究空间微重力环境下神经细胞与免疫细胞的相互作用。
本文研制一种适合在空间进行细胞培养的实验模块,并开展地面实验进行性能测试。
2 模块研制
空间细胞培养模块的设计需要考虑以下几个方面:①在空间微重力条件下,气体和液体不会自然分离,培养容器中的气体将会以气泡的形式长期存在于培养液中,并对细胞的生长及活性产生严重影响。因此,在空间开展细胞培养实验,必需使用密闭的培养容器,并且在其中充满培养液,不能留存空气。在这种情况下,如何在细胞培养过程中,维持培养液中氧气和二氧化碳含量的稳定是一个关键问题。②在太空舱内各种资源都非常有限,因此,在模块设计上需采用小型化、集成化设计,尽可能降低模块的重量、体积、功耗及对其他资源的需求。③为便于在轨使用,空间细胞培养模块除了需满足空间飞行对安全性、可靠性等要求外,还需尽量采用简单可靠的培养方法和自动化、模块化设计,减少对航天员操作的需求,并保证实验结果的可靠性。
空间细胞培养模块要求培养面积大、培养液体积小、密封性好,并能湿热灭菌。本模块采用无源设计,最大外形尺寸为130 mm×90 mm×14 mm。整体由盖板、疏水透气膜、主体框架、O圈、紧固件、直通鲁尔接头等部分组成(图1)。用两侧紧固件和密封O圈对培养室进行密封,组装后即可进行贴壁细胞培养(图2)。其中疏水透气膜为透明薄膜,方便进行内外气体交换,并可进行细胞形态观察。
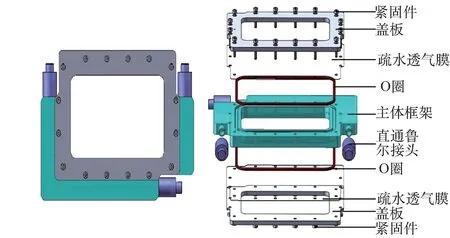
图1 空间细胞培养模块设计图Fig.1 Design chart of space cell culture device

图2 细胞培养模块实物图Fig.2 Physical picture of cell culture device
2.1 培养室设计
主体框架由聚碳酸酯(PC)制成,内部中空尺寸为80 mm×50 mm×8 mm,主体框架两侧具有凹槽可放置O圈,结合疏水透气膜形成内部细胞培养室,容积约为30 mL。培养室单侧培养表面积约为40 cm,可以进行双侧细胞培养,显著增加单位面积的细胞培养量。当细胞在疏水透气膜上贴壁培养时,可与外界进行气体交换。疏水透气膜具有较好的生物相容性,可以耐受湿热灭菌条件,并可重复使用。
2.2 密封设计
培养室采用O圈密封,结合盖板与紧固件加强密封效果与强度。O圈由医用硅胶制成,具有良好的生物相容性,能耐受120℃(20 min)的灭菌条件,且密封效果好。盖板由铝合金制成,内侧中空透气。为实现培养液注入与交换,培养室通过主体框架内部管路与直通鲁尔接头连接,鲁尔接头即插即用,具有很好的密封效果。
3 性能测试
3.1 材料
骨肉瘤细胞(Human Osteosarcoma Cells,MG63)购买于美国模式培养物集存中心ATCC;DMEM培养基(Gibco,cat.11995-065);10%胎牛血清(Hyclone);CCK8试剂盒(日本同仁CK04);Caspase-3分光光度法检测试剂盒(凯基KGA202-KGA204)。
3.2 细胞培养和细胞活性检测
MG63细胞调整细胞浓度为4×10个/mL,接种于6孔板中,2 mL/孔,即8×10个/孔。培养过夜待细胞贴壁后,换用10%胎牛血清(Fetal Bovine Serum,FBS)的培养基培养24 h,再加入高压灭菌后的不同材料与MG63细胞共培养,同时设立阴性对照组。作用72 h、144 h后除去培养液和材料,用Dulbecco’s磷酸盐缓冲液(Dulbecco’s Phosphate Buffered Saline,DPBS)清洗细胞,加入200μL含10%的CCK-8的无血清培养基,37℃温浴1 h左右,取200μL上清于96孔板中,使用酶标仪450 nm波长检测上清液OD值。
3.3 细胞裂解和总蛋白浓度测定
细胞培养方法同上,作用6 h、24 h、48 h、72 h、144 h后除去培养液和材料,用DPBS洗涤细胞2次,胰酶消化后,2000 rpm离心5 min,收集细胞,尽量去除DPBS上清,在收集的沉淀细胞中加入200μL预冷的Lysis Buffer,冰上裂解60 min,期间每20 min涡旋振荡1次,每次10 s,裂解结束后在4℃下10 000 rpm离心1 min,吸取上清液转移到新管中,并于冰上放置。
BCA试剂A与BCA试剂B按50∶1的比例配制成工作液,用移液管反复吹打,充分混匀。将标准品0,1,2,4,8,12,16,20μL加入96孔板的标准孔中,所有标准孔用标准品稀释液补足到20μL。样品孔加入2μL样品后,用标准品稀释液补足至20μL。每孔加入200μL BCA工作液,37℃孵育30 min。利用562 nm的波长检测OD值,根据标准曲线计算出样品的蛋白浓度。
3.4 Caspase-3活性检测
吸取50μL含100μg蛋白的细胞或组织裂解上清,体积不足50μL用10 mmol/L PBS补足至总体积50μL(各组均采用同样的蛋白定量进行测定和比较),加入50μL的2×Reaction Buffer,再加入5μL Caspase-3底物,并于37℃避光孵育4 h,用酶标仪在波长405 nm测定其吸光值。
3.5 装置细胞培养和总蛋白测定
MG63细胞调整细胞浓度为1×10个/mL,将1 mL细胞液与15 mL新鲜培养基混匀,从培养室边框的管路中接种于细胞培养装置一侧的透气膜上,静置4 h。再将另外1 mL细胞液与15 mL新鲜培养基混匀,从培养室边框的管路中接种于细胞培养模块另一侧的透气膜上,并使培养液充满整个培养装置。设立细胞培养瓶组作为阴性对照。静置培养3天后,从培养室边框的管路中吸取培养基,并用DPBS洗涤细胞2次,胰酶消化后,2000 rpm离心5 min,收集细胞,尽量去除DPBS上清,在收集的沉淀细胞中加入200μL预冷的Lysis Buffer,冰上静置60 min,在静置过程中涡旋振荡3次,每次10 s,静置结束后4℃10 000 rpm离心1 min,吸取上清液转移至新的管中,放置在冰上待用。
蛋白裂解方法同上,根据标准曲线计算出样品的蛋白浓度。利用3.2和3.4的方法测定模块内的细胞活性和Caspase-3活性。
3.6 统计分析
利用SPSS22.0软件对数据进行统计,进行t
检验和方差分析,P
<0.05认为差异具有统计学意义。4 结果
4.1 材料对细胞活性的影响
在组装模块前所有与细胞接触的材料都应进行生物相容性检测。测试的材料包括主体框架材料、公鲁尔接头、母鲁尔接头和O圈。其中O圈选择常用的硅胶、氟胶、丁晴3种材料。这些材料通过高压灭菌与MG63细胞共培养72 h后,利用CCK8试剂盒检测细胞活性,结果如图3、图4所示。结果可见,硅胶O圈与细胞共培养72 h和144 h后,对细胞活力的影响与对照组相比无显著性差异(P
>0.05)。而丁腈和氟胶材料的O圈与细胞共培养72 h和144 h后,与对照组相比显著降低细胞活力,抑制细胞生长(P
<0.01,P
<0.05)。鲁尔接头和主体框架材料(PC)与细胞共培养72 h和144 h后,对细胞活力的影响与对照组相比无显著性差异(P
>0.05)。因此组装模块选用了硅胶材料的O圈。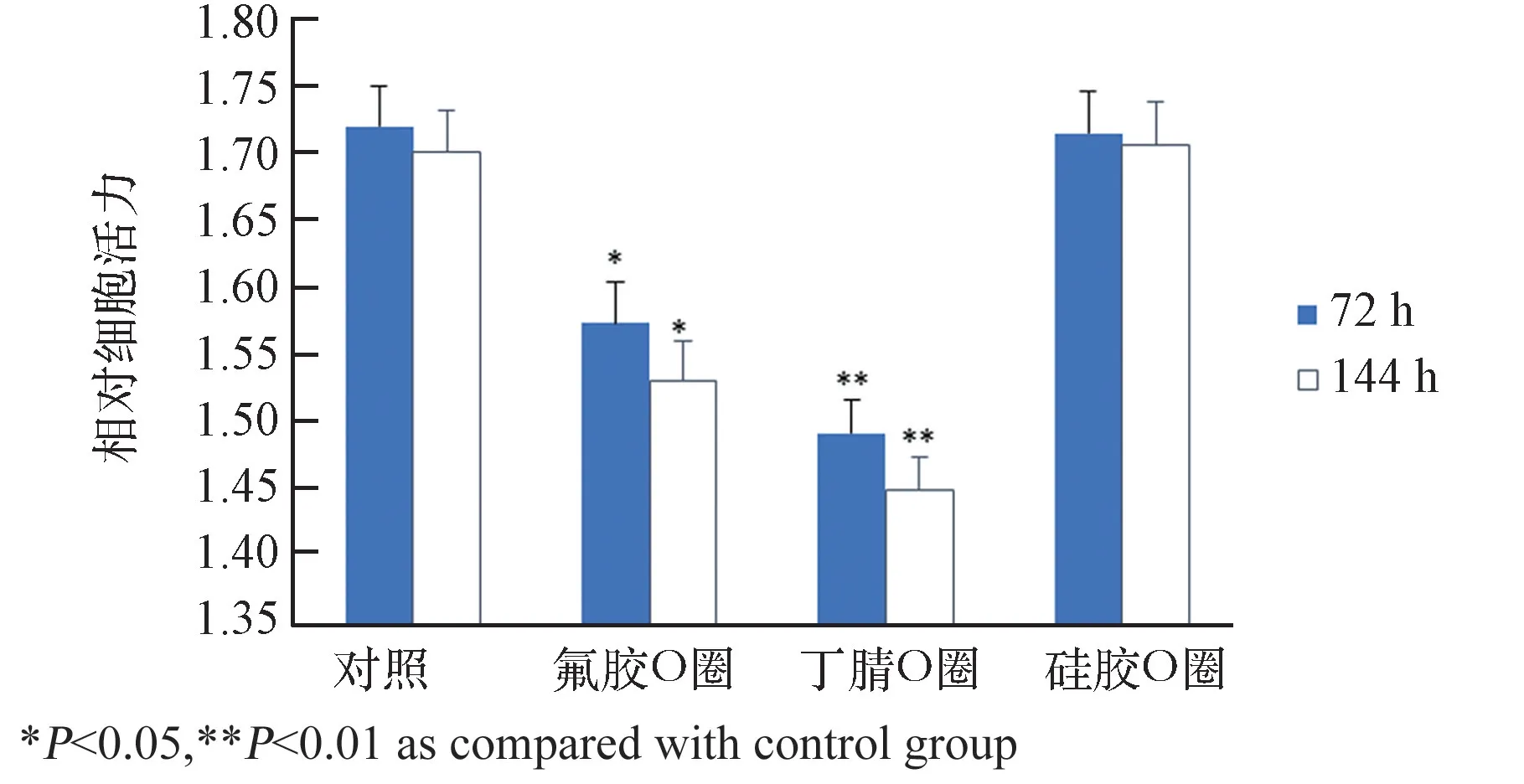
图3 O圈材料对细胞活力的影响Fig.3 Effects of O ring materials on cell viability
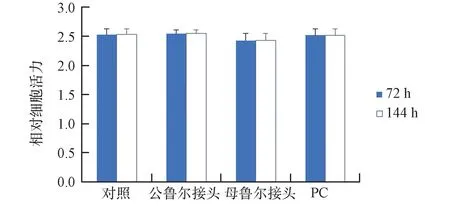
图4 鲁尔接头和主体框架材料对细胞活力的影响Fig.4 Influence of Luer junction and main frame materials on cell viability
4.2 材料对细胞凋亡的影响
在组装模块前所有与细胞接触的材料进行生物相容性检查除细胞活力检测外,还应检测细胞凋亡,以期进一步观察材料对细胞生长情况的影响。测试的材料包括主体框架材料、公鲁尔接头、母鲁尔接头和O圈。这些材料通过高压灭菌与MG63细胞共培养6 h、24 h、48 h、72 h、144 h后检测Caspase-3活性。Caspase家族与真核细胞的凋亡密切相关,其中Caspase-3是其中最重要的分子之一。它是细胞凋亡过程中最主要的终末剪切酶,在细胞正常生长过程中,它以酶原形式存在于胞浆中,无表达活性。在细胞发生程序性死亡的早期,caspase-3分子被激活,裂解相应的底物。因此Caspase-3的活性可以作为判断细胞凋亡的指标。
结果如图5、图6所示。结果可见,硅胶O圈6 h、24 h、48 h、72 h、144 h共培养对细胞凋亡的影响与对照组相比无显著性差异(P
>0.05)。鲁尔接头和主体框架材料(PC)在6 h、24 h、48 h、72 h、144 h共培养后对细胞凋亡的影响与对照组相比,无显著性差异(P
>0.05)。说明组装模块选用了所有材料与细胞生物相容性好,可以用于后续组装。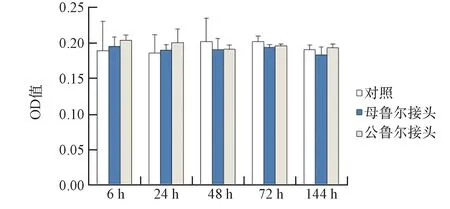
图5 鲁尔接头对细胞凋亡的影响Fig.5 Effect of Luer junction on apoptosis
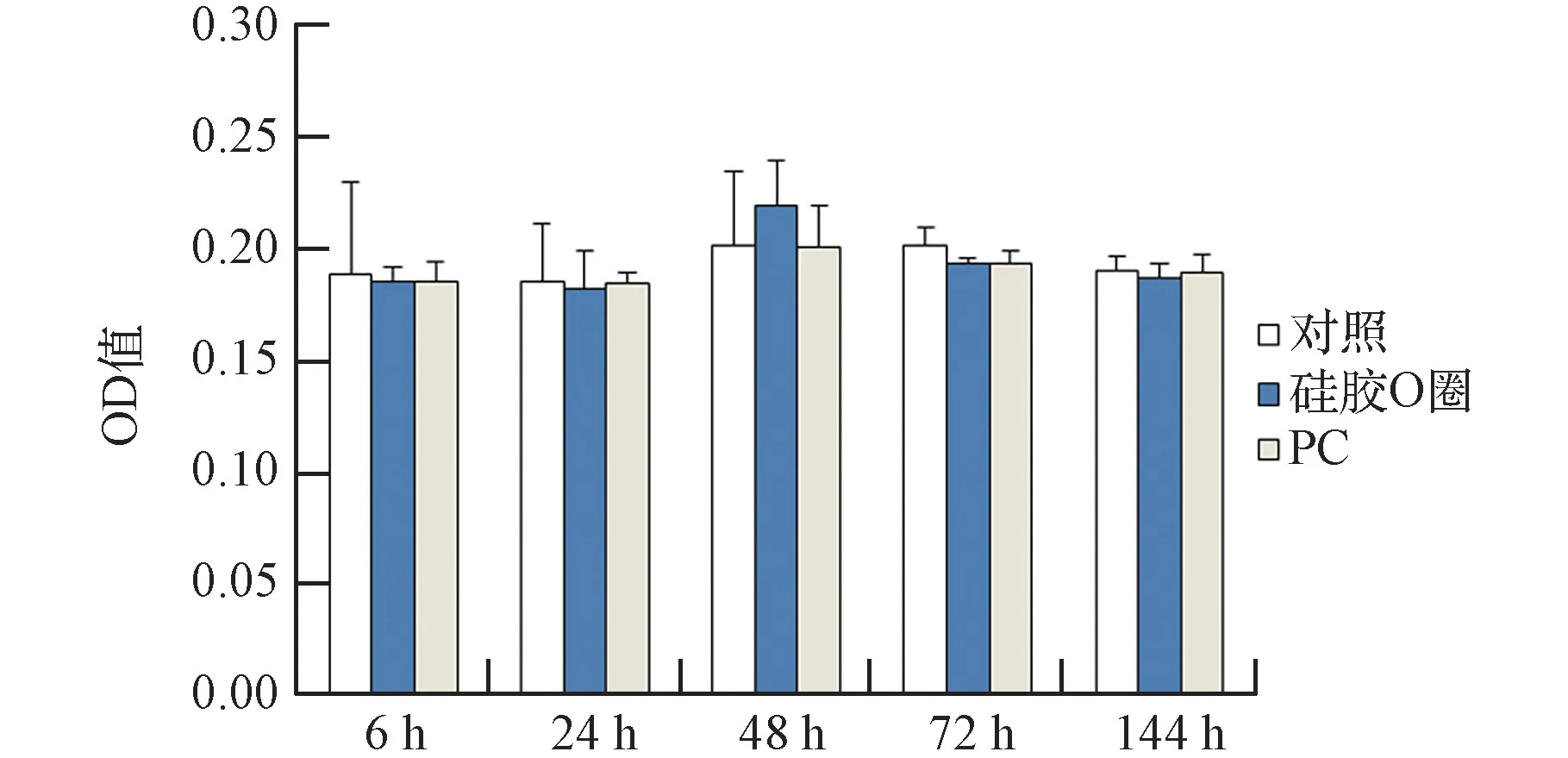
图6 硅胶O圈和主体框架材料对细胞凋亡的影响Fig.6 Effects of silicone O ring and host frame materials on apoptosis
4.3 培养模块细胞测试
在组装模块前,所有与细胞接触的材料进行生物相容性测试后,选择适合的材料进行整机的适应性测试。采用T25细胞培养瓶和自主设计的空间细胞培养模块培养MG63细胞72 h,观察细胞形态。结果显示细胞培养瓶和空间细胞培养模块培养细胞的生长状态一致,细胞铺展状态良好,如图7、图8所示。
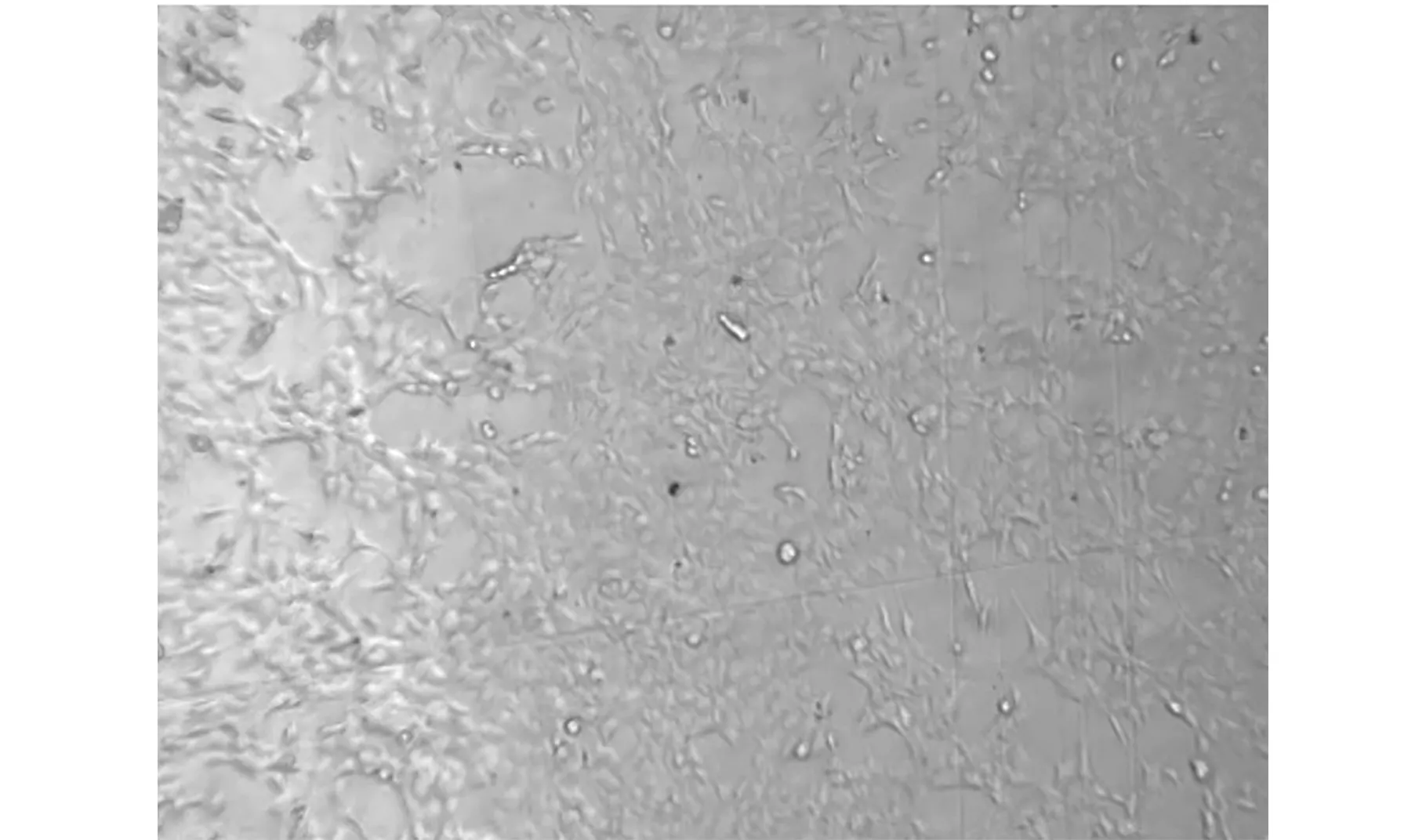
图7 细胞培养瓶中细胞形态Fig.7 Cell morphology in cell culture flask

图8 空间培养模块中的细胞形态Fig.8 Cell morphology in a space culture device
采用蛋白定量测定培养72 h后,1个空间培养模块的细胞总蛋白量为5.7 mg,实验结果显示空间细胞培养模块培养MG63细胞的总蛋白量相当于4个T25的细胞培养瓶收集的蛋白总量。这一结果有利于在空间环境中在同样体积的培养模块中获得更大量的细胞样品。
采用CCK8检测试剂盒检测MG63细胞在不同培养模块培养72 h后的细胞活性,实验结果显示如图9所示,表明自主设计的空间细胞培养模块培养的细胞活性与细胞培养瓶中培养细胞活性无显著性差异(P
>0.05)。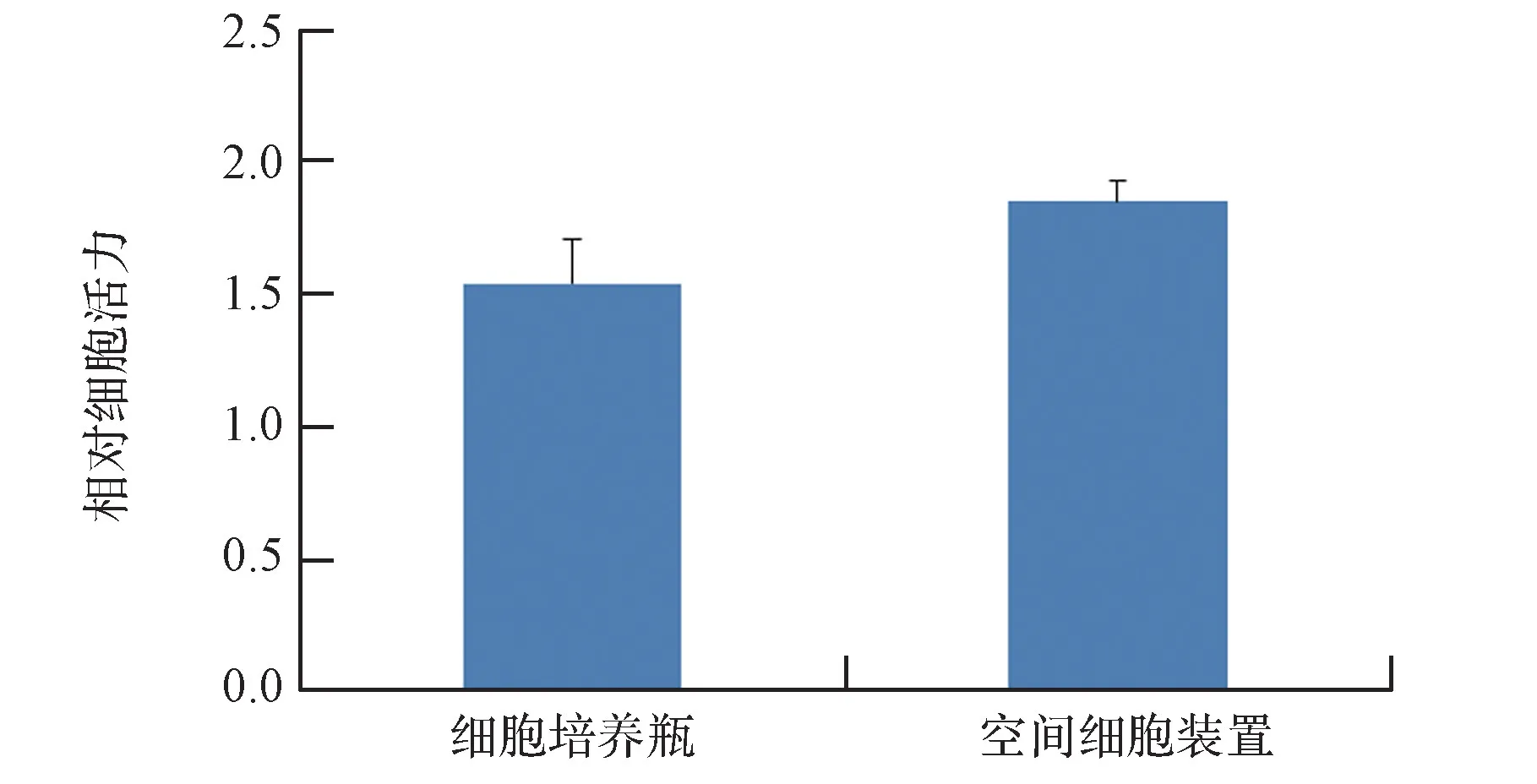
图9 不同培养装置对细胞活力的影响Fig.9 Effects of different culture devices on cell viability
检测MG63细胞在不同培养模块培养72 h后的Caspase-3活性,实验结果如图10所示,结果表明空间细胞培养模块培养的细胞凋亡与细胞培养瓶中培养细胞无显著性差异(P
>0.05)。细胞活力和凋亡的结果同时说明空间细胞培养模块在短期的细胞培养中可以替代细胞培养瓶进行空间环境的细胞培养。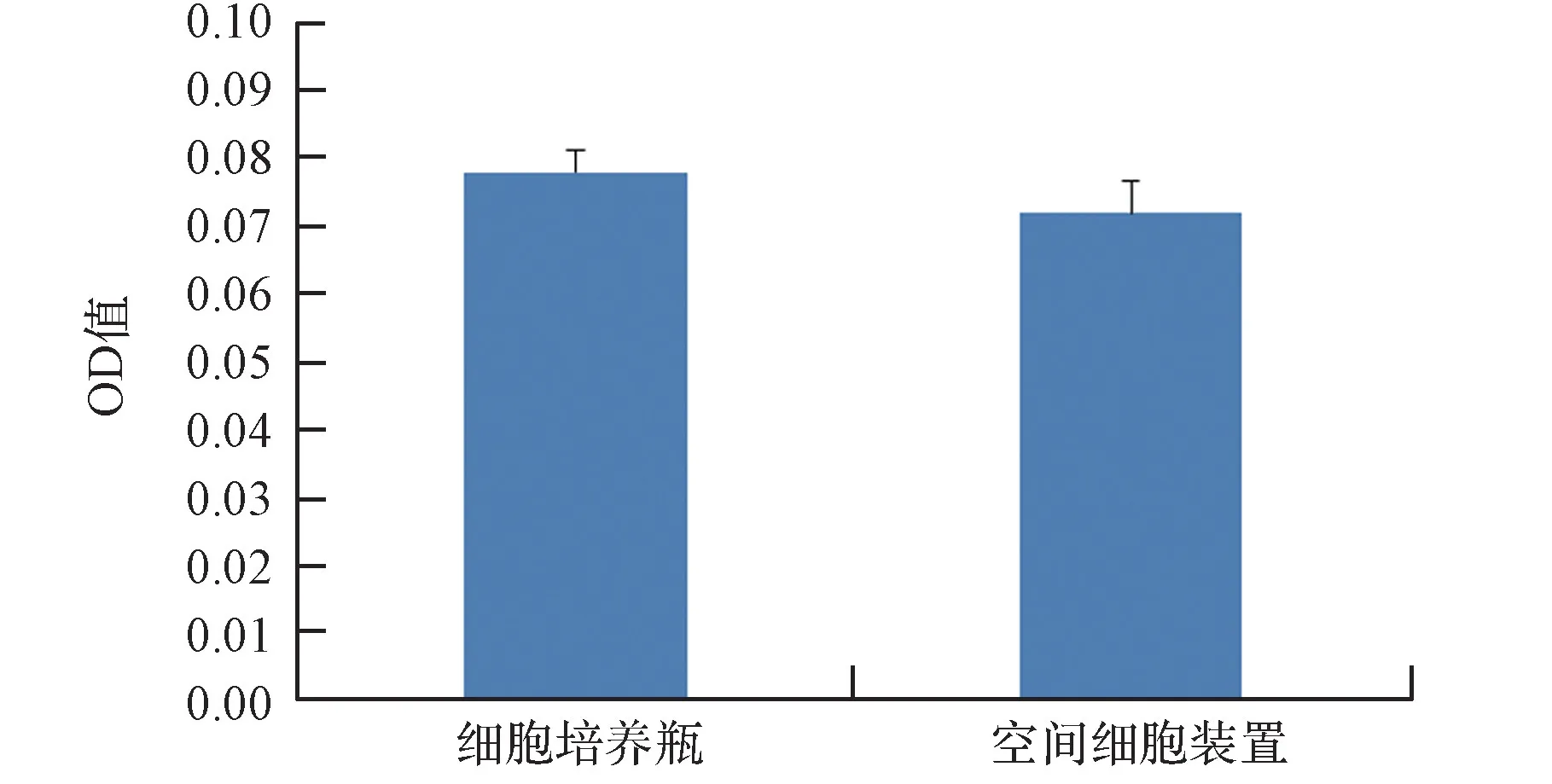
图10 不同培养装置对细胞凋亡的影响Fig.10 Effects of different culture devices on apoptosis
5 结论
本文设计了一种空间细胞培养模块,该模块操作简单,密封效果好,生物相容性佳。培养膜疏水透气便于细胞生长和观察。利用此模块培养MG63细胞72 h后,观察细胞生长状态和铺展性良好,细胞活性和凋亡与传统细胞培养瓶相比无显著性差异。该模块为空间体外培养细胞提供了便利的工具,可应用于空间飞行和空间站的细胞培养研究。
