帕托珠利混悬液对靶动物仔猪的安全性评价
2021-07-08王震许琴瑟张伟高嫣珺聂雅霍皓远肖文华卜仕金
王震,许琴瑟,张伟,高嫣珺,聂雅,霍皓远,肖文华,卜仕金*
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3.江苏农牧科技职业学院,江苏 泰州 225300)
帕托珠利又名托曲珠利砜,是托曲珠利的一种主要活性代谢产物[1],不仅具有抗球虫活性,而且对新孢子虫、弓形虫、鞭毛虫等原虫也均显示出良好的活性[2]。德国拜尔公司已率先将该活性成分开发用于治疗马原虫性脑脊髓炎(EPM),并于2001年获美国FDA批准上市[3-4]。鉴于托曲珠利在控制仔猪球虫病方面的成功应用,近期湖北龙翔药业科技股份有限公司研制出一种5%帕托珠利混悬液新制剂,拟用于预防仔猪球虫病。前期临床药效试验表明,5%帕托珠利口服混悬液按15~20 mg/kg单次口服给药,对仔猪球虫病有良好的防治效果,药效与20 mg/kg托曲珠利溶液相当[5]。本试验旨在进一步评价帕托珠利混悬液对靶动物—哺乳期仔猪用药的安全性,该研究不仅对指导临床合理用药具有重要参考价值,而且是申报新兽药时必需提供的一项研究资料。
1 材料与方法
1.1 供试药品
5%帕托珠利口服混悬液(批号20180501),由湖北龙翔药业科技股份有限公司提供。
1.2 仪器
贝克曼Unicel Dxc800 synchron型全自动生化分析仪、Sysmex XE-2100型全自动血液分析仪、CX2型OLYMPUS显微镜、JA2003型电子天平。
1.3 受试动物及饲养管理
32只3~5日龄健康苏姜仔猪,公母各半,由江苏畜牧现代科技园国家级姜曲海猪保种场提供。试验前采用耳号及猪舍号进行识别标记。受试仔猪选自4窝母猪。仔猪跟随母猪分别安置在不同的产床,场所符合分娩母猪要求。仔猪可以自由吮。房间自然通风。仔猪在保温箱中休息,通过电热板加热取暖,温度保持在25~32 ℃。房间温度保持在18~25 ℃,湿度保持在30%~70%。自然采光,每天采光时间不低于10 h。
1.4 分组及给药
采用分层区组随机化方法,将32只3~5日龄仔猪随机分为4组,每组8只,公母各半[6]。采取多剂量水平给药,给药剂量分别为0、1、3、5倍最大推荐剂量。具体分组及给药如表1。
1.5 给药途径及给药时间
口服给药,口服时将药物置于试验仔猪舌根处让其自然吞咽。共给药3次,每次间隔3 d。于最后1次(第9天)给药结束继续观察1周。
1.6 试验期间临床观察
给药前后观察并记录受试动物的临床体征,给药后6 h每小时观察一次,之后在8、12、24 h分别进行观察,了解是否有呕吐或其他异常情况。平时上、下午各1次,观察内容包括但不限于皮肤、被毛、眼睛及分泌物、外观、口腔分泌物、口腔黏膜、哺乳行为、粪便性状、呼吸情况和行为等是否有异常。

表1 试验分组及给药
1.7 增重和体温变化
于给药前第0、5、10、16天逐只进行体温测量和称重。
1.8 血常规和血液生化检测
所有受试仔猪分别在第3次给药结束后及观察期结束后24 h内,于前腔静脉采集血样。血样一分为二,其中一份装入有抗凝剂的试管进行血常规分析,另一份装入无抗凝剂试管,析出血清后进行血液生化检查。其中血常规检测包括红细胞总数(RBC)、白细胞总数(WBC)、血红蛋白(HGB)、血小板总数(PLT)、红细胞压积(HCT)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)等参数,血液生化检测包括总胆红素(TBIL)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLOB)、白/球比(A/G)、碱性磷酸酶(ALP)、肌酐(CREA)、尿素(UREA)、血糖(GLU)、钠、钾、钙、磷等参数。
1.9 病理检查
试验结束后,对所有存活的仔猪进行扑杀,进行大体组织病理学检查,如有疑似与药物相关的肉眼可见的异常损伤,则采集该异常组织供进一步组织病理学检查。对未见明显异常病变的组织则采集新鲜组织和主要脏器,对采集的组织样品用10%福尔马林固定保存,以供进一步组织病理学检查[7]。
1.10 数据处理
采用SPSS统计学软件进行显著性检验。各组数据以“平均值±标准差”表示。采用方差分析对各组间增重、血液生理生化等指标进行分析,P<0.05表示差异显著。
2 结果
2.1 临床表现
试验期间,空白对照组和各剂量试验组动物均无死亡。对照组中4406号仔猪精神略差,被毛粗糙,抢奶困难;3倍剂量组中4105号仔猪精神稍差,皮肤干燥,被毛粗糙,抢奶困难。除此外,其他受试动物精神状态均良好,给药后未出现呕吐现象,吮乳行为及排便等均正常。
2.2 增重与体温变化
各剂量组体重变化见表2,体温变化见表3。在完整的试验期间内,数据表明1倍剂量组、3倍剂量组相5倍剂量组增重稍大于空白组,但各剂量组之间无显著差异(P>0.05)。试验结束后测得各试验组体温低于初始体温,但保持总体稳定。表明5%帕托珠利混悬液对仔猪生长无抑制作用,对仔猪生长不会产生不利影响。
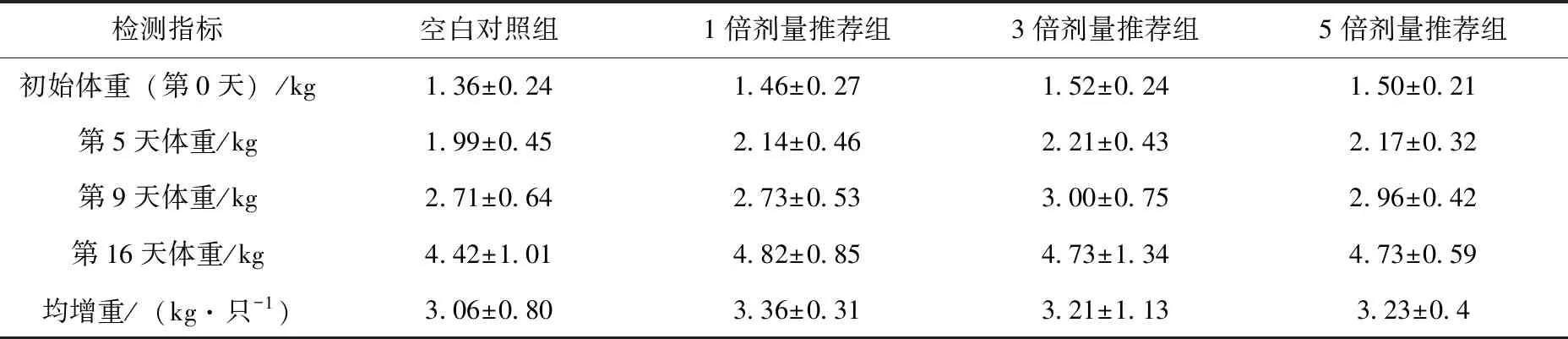
表2 帕托珠利混悬液对仔猪生长性能的影响(n=8)
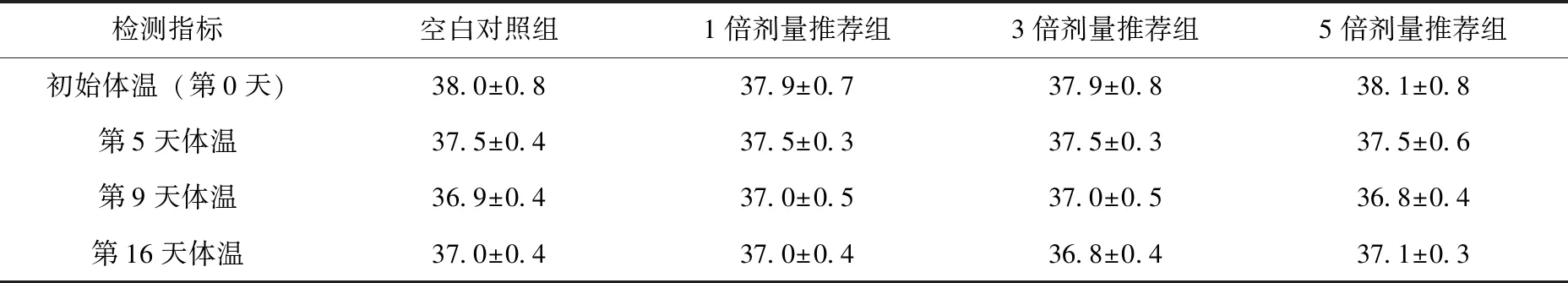
表3 帕托珠利混悬液对仔猪体温的影响(n=8) ℃
2.3 血常规及血液生化参数检测结果
在最后一次给药结束后及观察期结束后各组仔猪的血常规及血清生化测定结果分别见表4~7。

表4 第3次给药结束后各组仔猪血常规参数测定结果(n=8)
统计分析显示:在最后一次给药结束后,血常规与对照组相比,1倍剂量组嗜酸性粒细胞、嗜碱性粒细胞计数差异显著(P<0.05);3倍剂量组嗜中性粒细胞计数、红细胞计数、血红蛋白、红细胞压积差异显著(P<0.05);5倍剂量组嗜中性粒细胞差异显著(P<0.05),其他无显著性差异。血清生化测定结果与对照组相比,1倍剂量组球蛋白、ALT、肌酐和钙离子差异显著(P<0.05),3倍剂量组、5倍剂量组ALT、肌酐差异显著(P<0.05)。在观察期结束后各组血清生化及血常规参数均无显著性差异(P>0.05),且处于正常范围内,表明帕托珠利混悬液在5倍最大推荐剂量下对仔猪的血常规和血清生化指标无影响。
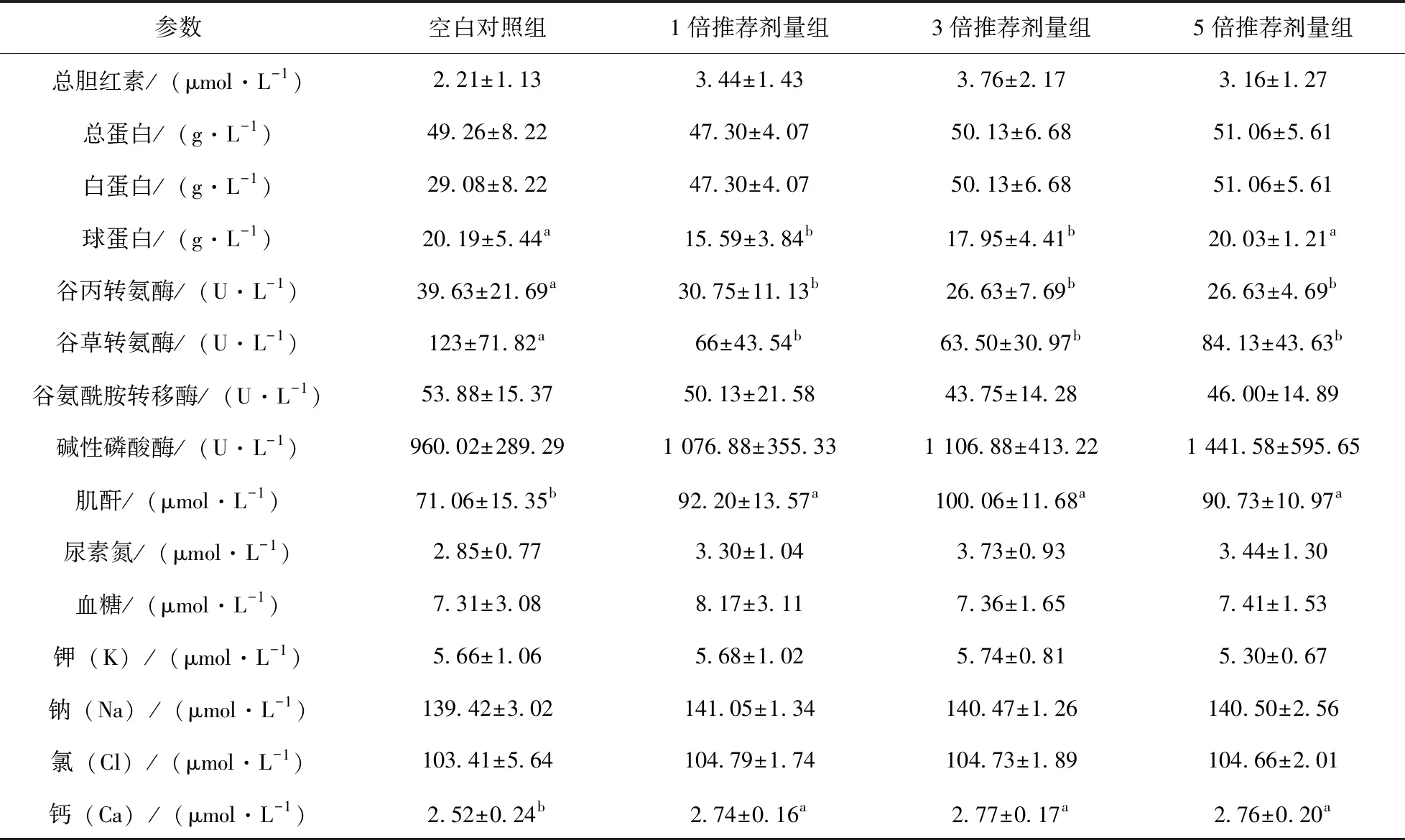
表5 第3次给药结束后各组仔猪血液生化参数测定结果(n=8)
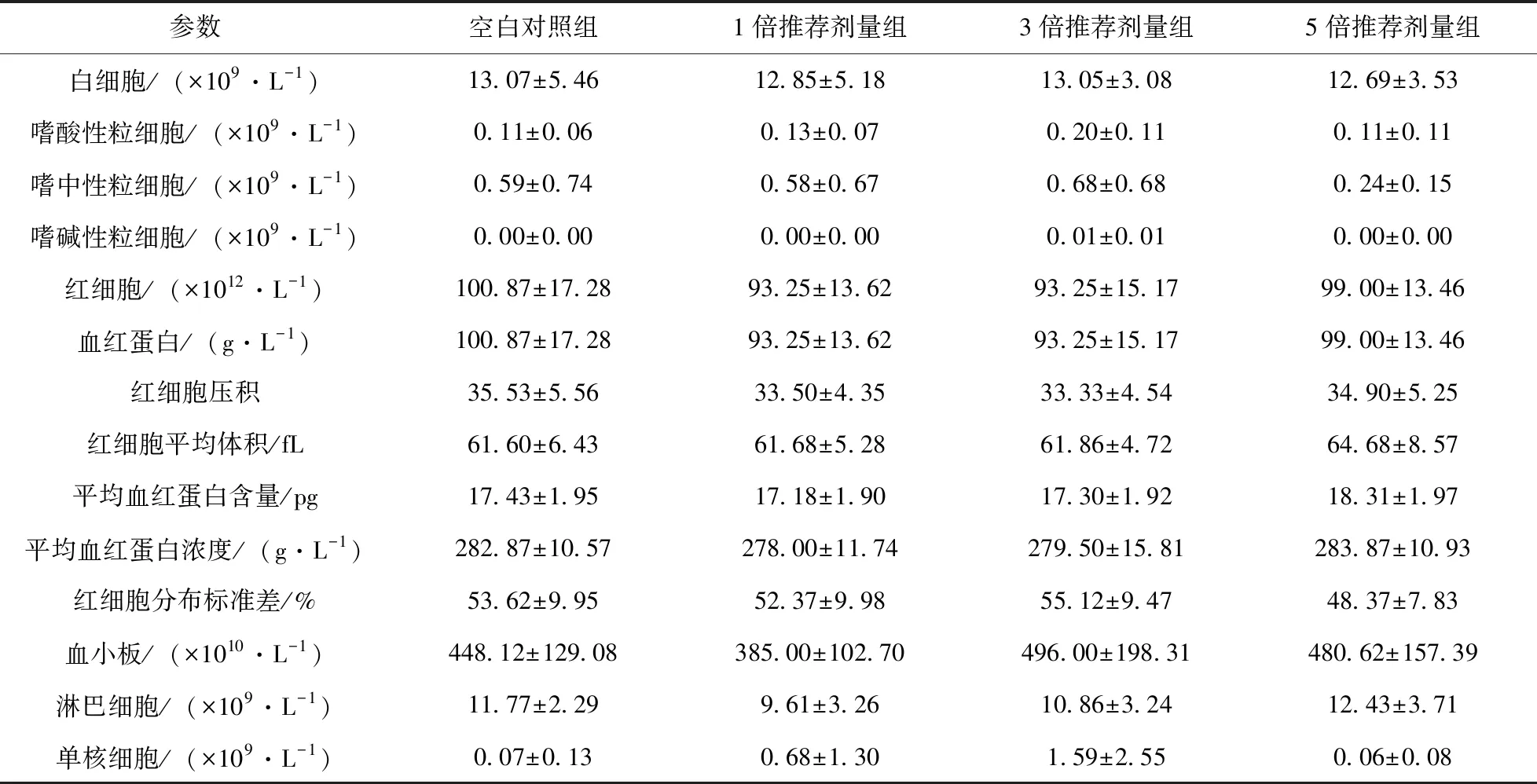
表6 观察期结束后各组仔猪血常规参数测定结果(n=8)

表7 观察期结束后各组仔猪血液生化参数测定结果(n=8)
2.4 病理学变化
试验结束后处死各组所有存活仔猪并进行尸检,均未见明显眼观病变。对5倍剂量组和对照组仔猪剖检进行组织病理学检查均未见明显异常病变:心肌细胞排列整齐且间隙正常,无充血及炎性细胞出现(图1);肝细胞(图2)、脾细胞(图3)形态完整,肺泡大小正常且无炎性细胞出现(图4);肾小球、肾小囊、肾小管管腔正常(图5)。此外,十二指肠和空肠皱壁及肠绒毛形态正常,无脱落萎缩等情况,肠黏膜下层可见肠腺;淋巴结中皮质及髓质细胞形态结构正常,淋巴窦未见充血现象(图片略)。


A. 对照组;B. 5倍剂量组
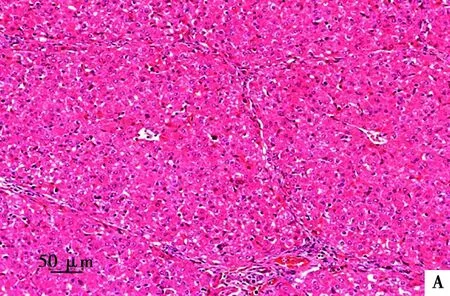

A. 对照组;B. 5倍剂量组
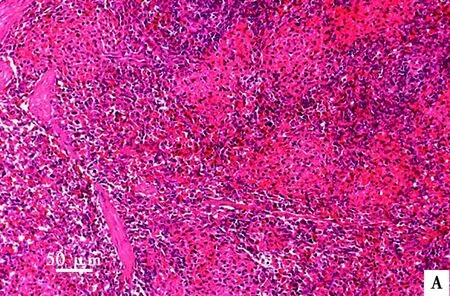
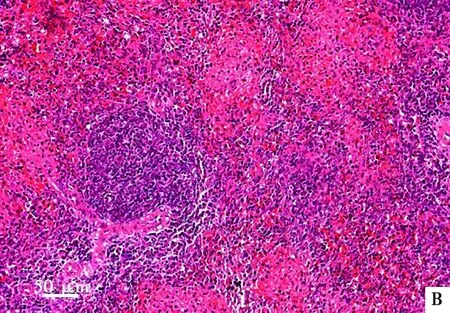
A. 对照组;B. 5倍剂量组
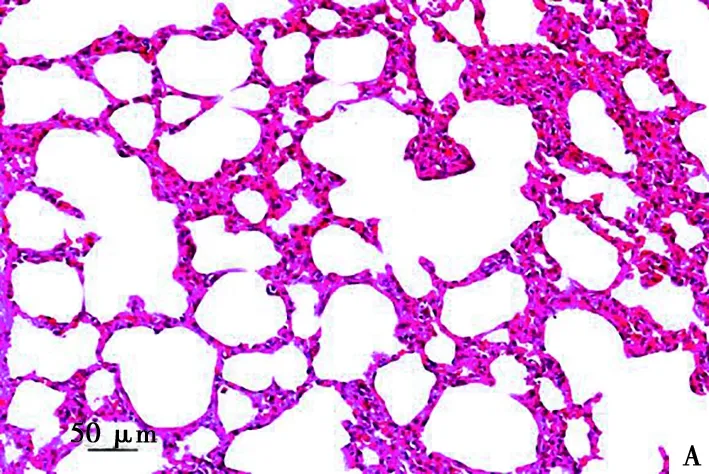

A. 对照组;B. 5倍剂量组

A. 对照组;B. 5倍剂量组
3 讨论
靶动物安全性研究其实是一种毒性研究,其目标是证明在推荐的应用条件下药品对靶动物的安全性、与这种药物的毒性相关的症状和影响,以及如果5倍的最大推荐剂量水平或更少对靶动物具有毒性,则毒性研究应证明这种药品对动物健康或生产无明显不良反应的最大剂量水平。靶动物安全性试验通过临床症状观察、组织病理学观察、血常规指标和血液生化指标来发现尚处在开发阶段的新兽药,过量和延长用药时间是否会导致与药物有关的不良反应,从而确定该药的安全范围[8]。
本试验中,试验期间所有仔猪均存活,仅对照组和3倍剂量组中各有一头仔猪因抢奶困难,增重较差外,其他受试动物的精神状况均良好,哺乳行为、排便均无异常。所有仔猪给药期间均未出现呕吐反应。第3次给药结束后,与空白对照组相比,1倍剂量组的平均嗜酸性粒细胞含量较高;1倍、3倍、5倍剂量组的平均嗜中性粒细胞含量均有不同程度升高;3倍剂量组红细胞含量、血红蛋白含量以及红细胞压积偏低。由于新生仔猪尚处于哺乳阶段,各项血液参数不稳定[9],因此没有证据表明与给药剂量存在相关性。在观察期结束后,各剂量组的平均血常规参数间均无明显差异。
肌酐是肌肉在体内的代谢产物,主要经肾小球滤过排出体外。肌酐正常指标为44~133 μmol/L,过高的肌酸含量表示肾脏出现损伤,肾功能不全。给药后血液生化参数显示,与空白对照组相比较,各受试药物组的肌酸水平均稍有升高,但肾脏组织病理学检查均未见异常,表明帕托珠利对肾脏无影响。
谷丙转氨酶和谷草转氨酶主要分布于肝细胞中,肝细胞有炎症、坏死、中毒等造成肝细胞损伤时,便会释放入血,使转氨酶上升[9]。试验结束后各剂量组血液生化参数与空白对照组相比,无显著性差异,且均在正常范围内,综合肝脏病理切片表明高剂量5%帕托珠利混悬液对仔猪肝脏无损伤。
本试验中,5%帕托珠利混悬液3次给药后,1、3、5倍剂量组与空白对照组相比较,血常规、血液生化指标均差异不显著,各剂量组之间无明显差异;对照组和5倍剂量组中剖检仔猪的主要脏器均未发现异常,组织病理学检查亦未见明显病理变化。试验期间未观察到其他不良事件。研究表明,5%帕托珠利混悬液按推荐剂量使用对仔猪具有较高的安全性。
