原代SD大鼠视网膜微血管内皮细胞的培养及鉴定
2021-07-08林华城刘海琴马华根唐元瑜
林华城,刘海琴,马华根,唐元瑜
(1福建中医药大学第二临床医学院;2福建中医药大学中西医结合学院;3福建中医药大学中医学院,福州350122)
视网膜微血管,主要是由一层单层扁平上皮细胞构成,其调节血压功能和屏障功能容易受到心[1]、脑[2]、肾[3]或血液循环等[4]病变的影响而发生管壁形态改变以及渗出、出血、新生血管增生等病变[5]。视网膜血管病变危害性大,具有致盲性,近年来其发病率不断升高,如何延缓视网膜血管病变的发展进程,已成为临床医生及医学科研人员亟需攻克的难题[6,7]。视网膜微血管内皮细胞(retinal microvascular endothelial cells,RVECs)是构建视网膜血管病理模型的重要工具细胞之一。由于人的视网膜获取途径较少,因此与人高度同源的大鼠视网膜血管内皮细胞便成为了目前研究视网膜血管病变最广泛的选择。本研究拟建立一种高效、简易、细胞获取量多、纯度高的大鼠RVECs培养方法,为后续视网膜血管疾病的研究奠定重要的细胞生物学实验基础。
材料和方法
1 实验动物
6~8周龄的SPF级Sprague-Dawley大鼠5只,雌雄不拘。购自福建医科大学实验动物中心,动物质量合格证号SCXK(闽)2016-0002。
2 主要试剂及仪器
胎牛血清(美国Gibco公司);肝素钠(南京新百药业有限公司);Ⅱ型胶原酶(北京鼎国生物公司);胰蛋白酶-EDTA消化液(南京凯基生物公司);即用型SA1022—兔IgG/SABC免疫组织化学染色试剂盒、兔抗大鼠VIII因子相关抗原抗体、DAB显色剂(武汉博士德生物公司)。超净工作台(苏净集团安泰空气技术有限公司);低速离心机(中国湖南湘仪公司);倒置生物显微镜(德国Leica公司);CO2培养箱(美国Thermo公司)。
3 大鼠RVECs的原代培养
在动物实验中心,将受试大鼠颈椎脱臼处死,固定于解剖台上,常规眼部消毒后,拉紧颈部皮肤,使眼球突出于眼睑。用弯镊夹持视神经根部,将眼球向上托起,摘取眼球,迅速置于无菌离心管内,带回细胞室。
在超净台中,将眼球附属的细线状视神经根、眼球外肌肉以及筋膜等轻轻剥离。用预冷PBS溶液漂洗修整过的“clear eye”眼球3次后,用两把眼科弯镊配合,轻轻挤压眼球四周,然后用虹膜剪在角膜缘后0.2mm处环形剪一周,将角膜、虹膜、睫状体和晶状体一并去除,并挤压眼球,去除玻璃体;翻转眼球壁,用显微剪剪断视网膜与视盘粘连处,使视网膜脱落、游离,并用钝头吸管将其转移至离心管中。
用预冷的PBS溶液反复吹打、漂洗视网膜后,将其剪碎至肉泥状,依次通过200μm、75μm不锈钢标准筛网;收集筛网下滤液,将其转移至15ml离心管中,离心,弃上清,向管内滴加10ml 0.1%II型胶原酶溶液,37 ℃消化15~20min;轻轻吹打后,再次通过45μm尼龙筛网;翻转筛网,将其倒扣在培养皿中,冲洗筛网,将冲洗液全部转移至15ml离心管内,轻缓吹打后,离心,弃上清,加入含25%胎牛血清、胰岛素、肝素、L-谷氨酰胺的M199完全培养液,混匀后接种于1%明胶包被的Nunc培养皿中,轻缓作十字形晃动,静置于CO2培养箱中培养,48 h后半量更换新鲜培养液。
4 大鼠RVECs的传代培养
待大鼠RVECs进入对数生长期,细胞融合度接近85%~90%时,吸弃旧培养液,用37℃预热的PBS溶液漂洗2遍后,加入4ml 0.25%胰蛋白酶-0.02%EDTA混合消化液,室温消化2~3min。镜下观察到大部分细胞圆缩、开始脱壁时,加入4ml完全培养液终止消化,轻缓吹打瓶壁以进一步促进细胞脱落;离心,弃上清液,将细胞沉淀与6ml培养液吹打混匀后,以1:2的传代比例接种于培养皿中,置于37℃、5%CO2培养箱内培养。
5 倒置相差显微镜下观察细胞生长情况
在不同时间点,将接种有原代和第一代传代大鼠RVECs的培养皿置于倒置相差显微镜下,观察细胞的形态、贴壁、密度及融合度等生长情况,并拍照记录。
6 免疫细胞化学染色法检测VIII因子相关抗原
将原代大鼠RVECs消化成单细胞悬液后,接种于培养皿中,待其贴壁生长至融合度接近80%时进行Ⅷ因子相关抗原鉴定。用PBS溶液轻缓漂洗细胞5 min×3次,滤纸吸干残存液;滴加预冷的4%多聚甲醛,覆盖于细胞表面,常温固定15min;甩弃固定液,PBS溶液轻缓漂洗5min×3次,滴加0.3%Triton X-100,透膜15min;倾倒透膜液,PBS溶液漂洗5min×3次,滴加5%牛血清白蛋白,室温封闭20min;甩弃封闭液,滴加1:300稀释的兔抗大鼠VIII因子相关抗原抗体覆盖于待测细胞表面,置于湿盒中,4℃孵育过夜;复温,甩弃一抗,PBS溶液漂洗5min×3次,滴加羊抗兔IgG抗体,37℃孵育30min;甩弃二抗,PBS溶液漂洗5min×3次,滴加SABC,37℃孵育30min;PBS漂洗5min×3次,DAB室温显色,倒置相差显微镜下控制染色时间,并拍照成像。
结 果
1 原代大鼠RVECs生长情况
倒置相差显微镜下观察可见:接种于培养皿中的血管组织碎片培养48h后开始贴壁,细胞以组织块为中心,向外迁移,岛屿状细胞团初步形成(图AC)。96h后细胞集落逐渐融合,铺满皿底,呈典型的单层、扁平、铺路石样镶嵌式排列(图D、E)。少数铺路石样细胞则被神经细胞缠绕包围,成混杂式生长(图F)。
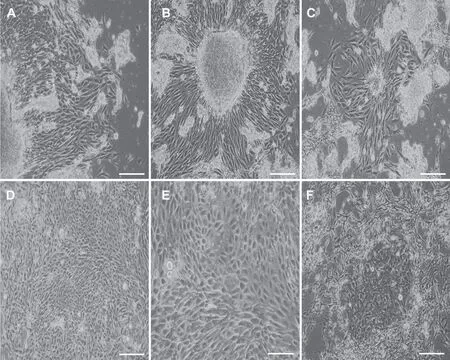
图1 原代大鼠RVECs在不同时间点的生长状态与形态 A—C:接种48h后微血管内皮细胞以贴壁的血管组织碎块为中心,开始向外周迁移,岛屿状细胞团初步形成; D和E:96 h后细胞铺满皿底,呈典型的单层、扁平、铺路石样镶嵌式排列; F:少数铺路石样细胞被神经胶质细胞缠绕包围,呈混杂式生长。比例尺:A—D和F,100μm;E,50μmFig. 1 The growth state and morphological observation of RVECs at different time points. A to C:the microvascular endothelial cells began to migrate outward with adherent vascular tissue fragments as center and the island shaped cell masses initially formed after 48h of inoculation; D and E: the cells were spread all over the bottom of the culture dish, forming a typical single-layer, flat, paving stone like mosaic arrangement after 96h of inoculation;F: a small number of paving stone-like cells are entwined and surrounded by glial cells and grow in a promiscuous manner. Scale bar: A to D, and F,100μm; E, 50μm
2 传代大鼠RVECs生长情况
细胞消化传代接种24h后,可见到短梭形或多角形的内皮细胞贴壁、伸展,呈团簇状分布(图A);5~6d后细胞群落相互融合,均匀铺满皿底,细胞形态保持不变,仍然呈典型的单层、扁平、铺路石样镶嵌式排列生长(图B、C)。
3 第Ⅷ细胞因子相关抗原免疫细胞化学表达
第一代RVECs传代细胞Ⅷ因子相关抗原免疫细胞化学染色显示,细胞结构层次分明,胞质、胞核淡染成棕红色(图A、C);苏木素衬染后,胞核淡染成浅蓝色(图B)。
讨 论
原代大鼠RVECs培养方法,主要包括组织块法和化学酶消化法。前者操作相对简单,但培养周期较长,不能完全保证每次原代细胞都能从组织块中爬出,且杂细胞较多,后期目的细胞的纯化工作也相对麻烦,实验成功率较低,目前国内仅有庄淼等[8]少数学者报道和使用过该方法。

图2 传代后大鼠RVECs融合前后的形态特点。A:传代24h后短梭形或多角形的微血管内皮细胞贴壁、伸展,呈团簇状分布;B和C:3~4d后细胞集落逐渐融合,细胞形态仍然保持典型的单层、扁平、铺路石样镶嵌式排列生长。比例尺:A和B,100μm;C,50μmFig. 2 Morphological observation of cells before and after fusion after cell passage. A:the microvascular endothelial cells in short spindle shape or polygon shape were adherent and extended, and distributed in clusters after passage for 24h; B and C: the cell colonies gradually fused and the cell morphology still maintained the typical monolayer, flat, paving stone like mosaic arrangement after passage for 3 to 4d. Scale bar: A and B, 100μm; C,50μm
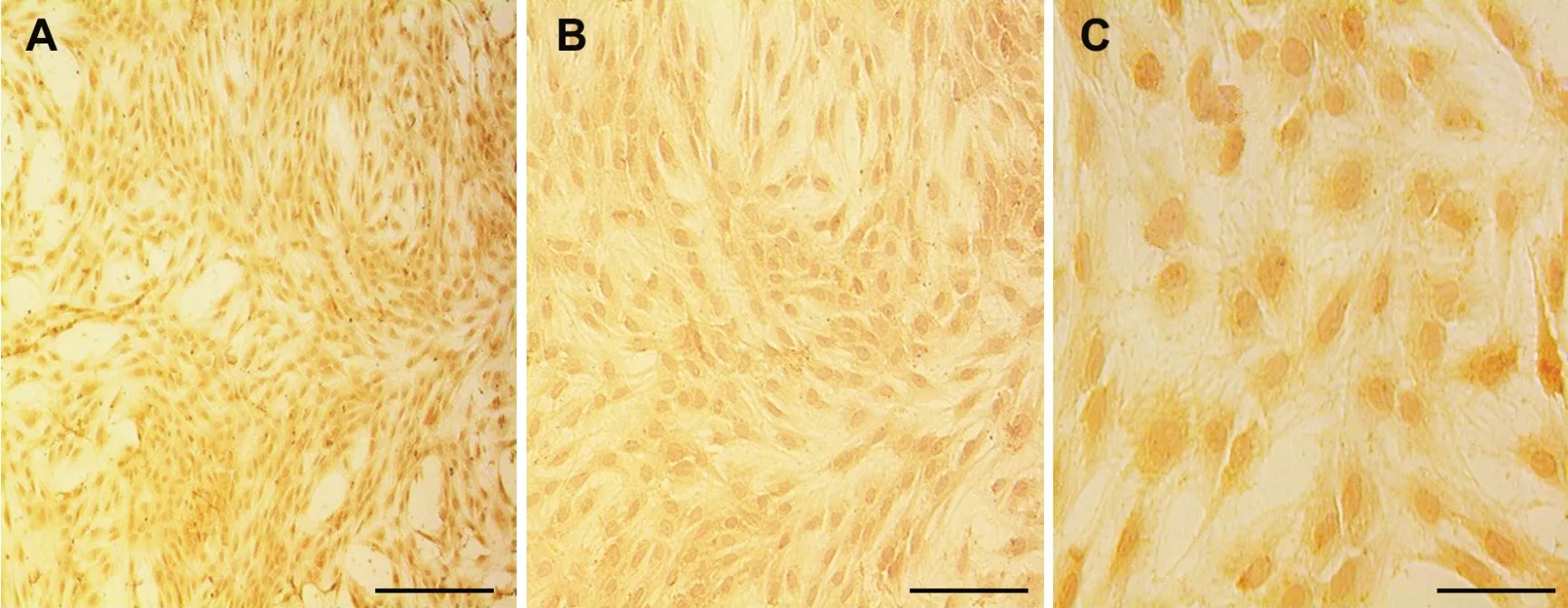
图3 第一代大鼠RVECs VIII因子免疫细胞化学染色。A和C:100倍、400倍镜下细胞结构分明,胞质、胞核呈现棕红色,VIII因子免疫细胞化学染色表达为阳性;B:苏木素衬染,细胞核淡染成浅蓝色。比例尺:A,200μm;B,100μm;C,50μmFig. 3 Iμmunocytochemistry staining of factor VIII related antigen in rat RVECs of the first passage. A and C: the cell structure is clear under the ×100 and ×400 magnification views, the cytoplasm and nuclei show brownish red, means positive expression of factor VIII related antigen;B: the nucleus is lightly blue stained after hematoxylin counter staining. Scale bar: A, 200μm; B, 100μm; C, 50μm
化学酶消化法则是通过酶的消化作用,松解视网膜微血管的周细胞,使内皮细胞更容易从血管碎块中爬出,生长速度亦高于单纯的组织块培养法,因而成功率较高并最为常用,其中消化酶的种类、浓度以及作用时间是实验的关键。如国内学者王征等[9]采用由胶原酶、DNA酶和蛋白酶E组成的混合酶进行消化;而杨密清等[10]则选择单一的0.2%Ⅰ型胶原酶,持续消化25mim,其优点在于酶液对细胞的化学损伤较小,存活率较高;毛羽翔[11]、李斌等[12]则采用二步酶消化法,依次用2%的胰蛋白酶和0.133%的胶原酶消化血管组织15min,缩短了消化时间。本研究经过反复实践探索,发现消化酶使用时,提前37℃预热30min,可达到酶液的最佳活性;同时,0.1%II型胶原酶消化15~20min,可松动周细胞,使周细胞在外力吹打作用下更容易脱落,培养出的微血管内皮细胞纯度更高。
此外,原代大鼠RVECs培养过程中最常见的问题是杂细胞的污染。为了减少大血管内皮细胞、视网膜色素上皮细胞、周细胞等杂细胞的混入,保证培养的目的细胞大部分为大鼠RVECs,如何分离视网膜组织以获得纯度较高的内皮细胞是实验能否成功的关键。目前大鼠RVECs的纯化方法较多,但各有利弊,如鲁建明等[13]在培养的血管内皮细胞纯度达到90%后,采用单细胞克隆法进一步纯化细胞,但该方法操作难度较高,实验周期长,不便于推广。田景毅[14]、林勇等[15]则采用磁珠筛选法进行纯化,但磁珠价格昂贵,且一般实验室不具备操作所必需的磁化仪器。徐国兴等[16]则根据细胞比重的不同,采用percoll细胞分离液进行纯化,通过高速离心,使不同比重的细胞分层而将内皮细胞与周细胞分离,其大鼠RVECs纯度可达98%,但该方法需要使用高速离心机,且操作也相对繁琐,所以推广亦有一定难度。丁煜等[17]则根据细胞对基质粘附性的不同,采用差速消化方法,使用胰酶将粘附性较低的内皮细胞先消化脱壁下来,吹洗收集细胞后,通过不断传代进行细胞纯化。课题组则认为:视网膜的细胞组分复杂,大鼠RVECs的纯化工作是一个将多种细胞纯化方法结合、联合使用的过程,主要包括:①反复漂洗以去除视网膜色素上皮细胞;②通过3次不同孔径的细胞筛网以去除Müller神经胶质细胞和周细胞;③根据细胞之间贴壁、粘附能力的不同,使用差速消化法去除成纤维细胞;④反复多次换液及传代去除红细胞、神经元等;⑤利用大鼠RVECs的细胞群体优势和生长优势约束和抑制其它杂细胞的生长。通过以上方法,结合实验室自身条件,采用综合手段即可达到纯化大鼠RVECs的目的。
总之,本实验将酶化学消化法与物理过筛法结合,成功培养出了纯度较高的大鼠RVECs,并针对该细胞特异性VIII因子相关抗原,运用免疫细胞化学染色方法,结合细胞形态学观察,对所培养的目的细胞进行了鉴定。该方法简便高效,实验成本低,成功率高,值得推广。
