LncRNA SNHG3对宫颈癌细胞SiHa增殖、迁移及侵袭的影响
2021-07-08孙子久孙恃雷方玉婷余伙梅
孙子久,胡 静,胡 凯,唐 敏,孙恃雷,方玉婷,余伙梅,张 彦
重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆 400016
宫颈癌是一种致死率较高的女性恶性肿瘤,每年约有53万新发病例和27万死亡病例[1]。每年死于宫颈癌的患者有85%来自不发达国家或发展中国家,低收入和中等收入国家的宫颈癌病死率是高收入国家的18倍[2-4],这表明研究宫颈癌进展的分子机制十分必要[5]。随着测序技术的进步,越来越多的非编码RNA(ncRNA)被发现。其中长链非编码RNA(lncRNA)是一类长度超过200个核苷酸的非编码RNA。研究表明,长链非编码RNA参与多种生物进程,如调控基因表达、亚细胞结构和蛋白复合物的稳定等[6]。近年来,越来越多的研究表明长链非编码RNA在调节包括宫颈癌在内的人类恶性肿瘤发生发展中起着至关重要的作用[7]。
小核仁RNA宿主基因3(SNHG3)是一个新发现的位于1p36.1的lncRNA[8]。近来一项生物信息学分析显示SNHG3可能在调控RNA剪接、tRNA处理、信号转导、细胞粘附、转录和凋亡等方面发挥重要作用[9]。目前已有文献报道,在lncRNA SNHG3启动子上存在与转录因子E2F1结合的位点,E2F1激活SNHG3后,可通过TGF-β信号通路和IL-6/JAK2/STAT3信号通路促进小鼠非小细胞肺癌细胞系的增殖和迁移,从而促进肺癌进展[10]。在乳腺癌中,lncRNA SNHG3可通过SNHG3/miR-384/肝癌衍生生长因子轴促进细胞增殖和侵袭[11]。此外,lncRNA SNHG3 可通过SNHG3/miRNA-151a-3p/RAB22A轴调控骨肉瘤的侵袭和迁移[12]。而在前列腺癌细胞中,lncRNASNHG3可与miR-577竞争性结合并上调前列腺癌SMURF1表达,从而达到促癌作用[13]。然而,lncRNA SNHG3在宫颈癌中的作用尚未见报道,其在宫颈癌细胞中是否同样发挥促癌的作用有待深入研究。因此,本研究拟在人宫颈癌SiHa 细胞中探讨lncRNA SNHG3对SiHa细胞增殖、迁移及侵袭能力的影响及分子机制。
1 材料和方法
1.1 细胞与试剂
人宫颈癌细胞SiHa和人正常上皮细胞HaCaT由重庆医科大学检验医学院保存,DMEM 高糖培养基(HyClone);胎牛血清(FBS)(Gibco);Transwell 小室(康宁);TRIZOL试剂,LipofectamineTM2000 转染试剂(Invitrogen);逆转录及PCR 相关试剂(TaKaRa);Western blot及蛋白质提取相关试剂均(碧云天);ECL发光液(Millipore);鼠抗人β-actin 抗体(钟鼎生物);兔抗人Vimentin,Snail 抗体(Cell Signaling Technology),兔抗人E-cadherin,N-cadherin(Immunoway);二抗(山羊抗兔IgG/HRP标记,山羊抗鼠IgG/HRP标记)(北京义翘神州生物);Q-PCR引物由北京擎科新业生物技术有限公司合成;LncRNA SNHG3小干扰RNA套装由上海吉玛制药技术有限公司设计并合成。
1.2 方法
1.2.1 细胞培养 正常上皮细胞HaCaT 和宫颈癌细胞SiHa 用DMEM 高糖培养基(含100 mL/L FBS、1000 U/mL 氨苄青霉素、100 mg/mL 卡那链霉素)在37 ℃、50 mL/L二氧化碳的孵箱中静置培养。每2 d用胰酶消化传代。
1.2.2 小干扰片段转染及分组 将处于对数生长期的宫颈癌细胞SiHa消化并接种于6孔细胞板(6×105/孔),待融合度至65%~75%,更换无血清无抗生素的DMEM培养基,依照试剂盒说明书利用LipofectamineTM2000法分别转染细胞,转染4~6 h后将培养基更换为含培养基和抗生素的培养基,24~48 h后收集细胞进行下一步实验。实验中敲低实验分为对照组(siRNA-NC)和实验组(siRNA-1、2),siRNA序列见表1。

表1 siRNA序列Tab.1 Sequence of siRNA
1.2.3 实时定量PCR检测mRNA转录水平 Trizol试剂法分别提取各组细胞的总RNA,取1 μg RNA 逆转录成cDNA,运用qRT-PCR检测SNHG3、N-cadherin、Snail、Vimentin、E-cadherin和GAPDH的mRNA表达水平,其中GAPDH为内参,引物序列见表2。

表2 引物序列Tab.2 Primer sequences for RT-PCR
1.2.4 CCK8实验 将转染siRNA-1、2、3或siRNA-NC的宫颈癌SiHa细胞接种至96孔板中,约3000/孔,培养0、24、48、72、96 h后,加入CCK-8试剂,混匀后放培养箱后继续培养,2 h后酶标仪检测450 nm处各孔细胞光密度A450nm,绘制生长曲线,每组设定5个复孔。
1.2.5 划痕愈合实验 将SiHa细胞按5.0×105/孔的密度接种于6孔板,细胞融合度达60%~70%时转染,转染后6 h或融合度达95%以上时,使用10 μL小枪头在6孔板中间划线,PBS冲洗后,加入2 mL双无培养基并拍照划痕,此时记为0、12、36 h(或0、24和48 h)后在各组细胞相同位置拍照,后使用AdobeIllustrator软件计算0 h与12、36 h(或0、24和48 h)各组之间距离,根据公式:0 h距离-12 h距离/0 h距离和0 h距离-36 h距离/0 h(或0 h距离-24 h距离/0 h距离和0 h距离-48 h距离/0 h)距离计算平均划痕愈合率。
1.2.6 Transwell小室实验 Transwell小室实验分为纵向迁移和侵袭实验(侵袭实验进行前,需先于每个小室内加入35 μL基质胶,并置于37 ℃孵箱内1 h)。细胞中转染siRNA,胰蛋白酶消化转染24 h后的各组细胞,双无培养基重悬制备细胞悬液,计数制成细胞密度分别为4×104/mL(纵向迁移)和8×104/mL(侵袭)的单细胞悬液,在小室上层添加单细胞悬液200 μL,下室添加600 μL含20%胎牛血清的培养基。迁移及侵袭实验24 h后将小室取出,PBS冲洗两次,用4%的多聚甲醛固定下层细胞,0.05%结晶紫染色后,PBS冲洗两次,用棉签将小室上层细胞轻轻擦拭下去,干燥后在倒置显微镜下对小室下层细胞拍照计数。
1.2.7 Western blot检测EMT通路相关蛋白的表达水平收集对照组、实验组处理48 h后的SiHa细胞,提取细胞总蛋白质,BCA法检测蛋白质浓度,取35 μg蛋白质经10%的SDS-PAGE分离,恒流(210 mA)转移分离后的蛋白质至PVDF膜上;5%BSA37℃封闭2 h后,4 ℃下分别加入一抗过夜孵育(E-cadherin/N-cadherin/Vimentin/Snail/β-actin 1∶1000稀释);TBST洗去游离抗体,分别加入HRP标记的山羊抗兔IgG(1∶5000稀释)或HRP标记的山羊抗小鼠IgG(1∶5000稀释),37 ℃孵育1 h;1×TBST洗膜10 min×3,HRP化学发光液显色。
1.3 统计分析
每组实验重复3次,使用GraphPad Prism 5.0软件进行统计学分析。对实验数据进行正态性检验,符合正态分布的数据采用均值±标准差的形式表示,并在方差齐性同时,使用单因素方差分析进行多组间比较,采用t检验进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 LncRNASNHG3基因在人宫颈癌中的表达
通过分析GEO 数据库基因表达芯片(GSE9750、GSE27678)后发现,宫颈癌样本中SNHG3的表达高于正常宫颈组织(图1A)。同时,轻、重度宫颈鳞状上皮癌前病变样本中SNHG3表达均高于正常样本(图1B)。qRT-PCR结果显示,宫颈癌SiHa细胞中的SNHG3表达水平高于人正常上皮细胞HaCaT(P<0.001,图1C)。

图1 SNHG3在宫颈癌组织及细胞株SiHa中高表达Fig.1 SNHG3 is highly expressed in cervical cancer tissues and SiHa cells.A,B:RNA expression level of SNHG3 in cervical cancer samples.***P<0.001 (Normal tissue vs cervical carcinoma).C:Expression of SNHG3 in HaCaT cells and SiHa cells detected by qRT-PCR(***P<0.001).
2.2 LncRNASNHG3在宫颈癌细胞SiHa中成功敲低
通过qRT-PCR结果显示,与对照组相比,siRNA-1可成功敲低内源性SNHG3(P<0.001,图2)。

图2 SNHG3在宫颈癌细胞SiHa中成功敲低Fig.2 SNHG3 was successfully knocked down in SiHa cells as shown by qRT-PCR(***P<0.001).
2.3 LncRNASNHG3促进宫颈癌细胞SiHa的增殖
CCK8实验显示,与对照组比较,敲低SNHG3组能抑制宫颈癌细胞SiHa的增殖能力,差异具有统计学意义(P<0.001,图3)。
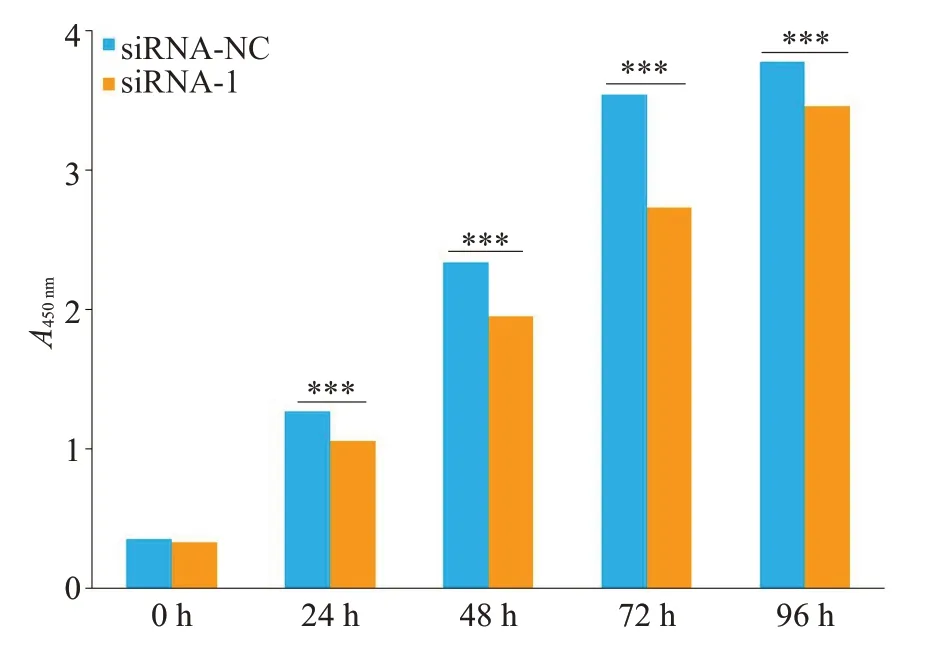
图3 SNHG3促进宫颈癌细胞SiHa的增殖Fig.3 SNHG3 knockdown inhibits proliferation of SiHa cells examined using CCK8 assay(***P<0.001).
2.4 LncRNASNHG3促进宫颈癌细胞SiHa的迁移
划痕实验结果显示,与对照组相比,敲低lncRNA SNHG3后SiHa细胞划痕愈合率在24 h和48 h均有明显的降低(P<0.001,P<0.01,图4A);Transwell小室纵向迁移实验结果显示,与对照组相比,敲低lncRNA SNHG3后SiHa细胞纵向迁移的细胞数量明显降低(P<0.001,图4B)。
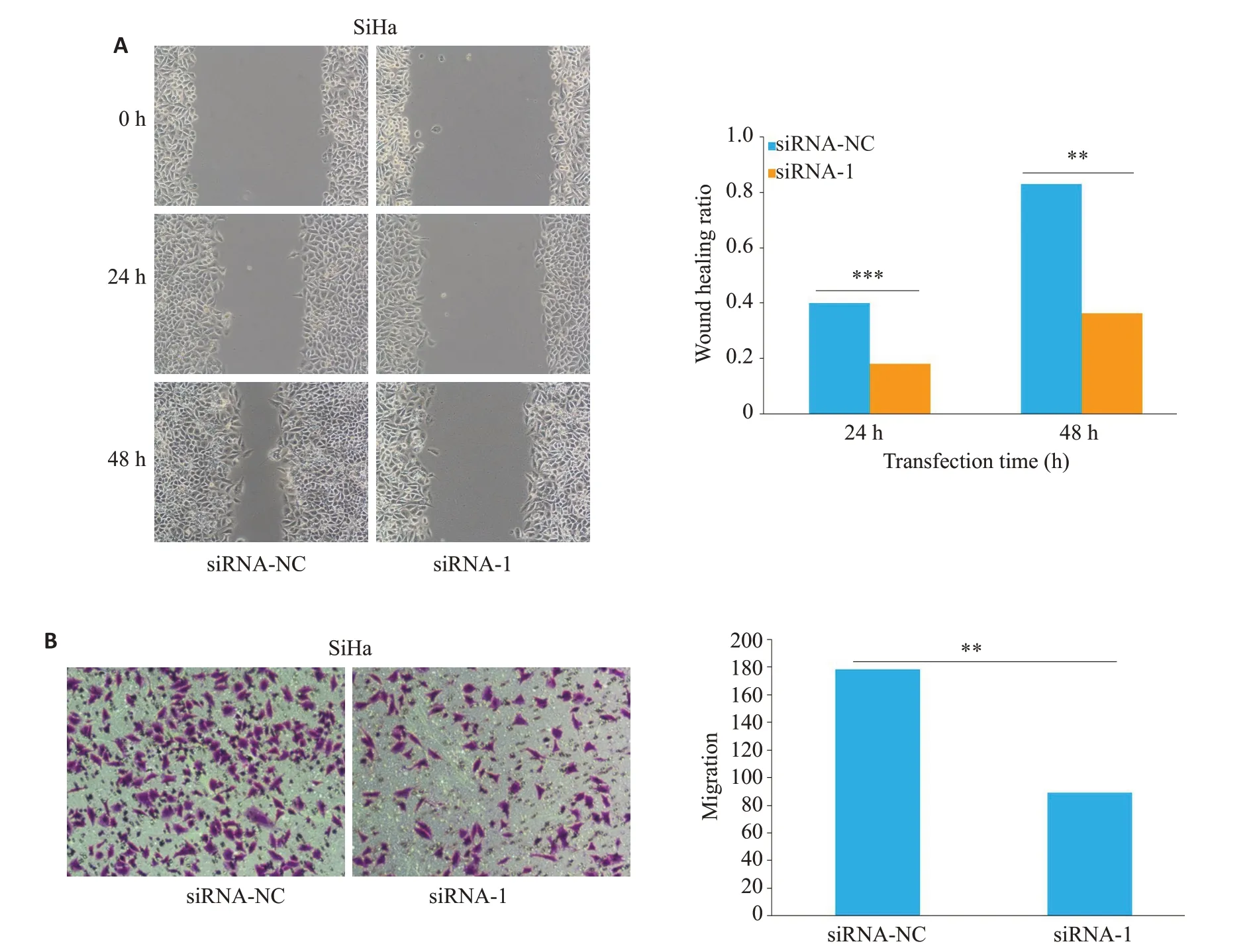
图4 SNHG3 促进宫颈癌SiHa细胞的迁移Fig.4 SNHG3 knockdown inhibits migration of SiHa cells shown by wound healing assay(A)and Transwell migration assay(B)(Original magnification:×400).**P<0.01,***P<0.001.
2.5 LncRNASNHG3促进宫颈癌细胞SiHa的侵袭能力
Transwell侵袭实验结果显示,与对照组相比,敲低SNHG3可明显减少SiHa细胞的穿膜数量(P<0.001,图5)。

图5 SNHG3 促进宫颈癌SiHa细胞的侵袭Fig.5 SNHG3 knockdown inhibits invasion of SiHa cells as shown by Transwell invasion assay(×400).***P<0.001.
2.6 LncRNA SNHG3促进人宫颈癌细胞SiHa的EMT进程
qRT-PCR 和Western blot 结果显示,与对照组相比,敲低SNHG3后SiHa细胞内促EMT相关标志物Ncadherin、Vimentin、Snail的mRNA及蛋白质水平均显著降低(P<0.001),而上皮细胞的标志物E-cadherin的表达水平则显著升高(P<0.001,图6A,B)。
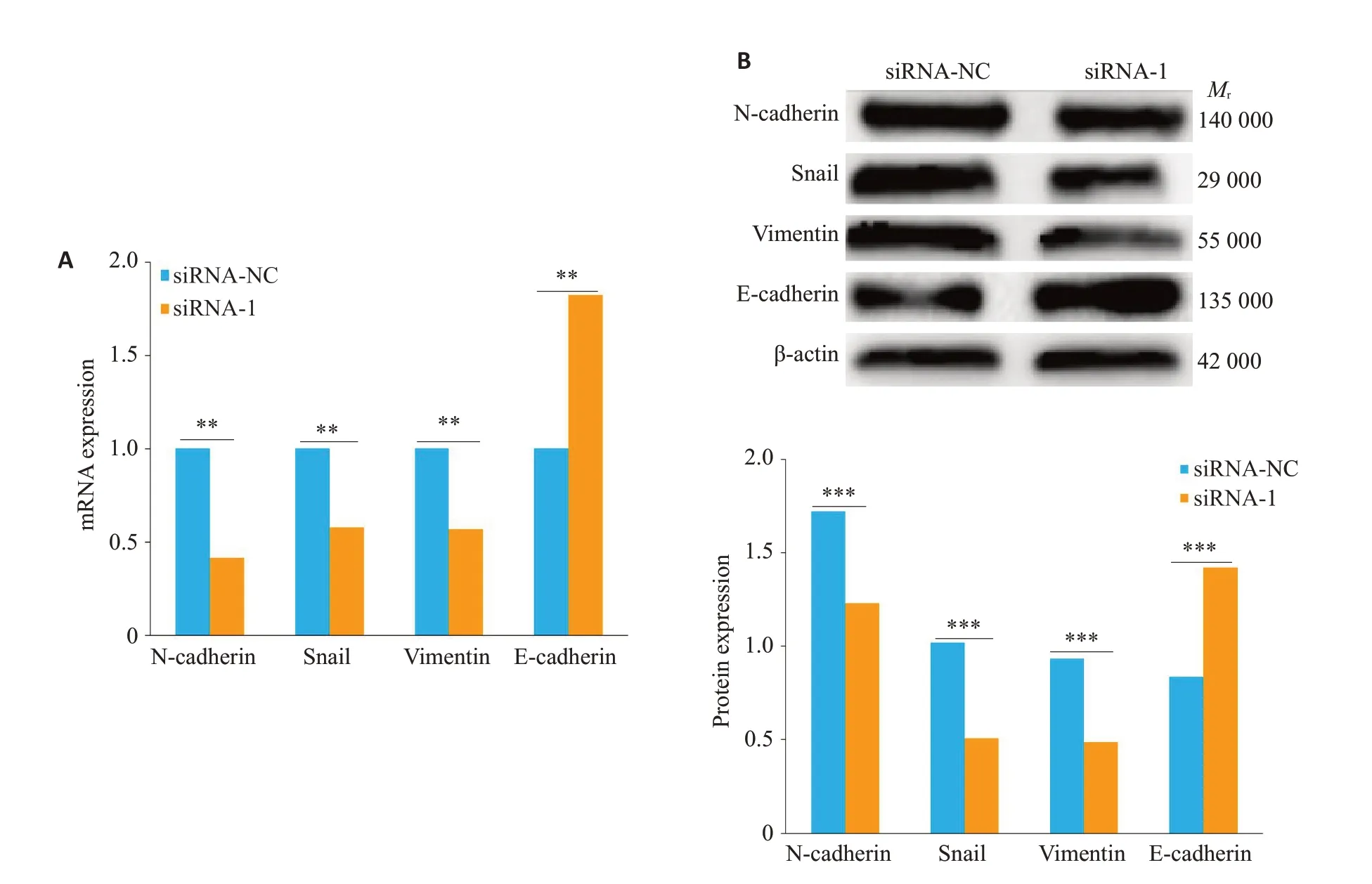
图6 SNHG3 激活SiHa细胞的EMT 信号通路Fig.6 Effects of SNHG3 knockdown on expressions of EMT markers in SiHa cells detected by qRT-PCR(A)and Western blotting(B).**P<0.01,***P<0.001.
3 讨论
宫颈癌的发病率和死亡率均位列女性恶性肿瘤的第4位[14]。由于目前中国尚未有全国性的癌症筛查,在过去的几十年里中国宫颈癌的发病率仍不见降低[15]。近年来,靶向治疗逐渐成为宫颈癌治疗的重点[16]。研究表明,lncRNA具有较高的组织特异性和稳定性,可能成为潜在的治疗靶点并用于诊断或预后的生物标志物[17]。本研究通过qRT-PCR技术结合生物信息学分析发现lncRNA SNHG3在宫颈癌组织样本和细胞系中显著高表达。与此同时,目前已有的多篇文献报道,lncRNA SNHG3在胃癌[18]、非小细胞肺癌[10]、胶质瘤、喉癌及前列腺癌[19-20]等多种肿瘤组织中的表达水平均明显高于其癌旁组织。这些结果提示lncRNA SNHG3可作为宫颈癌中潜在的诊断及治疗靶标,lncRNASNHG3在宫颈癌细胞中的具体作用值得深入探讨。
长链非编码RNA可通过调控肿瘤细胞的增殖、侵袭和转移等恶性生物学行为,影响肿瘤的发生发展[21]。研究表明,lncRNA SNHG3 通过SNHG3/miR-216a/ZEB1轴促进非小细胞肺癌的增殖、侵袭和侵袭[22],而在膀胱癌中lncRNA SNHG3可通过SNHG3/miR-515-5p/GINS2轴显著抑制癌细胞的增殖和迁移[23]。本研究通过CCK8细胞活性检测实验、划痕愈合实验及Transwell迁移、侵袭实验发现,敲低SNHG3可明显抑制SiHa细胞的增殖、迁移及侵袭能力。以上结果表明,SNHG3可在多种肿瘤中发挥促癌作用。然而,有研究发现作为一种新的肿瘤抑制因子,SNHG3通过AKT/mTOR/ERK通路抑制甲状腺乳头状癌的增殖和转移[8]。由此,lncRNASNHG3在癌症中并非均为促癌基因,其在不同肿瘤中的作用及分子机制尚需进一步阐明。
近年来,lncRNA、EMT与肿瘤的相互关系已得到广泛研究[24-26],其中lncRNA SNHG3可以激活EMT进程来实现促进肿瘤细胞的增殖、迁移及侵袭[27]。EMT即上皮-间质转化的过程,同时伴随向继发部位的浸润。已有研究报道:在肝癌细胞中,过表达lncRNA SNHG3可通过miR-128/CD151通路激活EMT和促进增殖、侵袭[28]。同时,本研究发现,在宫颈癌SiHa细胞中敲低SNHG3后,EMT中转移相关因子N-cadherin、SNAIL及Vimetin的mRNA和蛋白表达水平均显著下调,而E-cadherin的表达水平上调。这就表明SNHG3极有可能通过激活EMT在宫颈癌SiHa细胞中实现促癌作用。
综上所述,本研究首次发现lncRNA SNHG3在宫颈癌中高表达,SNHG3可能通过激活EMT促进宫颈癌细胞的增殖、迁移及侵袭能力,但在宫颈癌细胞中lncRNASNHG3激活EMT的具体分子机制有待进一步的分析。
