利用民猪耳缘组织重复培养成纤维细胞的研究
2021-07-08王春安狄生伟付德昌
王春安,狄生伟,付德昌,郑 鹏
(1 黑龙江昇太牧业发展有限公司,黑龙江 兰西 151500;2 东北农业大学 动物科学技术学院,哈尔滨 150030)
中国是世界第一养猪大国,具有丰富的猪种资源,中国的猪种资源对世界的养猪生产和猪的育种都具有重要意义。然而由于各种原因,有些地方猪种数量急剧下降,甚至绝种,因此,亟需加强地方猪种的活体保存及利用生物技术保存种质资源[1-3]。
民猪是中国东北地区一个古老的地方猪种,具有产仔多、肉质好、抗寒、耐粗饲的突出优点[4],是受保护的国家级地方品种。可以采用细胞培养技术从细胞水平保存民猪这一重要遗传资源。
利用猪的耳缘组织培养成纤维细胞是一种操作简单、常用的方法,为了在动物组织块的再利用、遗传资源的保存中探索一种新的保存方法,试验在采用植块法培养民猪耳缘组织成纤维细胞的基础上,进一步探讨了组织块的再培养和冷冻保存后再培养的方法,现报道如下。
1 材料与方法
1.1 试验动物
民猪,为饲养在黑龙江省兰西县种猪场(黑龙江昇太牧业发展有限公司)内的保种种猪,按照饲养标准饲喂,自由饮水。按照家系、个体之间没有亲缘关系进行选择,共采集45头民猪耳缘组织。
1.2 主要试剂
DMEM/F-12、胎牛血清(FBS),购自HyClone公司;双抗,为100×青霉素-链霉素溶液,100 mL装,每毫升含10 000 U 青霉素和10 mg 链霉素,Biosharp 公司产品;其他试剂如无特殊说明,均购自Sigma公司。
细胞培养基:DMEM/F-12+15%FBS+1%双抗(10 mg/mL的青霉素和链霉素)。消化液:0.25%胰蛋白酶(Amresco)。细胞冻存液:DMEM/F-12+15%FBS+10%二甲基亚砜(DMSO)+1%双抗。
1.3 耳缘组织采集
保定猪只,用75%酒精棉擦洗采样部位,用耳号钳在原有耳缺的部位剪下1块耳组织,放入添加2%双抗的PBS 的离心管内摇晃、清洗;然后将组织块移入有75%酒精的离心管内涮洗10 s 消毒;再将组织块移入2%双抗的PBS中摇晃清洗,去除残余酒精;最后将组织块放入含2%双抗的PBS的离心管中,置于4 ℃采样箱内,送回实验室。
1.4 组织块处理
将运回实验室的组织块移入75%酒精中浸泡10 s进行初步灭菌;随后用含2%双抗的PBS清洗;将组织块移入玻璃皿中,用灭菌手术刀将毛发充分刮净,用含2%双抗的PBS 清洗后,再次将组织块移入75%酒精中浸泡10 s;再用含2%双抗的PBS 清洗,去除残余酒精;将组织块移入加有培养液的玻璃皿中。
1.5 组织块的植块培养
用灭菌眼科剪将组织块剪成1 mm3块,用培养液清洗组织块后浸泡在培养液内;用牙签或镊子将剪碎的组织块摆到新的60 mm 培养皿内,置于37 ℃、5%CO2、饱和湿度的培养箱中;过夜培养后,组织块牢固地贴在底壁上,加入新鲜的培养液继续培养;每2~3 d 换一次培养液,直到细胞生长至90%;采用胰酶进行消化,传代。
1.6 组织块的再培养
将1.5中组织块生长出的细胞进行消化、传代后,剩余的组织块用培养液清洗一遍,将组织块摆到新的60 mm 培养皿内,置于37 ℃、5%CO2、饱和湿度的培养箱中,重新进行植块法培养;过夜培养后,组织块牢固地贴在底壁上,再加入新鲜的培养液继续培养;每2~3 d换一次培养液。
1.7 组织块冷冻后的再培养
将1.5中的组织块生长出的细胞进行消化、传代后,将剩余的组织块用培养液清洗一遍,15~20 个组织块加入1.5 mL 冷冻液,移入1.8 mL冻存管内,将冻存管放入细胞冻存盒内,置于-80 ℃冰箱内过夜,然后置于液氮内保存。冷冻保存20 d后,用37 ℃温水解冻,用培养液对组织块进行清洗,再按照1.6 的方法重新进行植块法培养。
1.8 细胞的传代培养与生长曲线绘制
当组织块法培养的细胞长满皿底后,用胰酶进行消化、传代,观察细胞的生长形态。选择第二代的成纤维细胞,用胰酶消化,制成细胞悬液,调整细胞密度为1×104个/mL,用96孔培养板培养,每孔接种100 μL,每2 d 换液1 次,每24 h 计数1 次,每次每组取3 孔,每孔计数3 次,求平均值。以细胞密度(个/mL)为纵坐标、培养天数(d)为横坐标绘制生长曲线。
2 结果
2.1 植块法培养成纤维细胞
新鲜猪耳缘皮肤组织贴壁5 d后,可见组织块周围有细胞游离出来并贴壁生长,细胞呈圆形、梭形、三角形等形态。随着培养时间的延长,组织块周围的细胞生长速度增加。除成纤维细胞外,还可以见到上皮细胞、圆形细胞,其中上皮细胞围绕组织块,紧靠组织块生长,成纤维细胞迅速向外周生长,并逐渐成为优势生长的细胞(见图1A)。培养15 d后,细胞逐渐铺满皿底(图1B),可以进行传代培养。利用此种方法,培养了45 头民猪的成纤维细胞。

图1 新鲜组织块经植块法培养的成纤维细胞
2.2 成纤维细胞的传代
成纤维细胞长满皿底后可以进行传代,利用成纤维细胞和上皮细胞对胰酶敏感性的不同来控制消化时间,将成纤维细胞和上皮细胞分开。当成纤维细胞已经脱离皿底、而上皮细胞没有脱离时,终止消化(见图2),然后收集成纤维细胞进行冷冻保存或传代。
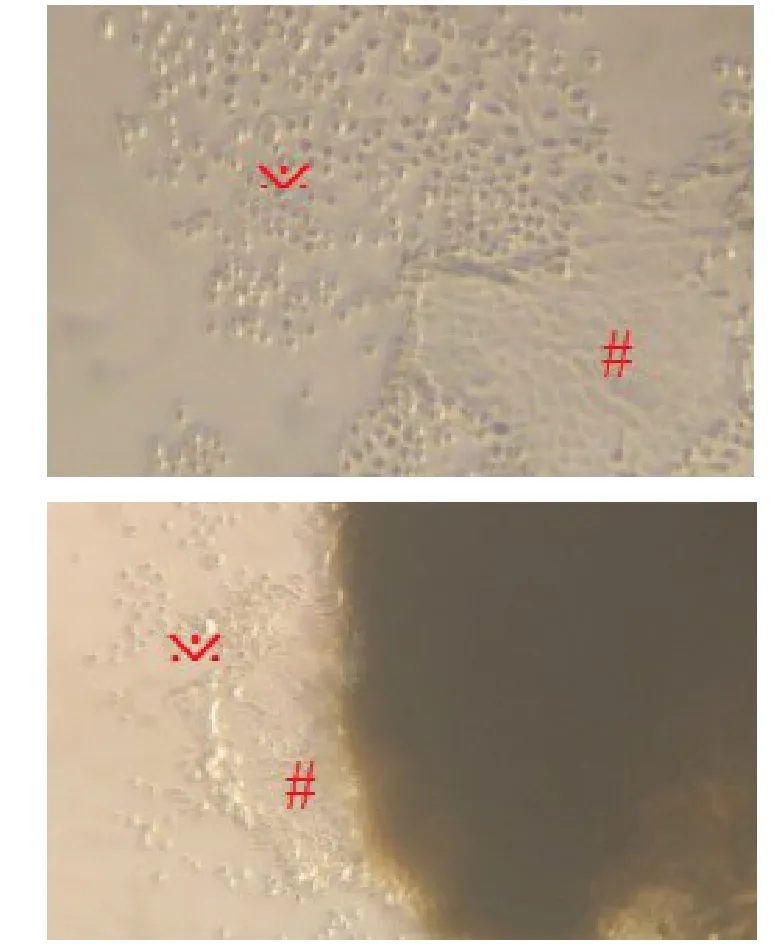
图2 植块法培养的成纤维细胞的消化
2.3 组织块的再培养
新鲜的组织块进行植块法培养成纤维细胞,当组织块周围长满细胞后,进行消化、吹打,然后将组织块用培养液清洗一遍,重新进行植块法培养。培养3 d后,可见组织块周围已经有成纤维细胞生长(见图3A),随着时间的增长,组织块周围的细胞逐渐增多(见图3B)。

图3 生长出细胞的组织块的再植块培养
2.4 组织块冷冻后再培养
新鲜的组织块进行植块法培养成纤维细胞,当组织块周围长满细胞后进行消化、吹打,然后将组织块用培养液清洗一遍,按照冷冻细胞的方法进行冷冻;冷冻20 d 后解冻,用培养液清洗一遍,重新进行植块法培养。培养3 d后,可见组织块周围已经有成纤维细胞生长,随着时间的增长,组织块周围的细胞逐渐增多(见图4)。
2.5 不同处理对组织块的细胞生长的影响
见表1。

表1 不同处理对组织块的细胞生长的影响(n=5)
试验经过采用新鲜组织块直接培养、长出细胞的组织块再培养、长出细胞的组织块冷冻后再培养,结果表明,组织块再培养、组织块冷冻后再培养后长出细胞时间和细胞传代时间都比新鲜组织块提前2 d,而且组织块再培养时污染比率明显低于新鲜组织块。
2.6 成纤维细胞的传代培养与生长曲线
3 种培养方法获得的成纤维细胞经过消化传代后进行培养,细胞贴壁生长,形态正常(见图5),增殖4~5 d后长满皿底。细胞生长曲线显示,细胞增殖正常(见图6)。

图5 成纤维细胞传代后进行培养

图6 成纤维细胞的增殖曲线
3 讨论
3.1 植块法培养成纤维细胞
利用组织块法培养成纤维细胞,是多种动物耳皮肤组织成纤维细胞较理想的培养方法,本试验采用这种方法成功获得民猪的耳皮肤组织成纤维细胞。利用组织块法培养成纤维细胞,不同的研究者报道生长出细胞的时间是不一致的,细胞长出时间与所用方法、培养条件、猪品种和年龄都有关系[5-8]。在培养成纤维细胞的过程中,通常还会有上皮细胞生长,除形态不同外,两种细胞对胰酶的敏感性不同,在消化过程中利用上皮细胞不容易消化的特性将成纤维细胞和上皮细胞分开,经过2~3次传代就能将上皮细胞完全剔除。
3.2 组织块的再利用
利用组织块培养成纤维细胞,当细胞长满皿底之后进行消化,通常只收集成纤维细胞,而对于组织块通常都丢弃了[9-10]。在本试验中,将组织块再次植块培养、进行冷冻后再植块培养,发现组织块再培养后仍然能长出细胞,而且长出细胞时间比新鲜组织块长出细胞时间提前1~2 d。可能的原因是,新鲜组织块离体后进行培养,需要一个对外部的环境适应的过程;而组织块再培养时组织块已经适应了环境,组织块内的成纤维细胞具备了在培养皿内不断分裂增殖的特性。利用组织块的再培养法可以在组织块数量有限的条件下获取大量细胞。然而对于组织块能够培养利用多少次、组织块内是否存在皮肤干细胞等问题还需要进一步确认。
3.3 细菌的污染
组织块法培养成纤维细胞面临的最大问题就是污染问题[3]。猪的耳组织表面经常和外界环境接触,尤其是畜舍环境较差时耳组织上会有很多污染源存在。在取样时如果擦洗、消毒不彻底,常常会导致下一步的细胞污染。前期试验污染较严重,后期要求饲养员采集样品时彻底擦洗猪耳表面的附着物,同时将PBS 清洗液中双抗的浓度提高到5%,运回实验室后刮干净表面的毛发再进行一次酒精消毒和清洗。经过这样的处理,组织块污染的情况几乎不会发生。另外组织块再培养过程中没有发生污染的情况,主要是因为前期经过处理和培养,组织块是无菌的,继续在无菌条件下培养就不会发生污染。因此,利用组织块的再培养不仅可以扩大细胞来源,还可以更好地避免细胞培养中的污染问题。
4 结论
本试验采用植块法培养了45头民猪耳缘组织的成纤维细胞,成功建立了一种组织块再培养成纤维细胞的培养方法。
