转氨酶固定化及其连续流催化合成(R)-1-(4-溴苯基)乙胺
2021-07-08张加强
张加强,陆 群,赵 昱
(1.西南交通大学 生命科学与工程学院,四川 成都 610031;2.云南省药用昆虫及蛛形类资源开发利用工程实验室,云南 大理 671000)
(R)-1-(4-溴苯基)乙胺是许多具有药物活性和生物活性化合物的重要合成中间体,例如可以用于合成新型广谱喹诺酮类抗菌药加雷沙星以及新型突变体B-Raf(V600E)强选择性激酶抑制剂[1-2]。转氨酶催化前手性酮的直接胺化为手性纯胺的合成提供了一个较优的选择[3],但水溶性的酶分子在苛刻的反应条件下稳定性和选择性较差,同时储存、回收和清除细胞碎片也相当困难[4-5]。连续流生物催化具有催化效率快、时空产率高,易于下游处理(便于分离)等优点[6],已成为绿色可持续工业化生产的重要研究领域。因此将酶固定在树脂载体上用于连续流催化合成(R)-1-(4-溴苯基)乙胺具有一定的研究价值。
1 实验部分
1.1 仪器与试药
LC-20AD型高效液相色谱仪、SPD-M20A检测器,日本岛津;CMax Plus酶标仪,美谷分子仪器;ES-1、ES-103B、ESR-2,天津南开和成;LX-1000EP、LX-1000HA,西安蓝晓;ReliZyemTMOD-403,日本三菱化工;ATA-117转氨酶由实验室构建并保藏;Bradford蛋白浓度测定试剂盒,生工生物工程;其他常规试剂均为市售分析纯。
1.2 实验方法
1.2.1 固定化载体的筛选
配制100 mmol/L、pH 8.0的磷酸盐缓冲液5 mL,加入0.5 g树脂载体和20 mg转氨酶,混合后置于30 ℃下搅拌24 h,过滤洗涤,加入50 mmol/L、pH 8.5的磷酸盐缓冲液5 mL(含3 mol/L甘氨酸),30 ℃下搅拌20 h,抽滤洗涤,得到固定化酶[7]。
1.2.2 酶蛋白质量浓度对转氨酶固定化的影响
配制100 mmol/L,pH 8.0的磷酸盐缓冲液,分别加入定量转氨酶冻干粉制成4,6,8,10,12,14 g/L的均一酶液。分别取2 mL酶液加入0.2 g ES-103B树脂,置于30 ℃下搅拌24 h。
1.2.3 缓冲液盐浓度对转氨酶固定化的影响
配制pH 8.0,浓度为100,200,500,800,1 000,1 500 mmol/L的磷酸盐缓冲液。分别取2 mL缓冲液加入0.02 g转氨酶冻干粉及0.2 g ES-103B环氧树脂载体,置于30 ℃下搅拌24 h。
1.2.4 缓冲液pH对转氨酶固定化的影响
配制浓度为500 mmol/L,pH为3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0的磷酸盐缓冲液。在2 mL缓冲液中加入0.02 g转氨酶冻干粉及0.2 g ES-103B环氧树脂载体,置于30 ℃下搅拌24 h。
1.2.5 固定化时间对转氨酶固定化的影响
配制浓度为500 mmol/L,pH为7.0的磷酸盐缓冲液,在2 mL磷酸盐缓冲液中加入0.02 g转氨酶冻干粉及0.2 g ES-103B树脂载体,置于30 ℃下搅拌,分别在0,2,4,6,8,12,18,24 h时取出,结束固定化过程。
1.2.6 最适反应pH
称取0.2 g固定化酶,分别加入pH为6.0,7.0,8.0,8.5,9.0,9.5,10的磷酸盐缓冲溶液(含20 mmol/L对溴苯乙酮,1 mol/L异丙胺,体积分数10%的DMSO)1 mL,置于45 ℃下反应1 h。
1.2.7 最适反应温度
称取0.2 g固定化酶,加入100 mmol/L,pH 9.0的磷酸钠缓冲液(含20 mmol/L对溴苯乙酮,1 mol/L异丙胺,10% DMSO)1 mL。在温度分别为30,40,50,60,70 ℃条件下反应1 h。
1.2.8 储存稳定性
将固定化酶ATA117@ES103B与游离酶ATA-117均加入100 mmol/L,pH 8.0的磷酸盐缓冲液中,放置于4 ℃冰箱保存,每隔2 h测定相应酶活。
1.2.9 重复批次操作稳定性
称取0.2 g固定化酶(ATA117@OD403,ATA117@ES103B),加入100 mmol/L,pH 9.0的磷酸盐缓冲液(含20 mmol/L对溴苯乙酮,1 mol/L异丙胺,10% DMSO)。置于45 ℃下反应1 h,液相检测产物浓度,再加入新的反应液进行重复批次实验。
1.2.10 连续流反应系统的建立
以内径5 mm,长度10 cm的填充柱作为反应场所,将固定化酶ATA117@ES103B填充于柱中,放置于50 ℃恒温箱中,通过注射泵以一定流速将反应液泵入反应器中,在出口处收集反应液,检测产物浓度。
1.2.11 酶活的测定方法
称取0.2 g固定化酶,加入1 mL反应液(100 mmol/L,pH 9.0,含20 mmol/L对溴苯乙酮,1 mol/L异丙胺,10% DMSO),置于45 ℃条件下反应1 h。将反应液用等量乙酸乙酯萃取后,加入10 mg K2CO3和5滴乙酸酐,400 r/min下搅拌反应1 h,再加入10 mol/L NaOH(200 μL)溶液,离心分离后液相测定产物浓度。
酶活定义:在45 ℃,pH 9.0条件下,每小时催化对溴苯乙酮生成1 μmol的1-(4-溴苯基)乙胺所需的酶量,即为1个酶活力单位,用U表示。
比酶活:1 g固定化酶(转氨酶冻干粉)所含有的酶活。
酶活回收率=(固定化酶酶活/初始酶液总酶活)×100%。
转化率=(目的产物的实际生成量/目的产物的理论生成量)×100%。
1.2.12 蛋白吸附率的测定方法
使用Bradford蛋白质定量试剂盒进行粗酶液初始蛋白浓度及固定后上清残余蛋白浓度的测定。
蛋白吸附率=[(初始蛋白浓度-上清残余蛋白浓度)/初始蛋白浓度]×100%。
1.2.13 色谱条件
色谱柱为CHIRAlCEl OJ柱;流动相为V(异丙醇)∶V(正己烷)=1∶9;流速为0.8 mL/min;检测波长为210 nm;柱温为40 ℃。
2 结果与讨论
2.1 固定化载体筛选
由于不同类型的树脂载体携带的官能团不同,使得酶蛋白和树脂之间的固定化方式存在差异,筛选结果如表1所示。
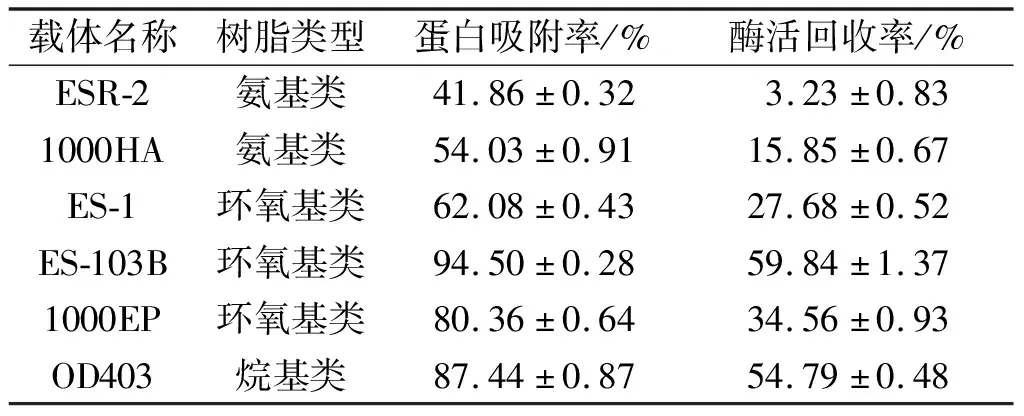
表1 树脂载体筛选结果一览表
氨基树脂和烷基树脂是借助分子间相互作用力将酶蛋白吸附在载体表面,酶分子很容易从载体表面脱落;而环氧树脂表面富含环氧基团,可以在常温下与酶蛋白氨基酸残基形成共价键,使酶蛋白共价连接在载体表面,大大提高了固定化酶的稳定性。由表1可知:环氧基树脂ES-103B蛋白结合能力最强,蛋白吸附率为94.50%,同时其所得固定化酶酶活回收率也最高,酶活回收率为59.84%。因此选用ES-103B环氧树脂作为最佳固定化载体。
2.2 固定化条件的优化
参照文献[8-9],对ATA-117固定于ES-103B的固定化条件进行了优化,包括酶蛋白质量浓度、缓冲液盐浓度、pH以及固定化时间,结果如图1所示。

图1 固定化条件的优化
固定化酶的比活随着酶质量浓度的增加而增加,在10 g/L时达到峰值,且蛋白吸附率基本保持不变,保持在90.13%~94.88%,蛋白几乎被完全吸附;而当酶液增加至12 g/L时,比活出现微微下降的趋势,同时蛋白吸附率也在减小。缓冲液盐离子浓度和pH对固定化的影响中,固定化酶活回收率及比酶活都呈现先升高再下降的趋势,在磷酸盐浓度500 mmol/L,pH 7.0时达到最大值。随着固定化反应时间的延长,固定化酶的酶活与蛋白吸附率呈现增长的趋势,在8 h时固定化酶达到最高酶活,此时蛋白吸附率为95.83%。故确定较优的酶固定化条件:m(载体)∶m(转氨酶)=10∶1,固定化时间8 h,缓冲液浓度500 mmol/L,pH 7.0,温度30 ℃。
2.3 固定化酶最适反应条件
对固定化酶ATA117@ES103B的最适反应条件进行了优化,也考察了其储存稳定性和重复批次操作稳定性,结果如图2所示。由图2(a)可知:游离酶ATA-117的最适pH为10,而固定化酶ATA117@ES103B的最适pH为9.5,即略向酸性偏移,这可能是因为酶蛋白经固定化后其所处微环境的电荷性质发生了改变而造成的影响。由图2(b)可知:在对ATA117@ES103B与游离酶ATA-117的稳定性比较实验中,发现游离酶随着存储时间的增加,酶活持续大幅度降低,在第10天时残余酶活为初始值的53.21%,在第15天时仅有27.43%的酶活残留;而ATA117@ES103B在前10 d左右酶活没有明显的损失,在存储15 d后,残余酶活为初始值的89.83%,展现了出色的存储稳定性。由图2(c)可知:温度对固定化酶活影响较大,故确定最适反应条件为:pH 9.5,温度50 ℃。由图2(d)可知:在ATA117固定于烷基树脂载体OD403和环氧基树脂载体ES103B的重复操作稳定性比较实验中,固定化酶ATA117@OD403在使用至第4次时,还保留了初始值的72.36%的活性,随后大幅度减小,当重复使用至10次时,残余酶活仅为7.62%;而ATA117@ES103B在重复使用至第4次时,保留有94.83%的残余酶活,当重复操作10次后,残余酶活为80.41%,具有良好的重复批次使用稳定性。

图2 固定化酶的最适反应条件
2.4 连续流反应条件的优化
对所建连续流反应器系统的反应条件进行优化,包括流向、流速以及填料量,结果如图3所示。由图3(a)可知:在保持其他条件相同的情况下,分别将反应液从上至下(下流系统)和从下至上(上流系统)泵入反应器,发现无论是在慢速(0.2 mL/min)、中速(0.5 mL/min)还是快速(1.0 mL/min)的流速条件下,下流系统中洗脱液的转化率均略高于上流系统。由图3(b)可知:反应转化率随着反应器中ATA117@ES103B用量的增加而升高,考虑到使反应转化率的最大化,故采用2.0 g的固定化酶使用量为最佳填料量。由图3(c)可知:降低流速能够增加底物与固定化酶的接触时间,使其充分反应从而提高转化率,然而流速为0.2~0.3 mL/min时,转化率并没有明显变化,因此确定流速为0.3 mL/min,反应转化率为93.43%。
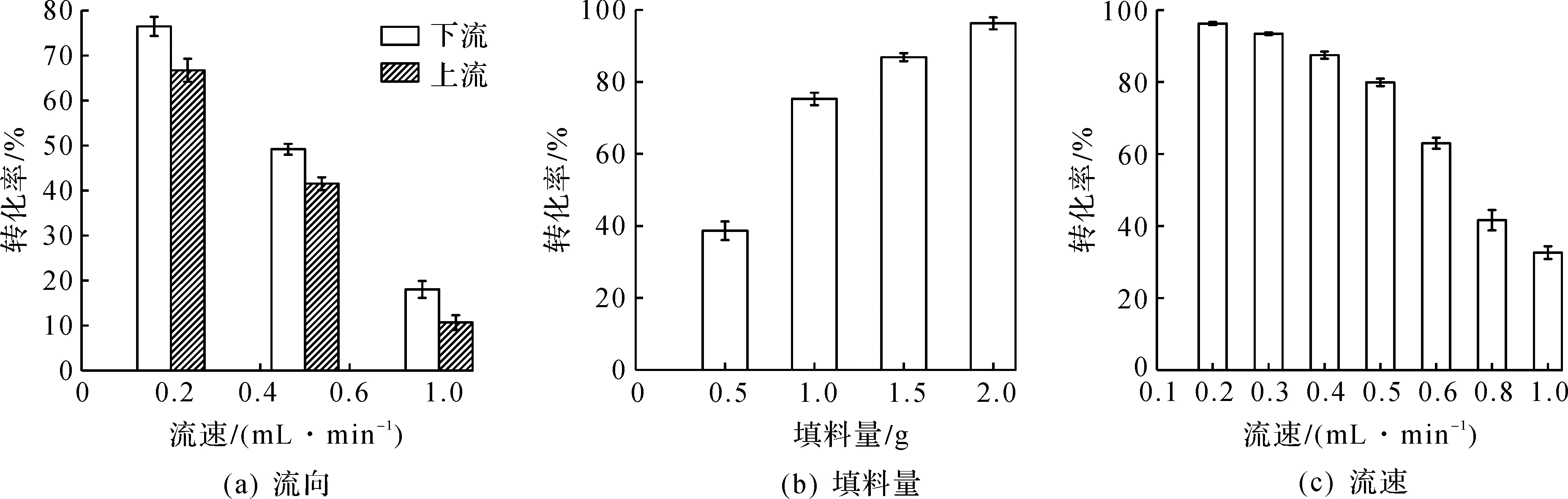
图3 连续流条件的优化
2.5 最优条件下连续流反应器的催化效力及其可持续性能
根据上述实验结果,将连续流生物催化反应的工艺条件调整为:固定化酶填料量为2.0 g,以0.3 mL/min的流速将反应液从上至下泵入反应柱中,柱温箱50 ℃。计算得反应器中具有催化能力的有效体积(即固定化酶总体积)约为1.96 mL,则反应液在反应器中的停留时间(即反应液在反应器中与固定化酶接触并发生反应的时间)约为6.54 min。分别在连续流催化模式与间歇反应模式下进行(R)-1-(4-溴苯基)乙胺的不对称合成,将反应结果进行对比,如表2所示。在连续流操作的最佳条件下,20 mmol/L的对溴苯乙酮在不到7 min的停留时间内转化率即可达到93%,催化效率为2.804 μmol/(min·g),比相应的间歇反应高出7倍,计算时空产率为789.85 g/(L·d)。

表2 间歇反应与连续流反应合成(R)-1-(4-溴苯基)乙胺
3 结 论
对6种不同类型的树脂载体进行筛选,确定ES-103B环氧树脂作为最佳固定化酶载体。通过单因素优化确定了较优的ATA-117转氨酶固定化条件、所得固定化酶ATA117@ES103B的最适反应温度和pH。构建连续流反应系统,对连续流反应条件进行优化,确定最佳反应条件是:固定化酶填料量2.0 g,流速0.3 mL/min,反应液从上至下泵入反应器。该研究使得在连续流反应系统中不对称合成(R)-1-(4-溴苯基)乙胺成为可能,理论上该系统可应用于其他更多重要药物中间体的合成,具有一定的应用价值。
