巨细胞病毒UL144对SD幼鼠肝细胞损害的分子机制
2021-07-07温正旺陈益平任迪索胡玲珑石海矾陈洁
温正旺陈益平任迪索胡玲珑石海矾陈洁
1温州医科大学附属第二医院育英儿童医院儿童感染科,浙江温州325000;2温州医科大学仁济学院,浙江温州325000
人巨细胞病毒(HCMV)是引起婴幼儿肝炎常见的病原体[1]。HCMV肝炎占婴幼儿肝炎综合征的30%~40%,临床表现多样(无症状感染、胆汁淤积肝炎甚至胆道闭锁),尤其是亚临床型肝炎最为常见,严重危害婴幼儿的健康及生长发育。人群普遍感染HCMV,其特异性IgG抗体阳性率可高达90%。国内流行病学调查发现,婴幼儿HCMV-IgG抗体阳性率高达70%~90%[2]。HCMV感染临床表现差异巨大,考虑与基因相关,HCMV中含有数百个基因型,其中UL144基因型与HCMV的毒力密切相关,在部分HCMV感染肝功能正常患儿体内表达阴性,是导致婴幼儿HCMV肝炎的潜在重要因素,但其具体的病理、生理机制尚不明确。近期本课题组临床研究证实婴幼儿HCMV肝炎与caspase系列蛋白介导的细胞信号凋亡通路密切相关[3]。本文通过建立动物模型,并检测各组中UL144 RNA,caspase-8、caspase-12及Toll样受体4(TLR4)的蛋白和肝脏细胞的凋亡情况,探索UL144在HCMV感染肝脏损伤中的内在分子机制。
材料与方法
一、动物及分组
取体重为80~100 g健康雄性SD幼鼠 (3~4周龄)24只,均由温州医学院试验动物中心提供,合格证号为[SYXK(浙)2016-0061]。按随机数字表法分为空白组、空载组和实验组3组,每组各8只。空白组不作特别处理;空载组尾静脉注入100μL的空载腺病毒;将344μL病毒原液用0.9%生理盐水稀释成1.2 mL,然后每只尾静脉注入100 mL UL144,滴度为2.0×1012,建立UL144动物模型,建立后饲养1周,使药物效果稳定。
二、主要试剂
原位缺口末端标记(TUNEL)试剂盒(罗氏公司);鼠浓缩型免疫组化试剂盒 (北京中杉金桥公司);RT-PCR试剂盒 (Fermentas公司);Trizol抽提试剂(北京普利莱基因技术有限公司),幼鼠UL144基因AAV9型号:200μL*5(唯真生物科技有限公司)。
三、研究方法
1.取材
实验结束次日,SD幼鼠迅速断头处死,取出肝脏右叶,生理盐水将血液冲洗干净,每组共得8个肝脏右叶样本,每组1~4号用4%多聚甲醛固定12 h后,石蜡包埋,分别连续切片,待测HE、TUNEL;其余均置液氮保存,每组5~8号用于RT-PCR法检测UL144 RNA,ELISA检 测caspase-8、caspase-12和TLR4的蛋白表达。
2.肝脏右叶细胞HE染色和凋亡检测
采用HE染色观察肝脏右叶细胞病理改变;采用TUNEL法,按试剂盒提供方法操作。镜检细胞核中绿色荧光者为凋亡细胞,随机计算5个高倍视野(×400)下的凋亡细胞数。凋亡指数(AI)以凋亡细胞/100个细胞(%)表示。
3.RT-PCR法测定SD幼鼠UL144 RNA的表达
按照Trizol提取试剂说明书抽提RNA,并测定RNA浓度,按RNA逆转录试剂盒(Fermentas公司)说明书进行逆转录,按实时荧光定量PCR操作要求在96孔中加入引物 (由上海基康生物工程有限公司合成)、SYBR GreenⅠ、模板、水总体积为20μL,混匀后在罗氏LightCycler480进行实时定量PCR分析,用Lightcycler480 15.0软件处理实验结果。
4.ELISA方法检测肝脏组织中caspase-8、caspase-12及TLR4的表达水平
ELISA试剂盒为美国PeproTech公司制造;抗caspase-8、caspase-12及TLR4抗体由Abcom公司生产。caspase-8、caspase-12及TLR4的酶联免疫试剂盒室温下放置30 min,每孔加50μL匀浆或标准样品,留两孔空白对照;薄膜盖住微孔板,孵育2 h;洗板4次,将酶标板反转,将洗涤液轻甩干;每孔加50μL抗caspase-8、caspase-12及TLR4抗体并封板,孵育2 h;洗板4次,酶标板反转,洗涤液彻底甩干;每孔先后滴入显色剂A及B,遮光下常温静置30 min;滴终止液100μL,在450 nm处检测吸光度值(OD);以标准品浓度为横坐标,OD值为纵坐标,绘制标准曲线,根据OD值计算其浓度。
四、统计学方法
本研究采用SPSS18.0软件进行统计处理。各组呈正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,计数资料应用χ2检验,P<0.05为差异具有统计学意义。
结 果
一、HE染色
光镜下形态学变化:实验组肝脏细胞出现变性,细胞核浓缩,深染增加,空白组和空载组基本正常(详见图1)。
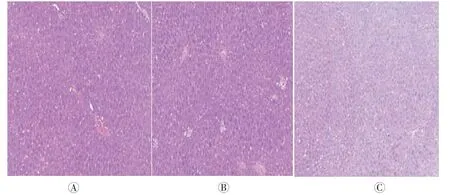
图1 三组幼鼠肝脏的HE染色(HE染色,×100)
二、肝细胞凋亡情况
图2可见,各组间幼鼠离体肝组织细胞凋亡差异均有统计学意义(F=158.427,P<0.05);实验组肝细胞的凋亡指数为7.68±0.37,明显高于空载组的2.26±0.24及空白组的2.38±0.16(P<0.05),空白组和空载组两者之间差异无统计学意义(P>0.05)。
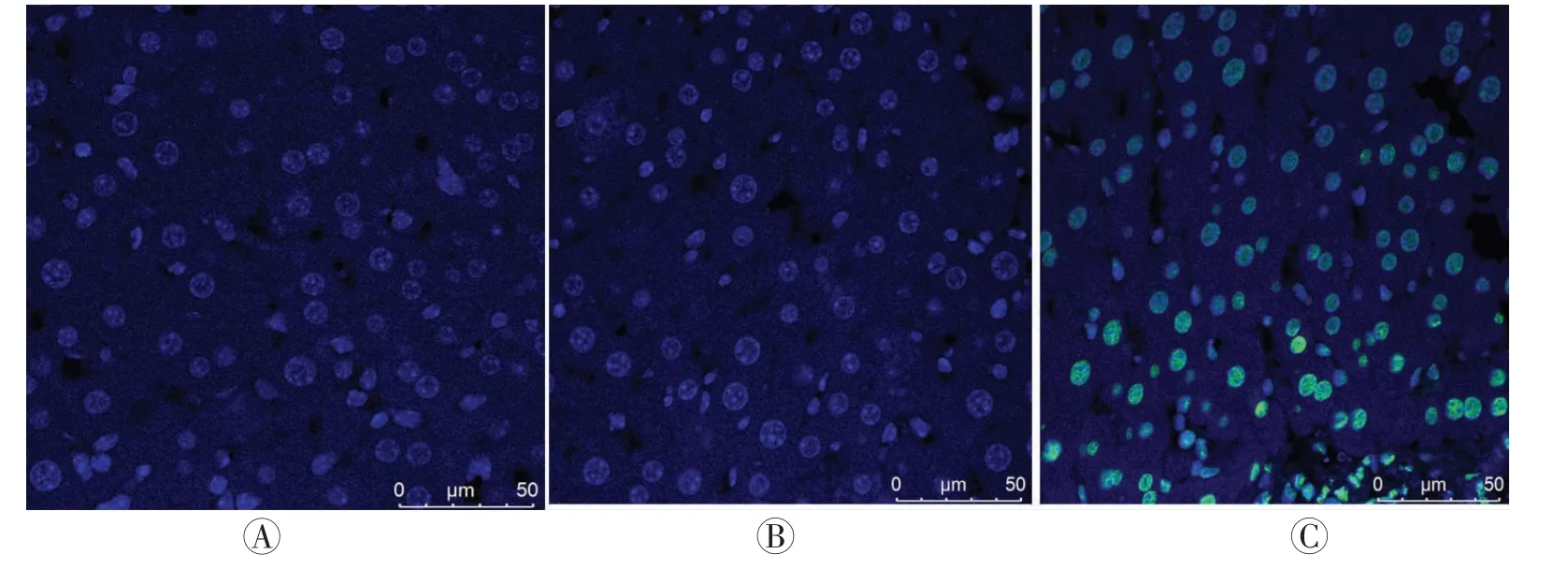
图2 三组幼鼠肝脏的TUNEL检测结果(TUNEL法和DAPI核染检测,×400)
三、 肝 脏 组 织 UL144、caspase-8、TLR4 和caspase-12的表达量
表1可见,三组间幼鼠肝脏内的UL144 RNA、caspase-8和TLR4蛋白表达量的差异有统计学意义(F=156.166、97.287和67.624,P均<0.05),其中实验组的表达量分别为1.823±0.080、0.305±0.004和0.880±0.068,高于空载组及对照组(P均<0.05);空载组的表达量分别为1.000±0.040、0.104±0.003和0.308±0.004,均高于空白组(P均<0.05)。 三组间幼鼠肝脏组织中caspase-12蛋白表达差异无统计学意义(F=2.156,P>0.05)。
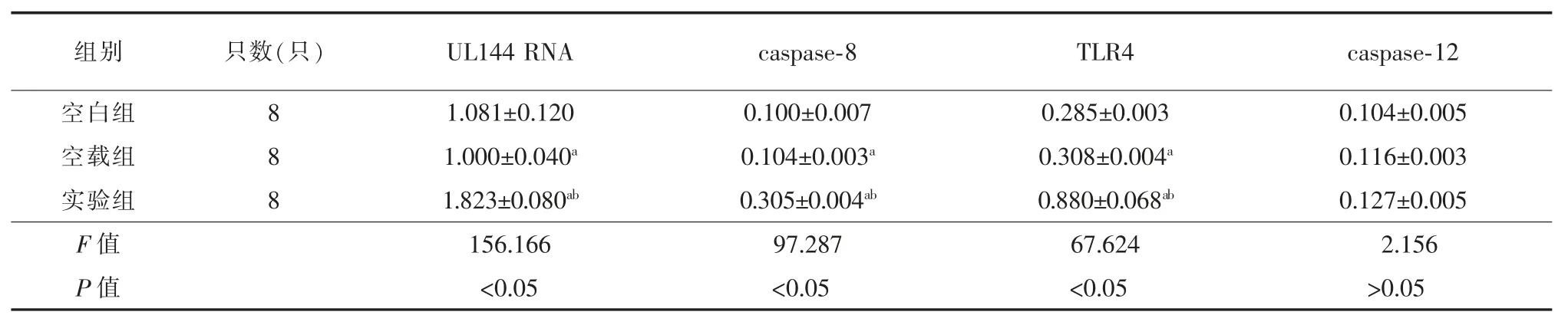
表1 各组幼鼠肝脏组织UL144 RNA、caspase-8、TLR4、caspase-12表达量的比较
讨 论
HCMV是一种广泛分布的机会致病性病毒,具有潜伏性感染特点。HCMV含有免疫逃避基因,可干扰宿主自身的细胞因子系统,影响APC的抗原提呈功能。HCMV感染易引起机体宿主细胞凋亡,而HCMV具有许多抗凋亡的机制和CTL杀伤机制,使感染细胞长期存活[4]。上述方式相互作用使病毒感染后处于静息平衡状态,当机体免疫功能低下时,病毒大量复制发生显性感染。临床发现,当HCMV感染时,一部分表现为亚临床型肝炎、黄疸型肝炎、无黄疸型肝炎、胆汁淤积性肝炎和胆汁淤积症,大部分仅提示存在HCMV感染[5];HCMV感染临床症状差异巨大,原因是HCMV中存在与病毒毒力相关的亲嗜性基因,而亲嗜性基因如何诱导肝细胞损伤目前尚未完全明确。
早期研究发现,巨细胞病毒ULβ区基因与巨细胞病毒的毒力和感染力相关,但UL144和UL146作用最明显,如何相关目前尚未明确[6]。本研究中发现当给予幼鼠腹腔注射,HCMV UL144蛋白时,SD幼鼠肝脏细胞HE染色提示出现不同程度的变性,TUNEL法检测出现不同程度的凋亡,提示HCMV UL144基因片段可以导致幼鼠肝细胞损伤乃至凋亡。先前的研究提示,HCMV感染导致肝功能损伤与caspase系列蛋白密切相关,caspase系列蛋白成分复杂,介导的信号通路很多,例如caspase-9参与介导的线粒体途径诱导的细胞凋亡,caspase-8参与传递的细胞外信号凋亡通路,caspase-12参与诱导的内质网应激细胞凋亡信号通路[7]。研究提示,HCMV感染可激活内质网应激信号通路,内质网应激信号通路的激活参与了HCMV感染肝功能的损伤[8]。本实验发现,UL144蛋白进入SD幼鼠体内导致肝细胞的损伤乃至凋亡,但是caspase系列蛋白中介导内质网应激信号通路激活的caspase-12的表达与空白组的比较无明显差异,提示它与HCMV UL144的感染力与毒力之间不存在相关性,但不能认定UL144与内质网应激之间无相关性。本研究还发现,实验组的caspase-8明显高于另外两组,差异具有统计学意义,且caspase-8是caspase系类蛋白中直接参与细胞凋亡的,UL144可能通过激活caspase-8效应分子诱导肝细胞凋亡。有研究揭示,HCMV感染诱导细胞凋亡的整个过程中,细胞内TLR家族蛋白作为炎症启动器起到重要作用,尤其是TLR4,研究发现TLR4主要通过caspase系列蛋白酶的激活起作用[9]。本研究中显示,相较于其他两组,实验组的TLR4表达明显升高,提示在病毒感染后,TLR4被激活,介导的caspase-8效应分子参与了HCMV感染导致肝细胞损伤乃至凋亡的病理生理过程。
综上所述,关于HCMV感染导致肝脏损伤,传统的一些靶点已经满足不了临床的需要,亟需寻找确实可行的研究方向及靶点。本研究从基因片段入手,将炎症启动因子TLR4以及凋亡效应分子caspase-8引入HCMV感染导致肝功能损伤的研究中,并确实发现HCMV UL144感染后幼鼠体内TLR4和caspase-8表达出现明显上升,提示UL144可能通过激活TLR4并介导caspase-8参与了HCMV感染肝细胞损伤的病理生理过程,将为HCMV感染肝损伤提供一个全新的靶点及理论依据。但是本文在小鼠体内注入UL144后虽然发现体内一些与细胞凋亡相关的细胞因子表达出现显著变化,但未通过抑制剂对TLR4与caspase-8之间的相关性进行深入研究,将在今后予以观察。
利益冲突所有作者均声明不存在利益冲突
