培养滤液MPT64抗原检测阴性结核分枝杆菌的基因多态性分析
2021-07-07赵国连谈小文崔晓利党丽云
赵国连 谈小文 崔晓利 党丽云
目前,一些分子生物学检测技术可以很容易实现对结核分枝杆菌(Mycobacteriumtuberculosis,MTB)和非结核分枝杆菌(non-tuberculous mycobacteria,NTM)的鉴别。但这些技术对基础设施和操作人员的熟练程度有较高要求[1]。因此,快速、敏感、简便的MTB鉴定方法对结核病的准确诊断和正确治疗至关重要。MPT64抗原检测的胶体金免疫层析法可用于BACTEC MGIT 960液体培养(简称“MGIT 960液体培养”)阳性分枝杆菌菌种的快速鉴定,价格便宜、方便使用、15 min内可获得结果[2],在德国、日本和南非等地的研究中均表现出较高的诊断效能[3]。然而,也有研究显示,MPT64抗原检测在MTB鉴别中存在一定量的假阴性结果,认为可能与MTB的MPT64基因多态性相关[4-5]。因此,笔者通过基因测序比对,分析MPT64抗原检测假阴性MTB的基因多态性,以期获得MPT64抗原检测假阴性结果产生的原因。
资料和方法
一、菌株来源
收集2018年1月至2020年6月就诊于西安市胸科医院行痰液、支气管肺泡灌洗液、胸腹腔积液等标本分枝杆菌MGIT 960液体培养的疑似肺结核患者资料,选取培养阳性且经分枝杆菌萋-尼抗酸染色镜检确认为阳性,并有MPT64抗原检测(胶体金免疫层析法)、对硝基苯甲酸/噻吩-2-羧酸肼(PNB/TCH)生长试验和分枝杆菌菌种鉴定(DNA微阵列芯片法)结果的1962例患者分枝杆菌临床分离株作为研究对象。对其中MPT64抗原检测与分枝杆菌菌种鉴定结果不一致的菌株(本院研究室保存)行GeneXpert MTB/RIF(简称“GeneXpert”)和PNB培养检测,并对MPT64抗原检测阴性但菌种鉴定结果为MTB的14株菌株进行MPT64基因测序。
二、研究方法
1.MGIT 960液体培养:收集标本行液化去污处理[6],将0.5 ml处理后标本接种于MGIT 960分枝杆菌生长指示管中,充分混匀,室温静置30 min。于37 ℃在MGIT 960系统中孵育,最长42 d,并定期监控。培养阳性标本经分枝杆菌萋-尼抗酸染色镜检确认。
2.MPT64抗原检测(胶体金免疫层析法):将MGIT 960液体培养阳性且分枝杆菌萋-尼抗酸染色镜检确认阳性的标本按照MPT64抗原检测试剂盒(杭州创新生物检控技术有限公司生产)说明书进行操作。对MPT64抗原检测阴性的菌株,14 d后再次行MPT64抗原检测。
3.PNB/TCH培养基生长试验:采用微孔板肉汤(PNB)培养基(珠海银科医学工程股份有限公司)按照试剂说明书进行操作,培养7~10 d后观察菌株生长情况,有细菌生长时可初步鉴定为NTM。
4.分枝杆菌菌种鉴定:同时将MGIT 960液体培养阳性且经分枝杆菌萋-尼抗酸染色镜检确认阳性的标本应用DNA微阵列芯片法试剂盒(北京博奥晶典生物技术有限公司)进行分枝杆菌菌种鉴定。严格按照说明书操作。将提取的核酸模板2 μl加入18 μl扩增反应液,扩增反应结束后将6 μl的扩增产物与9 μl杂交缓冲液混合。经95 ℃ 5 min变性后与芯片进行杂交。在50 ℃恒温水浴锅中杂交2 h后进行洗涤、扫描。参照试剂盒说明书进行结果判读:当探针信号值大于参考值时判读为阳性,否则为阴性。将所有探针信号值排序,获取最大探针信号值。若最大信号值为阴性,则报告“无分枝杆菌”;若只有1条探针为阳性结果,则表示待测样本为该探针所对应的分枝杆菌菌种或菌群;若1条以上探针为阳性结果,则通过探针组合情况来确定待测样本所对应的分枝杆菌菌种或菌群。
5. GeneXpert检测:对MPT64抗原检测与分枝杆菌菌种鉴定结果不一致的菌株行GeneXpert检测。按照试剂盒说明书进行操作。当GeneXpert检测结果为阳性时,鉴定为MTB。
6.MPT64基因测序:将MPT64抗原检测阴性而菌种鉴定结果为MTB的菌株及H37Rv对照菌株(来源于2019年中国疾病预防控制中心下发的熟练度测试菌株)及MPT64抗原检测阳性的MTB临床分离株各1株)所提取的DNA,依据之前报道的MPT64引物(正向:5′-TCGATCTGCTAGCTTGAGTCTGGT-3′;反向:5′-ACCACCGCACCAA GGCTGTCTA-3′)[7]进行基因扩增。扩增程序为95 ℃ 3 min预变性,95 ℃ 45 s变性,62 ℃ 45 s退火,72 ℃ 70 s延伸,共40个循环。扩增产物经1%琼脂糖凝胶电泳确认并送生物工程(上海)有限公司测序。测序结果与H37Rv菌株在BioEdit软件上使用Cluster W多序列比对,并标记发生突变的核苷酸序列。
三、统计学处理
采用SPSS 19.0软件进行数据分析。计数资料采用“构成比或百分率(%)”表示。以基因芯片检测为参考标准,评价MPT64抗原检测MTB的诊断效能,各指标计算公式如下:敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致率=(真阳性例数+真阴性例数)/总例数×100%。各方法间的一致性检验采用Kappa检验,Kappa值≥0.75说明一致性较好;0.4≤Kappa值<0.75说明一致性一般;Kappa值<0.4说明一致性较差。
结 果
一、MPT64抗原检测情况
1962株菌株的DNA微阵列芯片法菌种鉴定结果与培养后细菌PNB/TCH生长试验结果一致,其中88株(4.5%)为NTM,1874株(95.5%)为MTB。88株NTM菌株中,MPT64抗原检测阴性菌株87株(98.9%),1株阳性菌株经GeneXpert和PNB培养鉴定为MTB与NTM混合感染,但因NTM生长较快而在培养物中成为优势菌。1874株MTB菌株中,MPT64抗原检测阴性14株(0.7%),阳性1860株(99.3%)。对于分枝杆菌MGIT 960液体培养阳性标本,以DNA微阵列芯片法检测结果为参照标准,MPT64抗原检测对MTB的检测效能见表1。
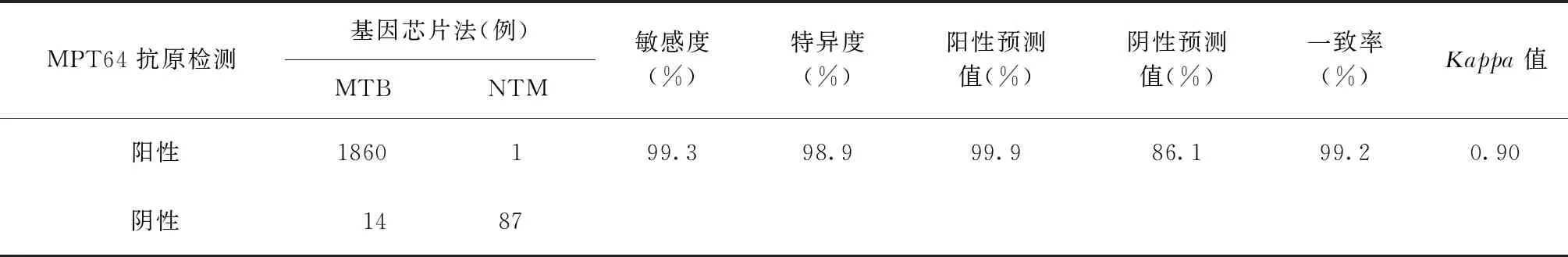
表1 MPT64抗原检测以DNA微阵列芯片法为参照方法鉴定分枝杆菌菌种的结果
二、MPT64基因扩增产物琼脂糖凝胶电泳结果
对MPT64抗原检测阴性的14株MTB临床分离株(1~14号)和1株H37Rv标准菌株(15号)及MPT64抗原检测阳性的1株MTB临床分离株(16号)的MPT64蛋白基因扩增后行1%琼脂糖凝胶电泳,结果见图1。与H37Rv标准菌株相比,3号标本有大约1300 bp的大片段插入,而其他MPT64抗原检测阴性标本有小片段缺失。16号MPT64抗原检测阳性MTB菌株与H37Rv菌株无肉眼可见差异。
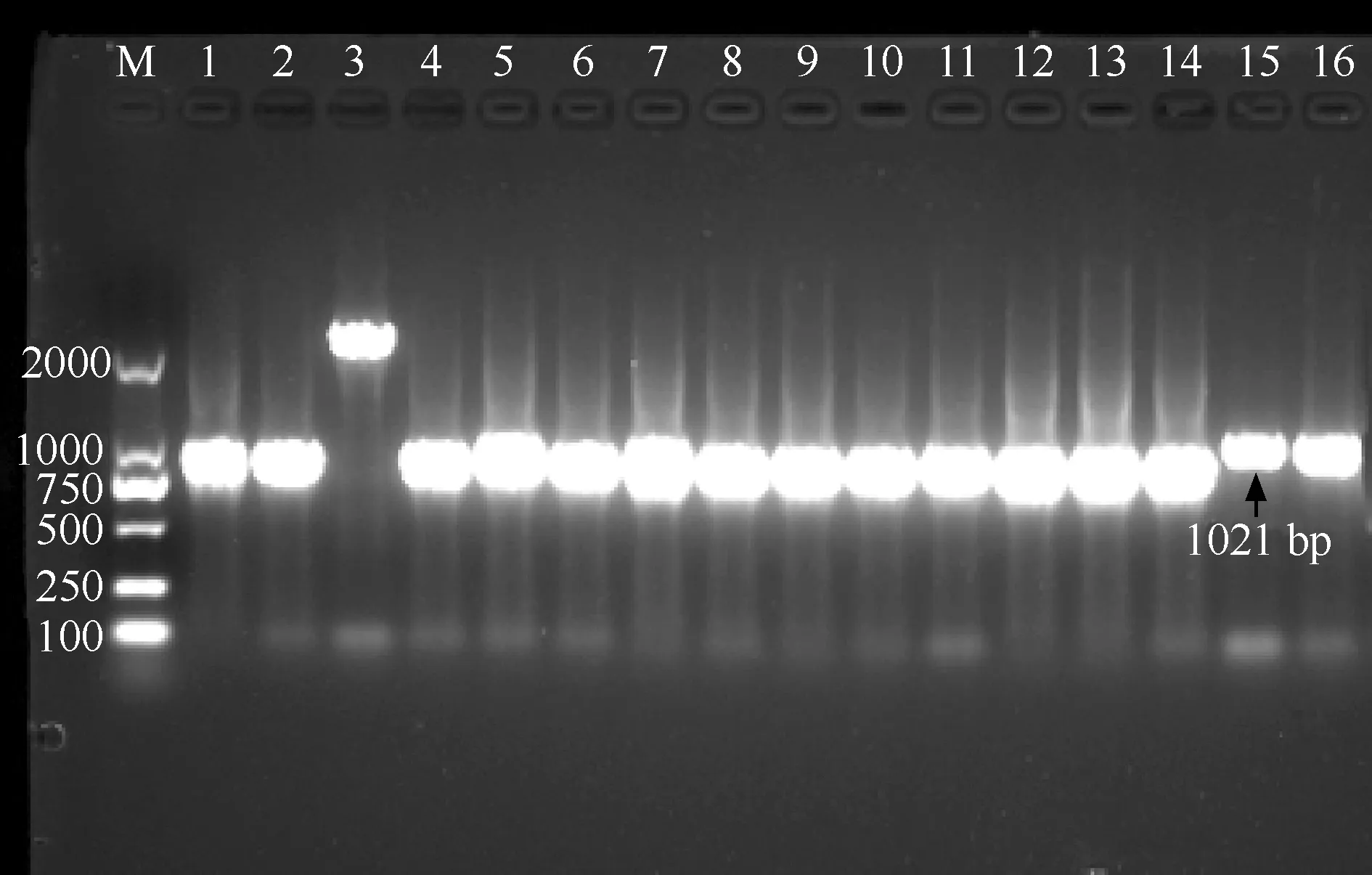
注 M:DNA相对分子质量Marker 2000 bp;1~14号泳道为MPT64抗原检测阴性的结核分枝杆菌MPT64基因条带,15号泳道为H37Rv标准菌株MPT64基因条带,16号泳道为MPT64抗原检测阳性结核分枝杆菌临床分离株MPT64基因条带
三、MPT64基因测序结果
对14株MPT64抗原检测阴性的MTB临床分离株、1株H37Rv标准菌株、1株MPT64抗原检测阳性的MTB临床分离株进行MPT64基因测序。结果显示,14株MPT64抗原检测阴性的MTB临床分离株发生MPT64基因第197~259位核苷酸缺失突变,导致第66~86位氨基酸缺失者达92.9%(13/14);另1株(3号泳道)MPT64蛋白基因在第587位点插入了1361 bp的IS6110基因片段。而MPT64抗原检测阳性的MTB临床分离株与H37Rv标准菌株基因一致,未发生MPT64基因的突变。具体见表2。
讨 论
MPT64抗原检测是使用小鼠单克隆抗MPT64抗体检测MTB菌株MPT64分泌蛋白的方法。MPT64分泌蛋白是由RD2区域基因编码的主要滤液蛋白(相对分子质量24 000),能够在培养早中期分泌并释放于MTB菌体外。故MPT64抗原检测的胶体金免疫层析法可以在短时间内实现对MGIT 960液体培养阳性分枝杆菌菌株的快速鉴定,有效区分MTB和NTM。既往有学者采用MTB抗原胶体金法检测853株分枝杆菌临床分离株,以PNB/TCH传统菌种鉴定方法为参照标准,其敏感度、特异度、阳性预测值、阴性预测值分别为99.0%、98.9%、99.9%、91.8%[8]。然而,也有研究报道了MPT64抗原检测存在假阴性的结果[4-5,7,9],这可能与培养液中细菌生长数量不足有关,但更多的报道认为与MPT64基因多态性相关[5,9]。
本研究显示,对于分枝杆菌MGIT 960液体培养阳性标本,以DNA微阵列基因芯片法检测结果为参照标准,MPT64抗原检测MTB的阳性预测值达99.9%,可认为以MPT64抗原检测阳性为确定分离培养物为MTB的方法具有较高的可靠性。同时,笔者对1874株MTB菌株行MPT64抗原检测,共检出14株(0.7%)阴性菌株,低于各地报道的占比(1.4%~6.8%)[5,10-11],可能与不同国家与地区流行的结核分枝杆菌复合群(MTBC)谱系间的差异有关[12]。故认为当 MGIT 960液体培养阳性标本经MPT64抗原检测为阴性时,应进一步采用其他菌种鉴定方法,以避免误诊和漏诊。
本研究对14株MPT64抗原检测阴性的MTB行MPT64基因扩增测序,发现13株(92.9%)发生了MPT64基因第197~259位点的63 bp核苷酸缺失突变,导致第66~86位氨基酸的缺失,与易松林等[13]对2017年湖南省85株MPT抗原阴性的临床分离株进行测序,有81株(95.3%)MPT64基因存在63 bp碱基缺失突变的研究结论相近。提示MPT64基因突变可能存在地域聚集性,但也可能存在多种单个位点突变或者单个碱基插入的情况。Jiang等[14]模拟分析了这些63 bp缺失的MPT64基因蛋白三级结构,结果显示突变蛋白存在α螺旋缺陷,相邻β片段卷曲程度增加,可能是发生整体拓扑结构变化的原因。此外,易松林等[13]研究还发现MPT64单位点非同义突变也会导致MPT64抗原检测阴性,例如402位G→A突变,613与614位间插入碱基等。Chew等[15]对2012—2016年分离于新加坡的8株MPT64抗原检测阴性的MTB菌株进行分析,结果显示,6株存在MPT64基因63 bp碱基缺失突变,1株在第347位点插入2 bp碱基导致移码突变,1株在第257位点发生非同义突变。2019年,Singh等[16]对印度10株MPT64抗原检测阴性的MTB菌株进行测序,结果显示,4株发生MPT64基因第26位G缺失突变,4株发生第37位C缺失突变,说明这两种缺失突变均可导致氨基酸移码突变,是编码蛋白多样性的原因。综上,不同地区的MPT64蛋白基因多态性存在一定差异,但63 bp 碱基缺失突变是我国境内报道的MPT64抗原检测阴性的主要原因。
本研究报道了中国第1株因MPT64基因第587位点插入IS6110基因片段而导致MPT64抗原检测阴性的MTB菌株,虽与Hillemann等[17]在2005年德国报道的1株因MPT64蛋白基因第177位点插入IS6110的多拷贝而导致MPT64蛋白序列中断的IS6110插入位置不一致,但这两种位点IS6110插入均导致了MPT64蛋白的变化,可认为是MPT64抗原检测阴性的原因。
综上,MPT64抗原检测操作简单、时效性强、敏感度高,可用于培养阳性MTB与NTM的快速鉴定。MPT64蛋白基因第197~259位点的63 bp核苷酸缺失突变及IS6110插入突变是本研究MPT64检测阴性的主要原因。但由于MPT64抗原检测阴性不能完全排除结核病诊断,仍需使用其他鉴定方法复核。另外,本研究为单中心研究,获得的样本数量较少,代表性欠佳。此外,对于MPT64检测阳性MTB菌株是否存在MPT64基因的同义突变、单位点插入也有待进一步研究。
