CuO NPs对大豆根尖细胞壁及果胶合成相关基因表达的影响
2021-07-07刘猜辛华
刘猜,辛华
(青岛农业大学生命科学学院,山东青岛 266109)
植物细胞壁以多种方式发挥作用,例如,为细胞提供结构支持、抵抗病原体并促进细胞之间的通讯。细胞壁的主要成分是多糖,包括纤维素、半纤维素和果胶等。纤维素和半纤维素被认为可以提供壁的拉伸强度,而果胶主要参与细胞与细胞的黏附并确定壁的孔隙度[1]。果胶存在于所有细胞中,不仅位于初生壁,而且构成中间层。果胶在初生壁中的含量高达30%[2-3],对维持细胞壁稳定和抗压能力有一定的作用,也是植物应对病原体侵害的重要屏障。在细胞壁的多种组成成分中,果胶是细胞壁中最复杂的一种。对两个品种的玉米(Zeamays)根细胞壁进行傅立叶红外光谱(Fourier Transform Infrared,FTIR)检测,官能团分析发现,吸附铅(Pb)后细胞壁的部分官能团的位置发生了明显的变化[4]。高浓度镉(Cd)会抑制旱柳(Salixmatsudana)茎和根的生长,根系是Cd积累的主要部位,Cd积累的量与根系细胞壁多糖的含量和结构密切相关,其中果胶含量显著增加[5]。另有研究表明,氧化镧纳米颗粒(La2O3NPs)(>100 mg/L)暴露显著抑制萝卜(Raphanussativus)细胞壁的果胶合成[6]。
果胶由4个主要的多糖结构域组成:同型半乳糖醛酸聚糖(HG),鼠李糖半乳糖醛酸聚糖I(RGI),鼠李糖半乳糖醛酸聚糖II(RGII)和木糖半乳糖醛酸聚糖(XGA)。其中主要成分是HG,约占果胶总量的65%[7]。果胶在高尔基体中合成,高尔基体膜上的糖基转移酶(GTs)将核糖上的糖基转移到寡糖或多糖受体上,并以高度甲基酯化的形式转运至细胞壁[8-11]。Zheng等[12]在拟南芥(Arabidopsisthaliana)中过表达棉花(Gossypiumhirsutum)GhGATL2、GhGATL9、GhGATL12、GhGATL15基因和沉默GhGATL15(VIGS)基因,对果胶含量测试表明,果胶在转基因品系中显著增加,而在VIGS植物中则降低,表明GhGATL基因参与果胶合成。GAUT4沉默的番茄(Lycopersiconesculentum)植株显示出果胶的成分发生了变化,果胶的含量降低[13]。拟南芥的3个AtGATL基因(atgatl3、atgatl6和atgatl9)中携带T-DNA插入的植物在其茎细胞壁中的半乳糖醛酸含量减少[14]。
氧化铜纳米颗粒(CuO NPs)是一种新型的功能材料,已越来越广泛地应用于气体传感器[15]、木材防腐[16]、船舶防污、塑料和金属涂料[17],减少摩擦的抗磨添加剂[18]和抗菌剂[19]。随着CuO NPs使用量的增加,其不可避免的会进入到环境中,关于CuO NPs所具有的潜在生态毒性与环境风险也正逐渐成为研究热点。迄今为止,关于逆境中植物细胞壁的反应主要集中在重金属和盐胁迫的研究方面,关于纳米材料的报道很少。本研究以大豆(Glycinemax)种子为试验材料,水培生根,探讨CuO NPs对大豆根细胞壁及果胶的影响,同时对果胶合成相关基因进行表达分析,旨在为植物细胞壁及果胶的防御机制提供进一步的依据。
1 材料与方法
1.1 供试材料
CuO NPs购自Sigma-Aldrich公司,CuO NPs基本上呈椭圆形,粒径约为40 nm[20]。分别称取2、5和10 mg 的CuO NPs,加入1L蒸馏水,超声震荡(100 W,40 kHz)30 min,配制成悬浮液。
冲洗大豆种子,然后将其浸泡在蒸馏水中。种子膨胀后,将它们放入小框子中,并用纱布覆盖,以保持种子湿润发芽。种子发芽后,将它们放在带孔的小篮子里(直径约0.5 cm),主根将通过孔伸入装有蒸馏水的塑料盆中。当根长约为2 cm时,分别用不同浓度(2、5、10 mg/L)的CuO NPs处理24 h和48 h。对照组用蒸馏水处理。每天每个处理搅拌3次,以防止颗粒聚集和沉淀。
1.2 超薄切片
分别取蒸馏水和5 mg/L CuO NPs处理48 h后的大豆根尖分生区,多聚甲醛-戊二醛固定液固定后,锇酸二次固定,系列丙酮溶液脱水,不同比例丙酮-树脂逐步渗透包埋。包埋块用Leica超薄切片机切片(厚度80 nm),切片用醋酸铀-柠檬酸铅染色后,用透射电子显微镜(日立HT7700)观察,并拍照。
1.3 细胞壁的提取
取3 g不同CuO NPs处理浓度(0、5 mg/L)的新鲜根,加液氮研磨成粉末状,转入50 mL离心管中,加入30 mL 75%乙醇浸没混匀,冰浴20 min,8 000 r/min离心15 min,重复提取3次。弃上清,再加入30 mL甲醇∶三氯甲烷(V/V)=1∶1溶液提取1次,冰浴20 min后离心。弃上清后加入30 mL丙酮提取1次,冰浴20 min后离心,弃上清。得到的沉淀即为细胞壁,冷冻干燥后备用。
1.4 FTIR红外光谱
将对照和5 mg/L CuO NPs处理48 h根的1 mg细胞壁干燥样品与100 mg溴化钾混合研磨压片,在4 000~400 cm-1区间进行傅立叶红外光谱仪(FTIR Spectrometer)扫描,观察谱峰情况。
1.5 果胶的提取
称取干燥的细胞壁25 mg,加入5 mL 0.5%草酸铵缓冲液(含0.1%的NaHB4),沸水浴1 h,6 000 r/min离心10 min,收集上清,重复3次,上清即为果胶。将所得上清用MSC050超滤杯、5 000 D超滤膜进行超滤浓缩[21]。
1.6 高效液相色谱
D- (+) -半乳糖醛酸(D-Galacturonic acid)、L- (+) -鼠李糖(L-rhamnose monohydrate)、甘露糖(D-Mannose)和半乳糖(Galactose)购自索莱宝公司;甲醇、乙腈、磷酸氢二钠、磷酸二氢钠均为色谱纯,其他试剂均为分析纯。
分别取4种单糖各5 mg、多糖样品1~2 mg于旋口玻璃管中,加入2 mol/L的三氟乙酸(TFA) 0.5 mL,120 ℃水解2 h,空气泵吹干。水解吹干后,加入0.3 mol/L NaOH 溶液及 0.5 mol/L PMP/甲醇溶液各0.5 mL,充分混匀后70 ℃避光反应30 min。冷却至室温,加入与 NaOH 等物质的量的HCl中和,氯仿萃取去除多余的衍生试剂,经0.22 μm 滤膜过滤至棕色样品瓶中,待HPLC(安捷伦公司)检测。高效液相色谱检测条件:ODS2 HypersilTM C18色谱柱(4.6 mm×250 mm,5 μm)(Thermo Hypersil),流动相为0.05 mol/L 磷酸盐缓冲液(pH6.7)∶乙腈(V /V)= 82∶18溶液,流速1.0 mL/min,进样量10 μL,检测波长245 nm。
1.7 CuO NPs处理后大豆根中果胶合成相关基因的系统分析
取对照和5 mg/L Cuo NPs处理48 h的大豆根进行转录组测序,筛选其有显著性差异的基因。
在https://www.ebi.ac.uk/Tools/msa/clustalw2/的Clustal Omega进行同源性比对,再用MEGA 5.0软件构建系统进化树,建树参数bootstrap=1 000次重复。
1.8 果胶合成相关基因的qRT-PCR
分别取0、2、5和10 mg/L CuO NPs处理24 h和48 h的大豆根,液氮速冻,-80 ℃保存。RNA的提取按照TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa,大连)说明书进行。
采用Primer primier 5.0、DNAMAN和NCBI进行qRT-PCR的引物设计,引物序列见表1,并将大豆组成型表达cyclophilin(CYP2)基因作为内参基因。

表1 qRT-PCR所需引物Table 1 Primers required for qRT-PCR
1.9 数据分析
使用Microsoft Excel 2010和DPS数据处理系统对试验数据进行统计分析,并使用LSD方法进行显著性差异分析。
2 结果与分析
2.1 CuO NPs对大豆根分生区细胞超微结构的影响
透射电子显微镜下观察发现,对照组大豆根尖分生区细胞的细胞核大,且位于细胞中央,细胞器结构明显,细胞壁平滑(图1a、1b);而CuO NPs处理后,液泡化现象严重,较难观察到正常的细胞核,细胞器减少,细胞壁也受到明显的损伤,厚度变得不均一(图1c、1d)。
2.2 CuO NPs对细胞壁官能团的影响
FTIR 谱图可以表征能够离子化的基团,如羧基、羟基、氨基等在重金属吸附过程中的作用。当官能团参与金属结合时,其吸收峰会发生偏移,因此可以通过峰位的位移来判断参与金属结合的官能团[22-23]。果胶和多糖链C—C或C—O属于果胶质中的特征峰,均明显向低频移动(表2),说明在CuO NPs处理后果胶质在一定程度上参与了铜的化学吸附,从而削弱了细胞壁表面氢键的作用。1 257 cm-1处硫酸酯特征峰出现下降,说明吸收铜后细胞壁硫酸酯化程度降低。

表2 大豆根细胞壁FTIR谱图官能团分析Table 2 Functional group analysis of FTIR spectrumdry of cell walls in soybean roots 单位:cm-1
2.3 CuO NPs处理后大豆根中果胶成分变化
我们通过HPLC对5 mg/L CuO NPs处理24 h大豆根细胞壁中的果胶成分进行了含量分析。果胶类多糖中含量较多的为HG和RG-I,我们选取其中4种单糖(半乳糖醛酸、半乳糖、鼠李糖和甘露糖)进行比较分析,根据标准品衍生产物的 HPLC 色谱图的峰面积绘制标准曲线,计算所测定的4种糖在提取的干燥细胞壁样品中的含量。在CuO NPs处理后,这4种糖含量都出现了一定的增多,其中甘露糖变化最明显,为对照的5.94倍。但是半乳糖醛酸和半乳糖在大豆根中含量较多,且在CuO NPs处理的大豆根中,半乳糖醛酸含量增加较明显,为对照的2.09倍。

表3 不同处理的大豆根细胞壁样品中4种糖含量Table 3 Contents of 4 kinds of sugar in cell wall samples with different CuO NPs treatments 单位:μg/g
2.4 CuO NPs处理后大豆根中的果胶合成相关差异基因
通过转录组测序,在大豆根中共发现了58个果胶合成酶相关的候选基因。其中的差异显著基因有15个,包括11个半乳糖醛糖基转移酶/GAUT基因(HG合成相关),1个α-1,5-阿拉伯糖基转移酶/ARAD1基因(鼠李聚半乳糖醛酸合成相关),3个木糖基转移酶基因/XGD1(木糖聚半乳糖醛酸合成相关)。其中只有2个基因在CuO NPs处理48 h后上调。

a, b:蒸馏水培养;c, d:5 mg/L CuO NPs处理a,b: Distilled water culture; c,d: 5 mg/L CuO NPs treatment图1 CuO NPs处理对大豆根分生区细胞结构影响Fig. 1 Effects of CuO NPs on the cell structure of soybean root meristem

图2 CuO NPs处理后大豆根中的果胶合成相关的差异基因及进化树Fig. 2 Differential genes and evolutionary tree related to pectin synthesis in soybean roots with CuO NPs treatment
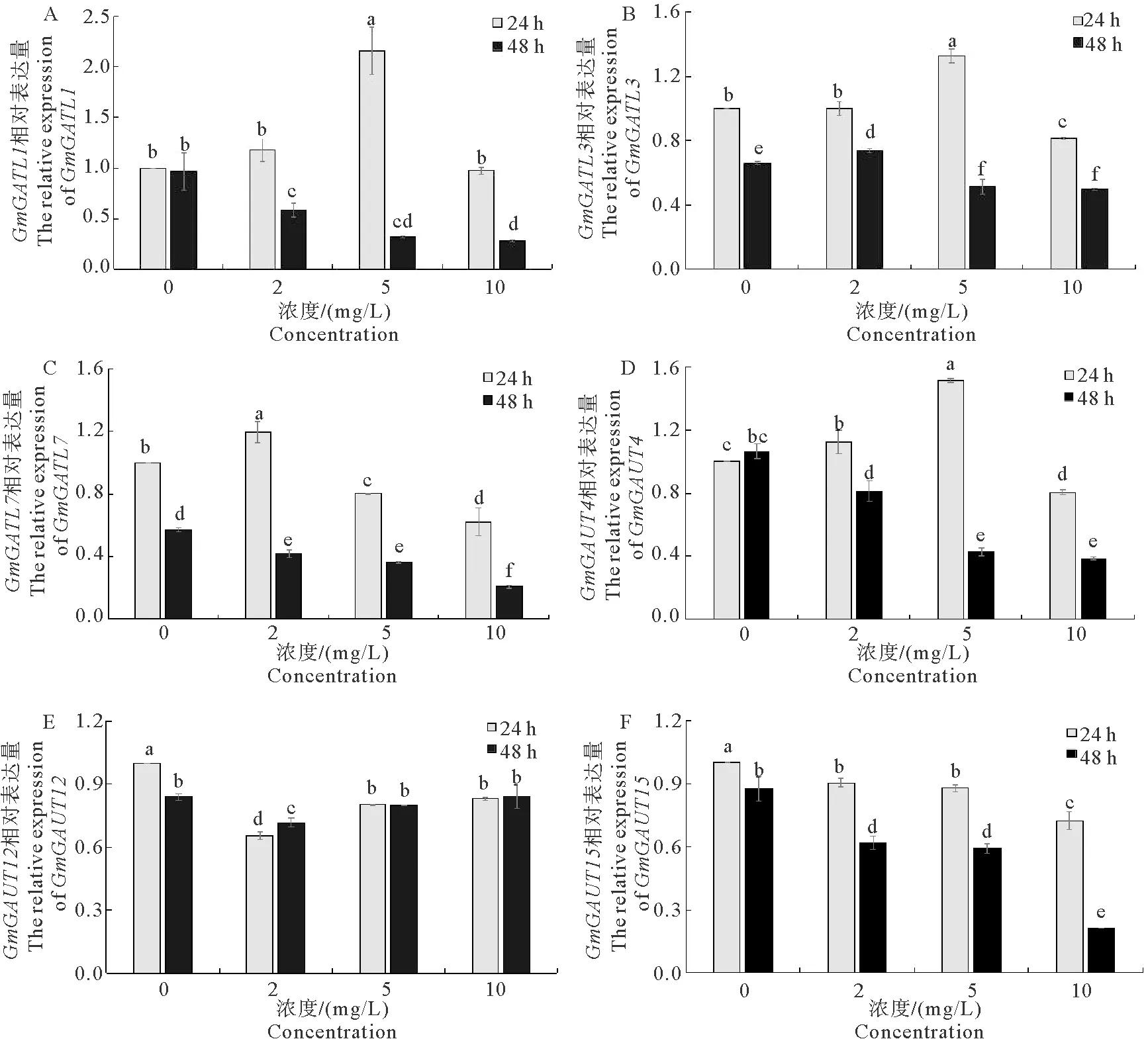
A. GmGATL1; B. GmGATL3; C. GmGATL7; D. GmGAUT4; E. GmGAUT12; F. GmGAUT15图3 大豆根中果胶合成相关基因的相对表达量Fig. 3 Relative expression levels of pectin synthesis related genes in soybean roots
2.5 CuO NPs处理对大豆根果胶合成相关基因表达的影响
由于HG在果胶成分中含量最为丰富,且在 CuO NPs处理后变化最大。为了进一步验证转录组中与果胶合成相关酶基因的表达变化,我们筛选了转录组测序中丰度较高的基因进行了qRT-PCR验证。研究发现,GmGATL1和GmGAUT4在2 mg/L和5 mg/L CuO NPs处理24 h时,相对表达量随浓度升高而出现上调,而在10 mg/L CuO NPs处理24 h时又出现下调,处理至48 h时,基因的表达量出现浓度依赖性的下调。GmGATL3在2 mg/L CuO NPs处理24 h时其相对表达量未发生明显变化,在48 h处理时上调;在5 mg/L处理24 h出现上调,而在10 mg/L CuO NPs处理24 h时又出现下调,在5 mg/L和10 mg/L CuO NPs处理48 h时则一直呈下调状态。GmGATL7基因在2 mg/L CuO NPs处理24 h时上调,在处理48 h时下调,5和10 mg/L CuO NPs处理时则一直呈下调状态。GmGAUT12随处理浓度的增加出现先下调后上调的状态,因此我们认为GmGAUT12可能是一个负调控基因。GmGAUT15在CuO NPs处理后则随浓度的升高而下调。
3 讨论
植物细胞是植物生命活动的结构与功能的基本单位。当用氧化锌纳米颗粒(ZnO NPs)处理黑麦草(Loliumperenne)幼苗时,其根尖收缩,在分生区细胞中发生液泡化[24]。本研究透射电镜结果中显示出严重的细胞液泡化现象,并在CuO NPs处理的大豆中发现了被破坏的细胞壁。高等植物的细胞壁主要成分包括多糖、蛋白质、木质素和酯类化合物等,在植物的生长发育和响应各种逆境胁迫中起着重要的作用,更是阻止重金属离子进入细胞质的第一道屏障。植物细胞通常通过增加细胞壁中果胶多糖的含量,来提高结合重金属离子的能力,使金属离子在细胞壁中积累,避免其过多的进入原生质体,危害细胞的生长发育。La2O3NPs下调了细胞壁果胶和IAA生物合成中涉及的核心基因而改变了根细胞壁结构[25]。在本研究中,FTIR谱图显示果胶和多糖链相关的官能团出现偏移,说明果胶可能参与了CuO NPs的防御。在Pb处理的拟南芥、杂交白杨(PopulustremulaL. x tremuloides Michx.)和浮萍(Lemnatrisulca)中,生长的细胞中均形成低甲酯化的HG来增厚细胞壁,用于Pb在细胞壁中的积累[26]。蕨类植物海金沙(Lygodiumjaponicum)中的大多数Cu都与细胞壁果胶的HG紧密结合[27]。我们用CuO NPs处理大豆根后,发现其果胶中的HG含量出现明显的增多,说明果胶在对纳米颗粒的防御中起着积极的作用。转录组测序分析表明,部分与果胶合成相关的基因在CuO NPs处理后发生显著变化,通过定量进一步分析6种果胶合成酶基因的表达量发现,GmGAUT和GmGATL基因在应对CuO NPs胁迫时表现出不同的表达趋势,但它们主要在低浓度(2 mg/L或5 mg/L)处理24 h时表现出积极的响应,浓度过高或处理时间较长则不能再响应外界胁迫。在CuO NPs处理48 h时,细胞结构遭到破坏,细胞核出现损伤,细胞不能正常进行染色体复制和细胞分裂,导致基因表达随处理浓度升高一直处于下调状态。目前仅是对大豆细胞壁果胶含量变化的鉴定和果胶相关基因相对表达量的分析,但细胞壁是如何防御CuO NPs的相关的基因功能验证有待进一步研究。
