苹果轮纹病菌产生细胞壁降解酶种类及其活性分析
2021-07-07李沅泽李保华王彩霞
李沅泽,李保华,王彩霞
(青岛农业大学植物医学学院/山东省植物病虫害综合防控重点实验室,山东青岛 266109)
苹果轮纹病(Apple ring rot)又被称为苹果粗皮病、轮纹烂果病,是苹果生产中危害最为严重的病害之一。20世纪90年代以来,随苹果产业不断发展壮大,感病品种‘富士’的栽培面积不断扩大。目前,苹果轮纹病在我国各个苹果主产区普遍发生,对全国7省市苹果园的调查结果显示,枝干的总体发病率达77.6%。一般年份,套袋果实轮纹病发病率15%~20%,显著降低了苹果的产量和质量,严重制约了我国苹果产业的健康发展[1-2]。
近年来,对苹果轮纹病的流行规律、防治技术及病原学等进行了系统研究,对该病原菌有了更深入的了解[3]。已明确我国轮纹病的病原菌为Botryosphaeriadothidea,探明轮纹病菌侵染枝干和果实的途径、症状及发展动态。‘富士’果实自幼果期至采收期都可感染轮纹病,其中6-8月果实对轮纹病菌最敏感,而侵染果实的病原菌全部来自枝干[4-5]。目前,生产上主要采用套袋栽培的方法,保护果实免受轮纹病菌侵染,随着套袋成本逐年升高,使得无袋栽培成为必然趋势[2, 6]。苹果轮纹病的防控目前尚无针对性措施,其中一个重要原因是对轮纹病菌的致病机理缺少全面深入的了解。
细胞壁降解酶作为多种植物病原真菌的重要致病因子,在病原菌侵染寄主过程中扮演着重要的角色[7-8]。陈晓林等[9]报道苹果树腐烂病菌致病过程中可产生5种细胞壁降解酶,其中木聚糖酶对苹果组织的浸解能力最强;李超等[10]研究发现,腐烂病菌分泌细胞壁降解酶活性与菌株致病力呈正相关。层生镰刀菌可引起多种植物病害,强致病力菌株可分泌多种细胞壁降解酶,包括漆酶、β-葡萄糖苷酶、果胶酶等;最近,Sharafaddin等[11-12]证实层生镰刀菌不同致病力菌株产生纤维素酶的量与其定殖能力密切相关,表明细胞壁降解酶是该病菌的主要致病因子。苹果轮纹病菌侵染后的果实表现出典型的细胞壁降解症状,推测酶类物质在病原菌的侵染过程中发挥重要作用,但目前关于轮纹病菌产生细胞壁降解酶种类及其活性变化等研究尚未见报道。本研究测定了苹果轮纹病菌产生细胞壁降解酶的种类,分析了5种碳源诱导轮纹病菌体外产生细胞壁降解酶的效果,及其在寄主体内分泌的细胞壁降解酶的活性变化趋势,以期明确苹果树轮纹病菌的致病因子,为病害有效防控提供有价值的参考。
1 材料与方法
1.1 供试菌株与植物材料
苹果轮纹病菌菌株LXS030101分离自发病‘富士’枝条,由本实验室成员进行单孢分离、纯化后鉴定为葡萄座腔菌(B.dothidea)[4]。
供试植物材料为2~3年生‘富士’苹果枝条和6月份幼果,均采集自青岛农业大学试验田。成熟‘富士’果实采集自商品果园。
1.2 供试培养基
苹果轮纹病菌细胞壁降解酶的诱导方法参照Dipietro等[13]报道稍做改进,以改良的Fries培养基(酒石酸铵5 g,硝酸铵0.5 g,磷酸二氢钾1 g,硫酸镁0.5 g,氯化钙0.1 g,酵母提取物1 g)为基本培养基,分别添加5种不同的碳源: 蔗糖(Sucrose)20 g,木聚糖(Xylan) 2 g,果胶(Pectin) 5 g,羧甲基纤维素钠(CMC) 10 g,木葡聚糖(Xyloglucan) 2 g,用蒸馏水定容至1 L,自然pH。
上述培养基均按60 mL/150 mL的装瓶量进行分装,121 ℃灭菌20 min。
1.3 细胞壁降解酶的体外诱导和菌丝干重测定
将苹果轮纹病菌培养于马铃薯葡萄糖琼脂培养基(PDA)上,25 ℃,暗培养3 d。在菌落边缘打取直径6 mm的菌饼,接种于上述5种不同碳源液体培养基,每瓶接种4个菌饼,于25 ℃、150 r/min条件下恒温振荡培养,分别于12、24、48、72、96、120 h进行取样,以未接种轮纹病菌的各培养基作为对照,每处理3个重复。培养液用滤纸过滤后,于4 ℃条件下12 000 r/min离心10 min,取上清液进行酶活性的测定。于120 h取样后,收集菌丝置于50 ℃烘箱,烘干后测量菌丝干重。
1.4 苹果果实和枝条接种及粗酶液的制备
选取颜色、大小相近且无伤痕病斑的健康成熟果实和幼果,自来水洗净后,用75%酒精进行果实表面消毒。待果实晾干后,用直径6 mm打孔器造成伤口,深度约3 mm,接种轮纹病菌菌饼后放入密封保湿盒。苹果离体枝条接种采用烫伤接种法,均于25 ℃条件下进行暗培养,分别于12、24、48、72 h观察测量病斑,并切取病健交界处果实组织,放置于-80 ℃保存,用于细胞壁降解酶活性测定。以未接种病原菌的果实和枝条作为对照,每处理设置3个重复。
每克鲜重组织加入25 mL提取液(50 mmol/L Tris-HCl,100 mmol/L KCl,2% PVP,0.5% Triton X-100,pH值7.2),冰浴振荡40 min,4 ℃、12 000 r/min离心10 min后上清液即为粗酶液。
1.5 细胞壁降解酶活性测定
采用紫外-可见光分光光度法测定细胞壁降解酶的活性。多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)、内切-β-1,4-葡聚糖酶(EG)、β-葡萄糖苷酶(β-Glucosidase)、木葡聚糖酶(Xyloglucanase)、木聚糖酶(Xylanase)和滤纸酶(FPA)的活性测定参考李宝聚、Douaiher和Siah等[14-16]报道,利用二硝基水杨酸(DNS)在540 nm处测定反应混合物的消光值,根据酶反应所释放的还原糖量计算酶活性。PG和PMG所用底物为0.5%多聚半乳糖醛酸溶液和0.25%橘皮果胶溶液,EG和β-葡萄糖苷酶活性测定所用底物为1% CMC溶液和0.5%水杨苷溶液,木葡聚糖酶和木聚糖酶底物为0.2%木葡聚糖溶液和0.25%木聚糖溶液,滤纸酶底物为新华一号定量滤纸。50 ℃条件下每分钟每毫升酶液(每克组织鲜重)催化底物释放1 μmol还原糖为一个酶活单位,用U/mL或U/g表示。
多聚半乳糖醛酸酶反式消除酶(PGTE)和果胶甲基反式消除酶(PMTE)的活性测定参照文献报道,在232 nm处测定反应混合物消光值,按相应公式计算酶活性[14]。30 ℃下每分钟每毫升酶液催化底物释放1 μmol不饱和醛酸为一个酶活单位(U/mL)。最终计算样品酶活性均减去对照值加以校正。
2 结果与分析
2.1 苹果轮纹病菌产生细胞壁降解酶种类和水平
轮纹病菌活化后接种蔗糖作碳源的培养基,同时接种苹果成熟果实,分别对9种细胞壁降解酶进行活性测定。表1结果显示,在蔗糖培养基和发病果实中均未检测到PGTE和PMTE酶活性,但其余7种酶活性均有不同程度升高,表明轮纹病菌可产生多种细胞壁降解酶且酶活性存在差异。在蔗糖培养基中,轮纹病菌产生的PG酶活性最高,其次为PMG、β-葡萄糖苷酶、木葡聚糖酶和FPA,而木聚糖酶活性最低;在成熟果实中,该病菌分泌的木聚糖酶活性最低,其余各酶活性相当。此外,蔗糖培养基中产生的各细胞壁降解酶活性均高于成熟果实,然而,在发病苹果枝条组织中,上述各细胞壁降解酶活性均未检测到。

表1 轮纹病菌在蔗糖培养基和苹果果实中产生细胞壁降解酶活性
2.2 不同碳源培养条件下轮纹病菌产生细胞壁降解酶活性
分别以蔗糖、果胶等为碳源对轮纹病菌进行培养,于培养后24~96 h取样,测定7种细胞壁降解酶活性,结果见图1。轮纹病菌在5种碳源培养条件下,仅在以蔗糖为碳源的培养基中检测到木聚糖酶,培养48 h时酶活性水平最高为3.96 U/mL,而在其他4种碳源培养条件下均未检测到木聚糖酶活性。同样,蔗糖为碳源时诱导轮纹病菌产生的木葡聚糖酶、PMG、EG、β-葡萄糖苷酶和FPA酶活性均显著高于其他碳源,且最大酶活性均出现在培养48 h的发酵液中。以果胶为碳源时,可诱导轮纹病菌产生高活性的PG,酶活性达39.62 U/mL;以木葡聚糖为碳源时,产生的PG酶活性也最高,但仅为3.94 U/mL。以CMC为碳源时,诱导病菌产生的PMG酶活性最高,而β-葡萄糖苷酶活性最低。以木聚糖为碳源时,诱导轮纹病菌产生的各细胞壁降解酶活性均较低且达到酶活性峰值时间较晚(培养72~96 h)。
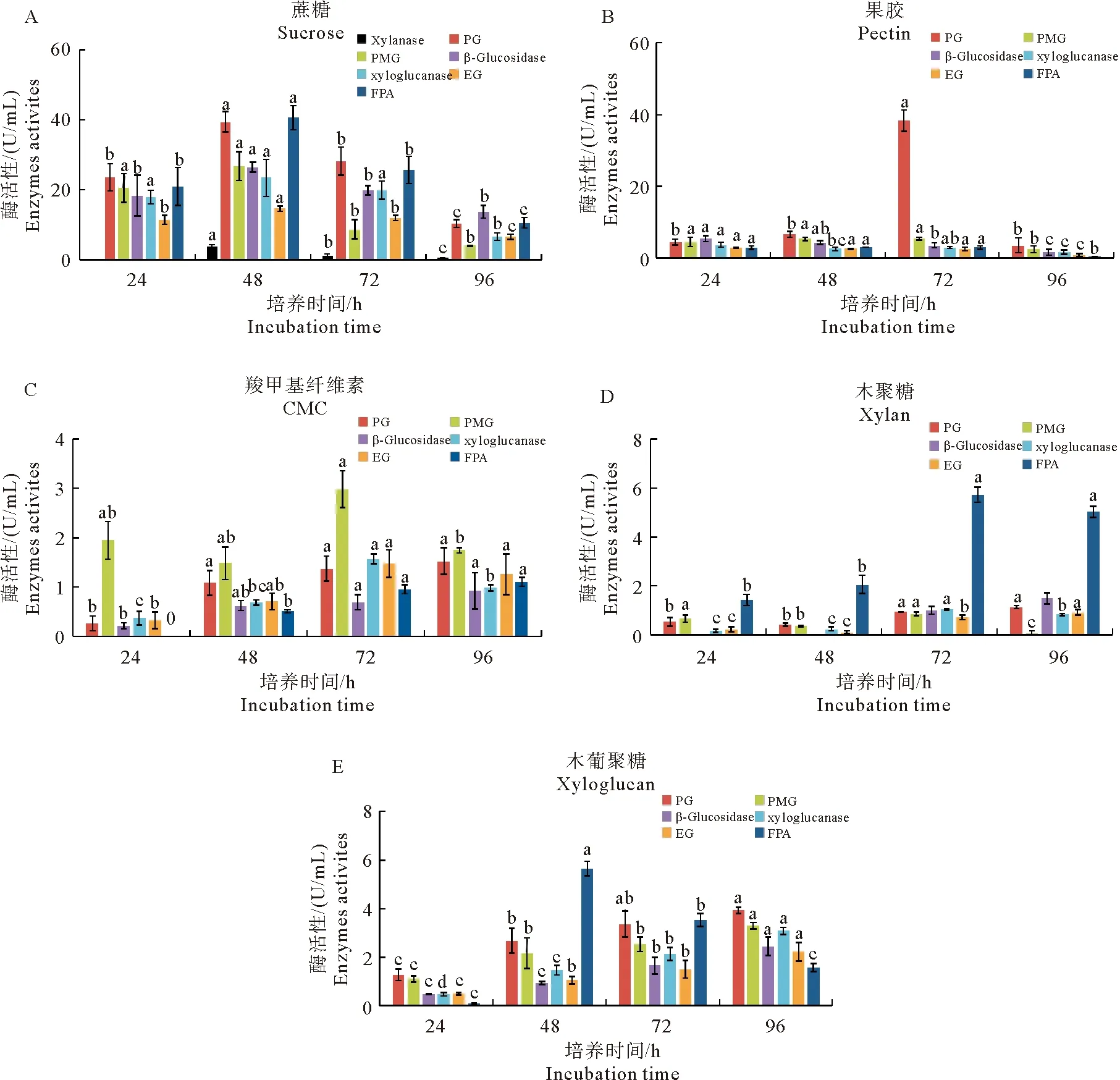
图1 5种碳源培养条件下苹果轮纹病菌产生细胞壁降解酶活性
试验测定了蔗糖、CMC、果胶、木聚糖和木葡聚糖5种碳源条件下,培养120 h后,苹果轮纹病菌的菌丝干重。图2结果显示,以蔗糖为碳源的培养基中,苹果轮纹病菌生长最快,菌丝干重达0.18 g,其次为以果胶和木聚糖为碳源的培养基,而在木葡聚糖为碳源的培养基中长最慢,菌丝干重仅为0.05 g。

图2 不同碳源培养条件下苹果轮纹病菌的菌丝干重
2.3 苹果轮纹病菌侵染果实过程中产生细胞壁降解酶的活性变化规律
苹果轮纹病菌侵染成熟果实过程中,可产生7种细胞壁降解酶,其活性变化如图3A所示。轮纹病菌分泌的木聚糖酶仅在接种后72 h检测到活性升高; PG、PMG、木葡聚糖酶和FPA酶活性变化趋势一致,均在接种后24 h出现一个明显的低谷,随后酶活性显著升高。β-葡萄糖苷酶活性于接种后24 h即到达峰值为11.72 U/g,随后酶活性快速降低,接种后72 h甚至未检测到该酶活性。EG酶活性呈现先升高后减低的单峰曲线,于接种后48 h到达高峰(5.20 U/g )。
相比成熟果实,轮纹病菌在侵染苹果幼果过程中产生的细胞壁降解酶种类减少,且酶活性水平均较低(图3B)。幼果接种轮纹病菌后,仅产生6种细胞壁降解酶,均未检测到木聚糖酶活性。PG和β-葡萄糖苷酶活性呈现先升高后降低的单峰曲线,于接种后48 h酶活性达到峰值分别为3.23 U/g 和1.41 U/g ;PMG酶活性仅在接种后24 h和48 h产生,木葡聚糖酶活性在接种后24~72 h产生,两者均于接种后48 h到达最高酶活性水平;EG酶活性仅在侵染早期(接种后12~24 h)产生,而FPA酶活性于接种后12 h已到达活性高峰(2.30 U/g ),随后酶活性水平缓慢降低。
轮纹病菌接种苹果果实后病斑面积如图4所示,成熟苹果果实接种轮纹病菌后12 h即可观察到明显的发病症状,接种点周围出现褐色、水渍状、软腐病斑,随后病斑快速扩展;接种后48 h时,病斑面积已达4.48 cm2;接种后72 h时,病斑上有褐色黏液渗出,病斑面积达13.06 cm2。幼果接种苹果轮纹病菌后24 h开始出现发病症状,接种点周围果肉组织变褐,随后病斑缓慢扩展,病组织未表现水渍状,接种后72 h时病斑面积仅为2.41 cm2。
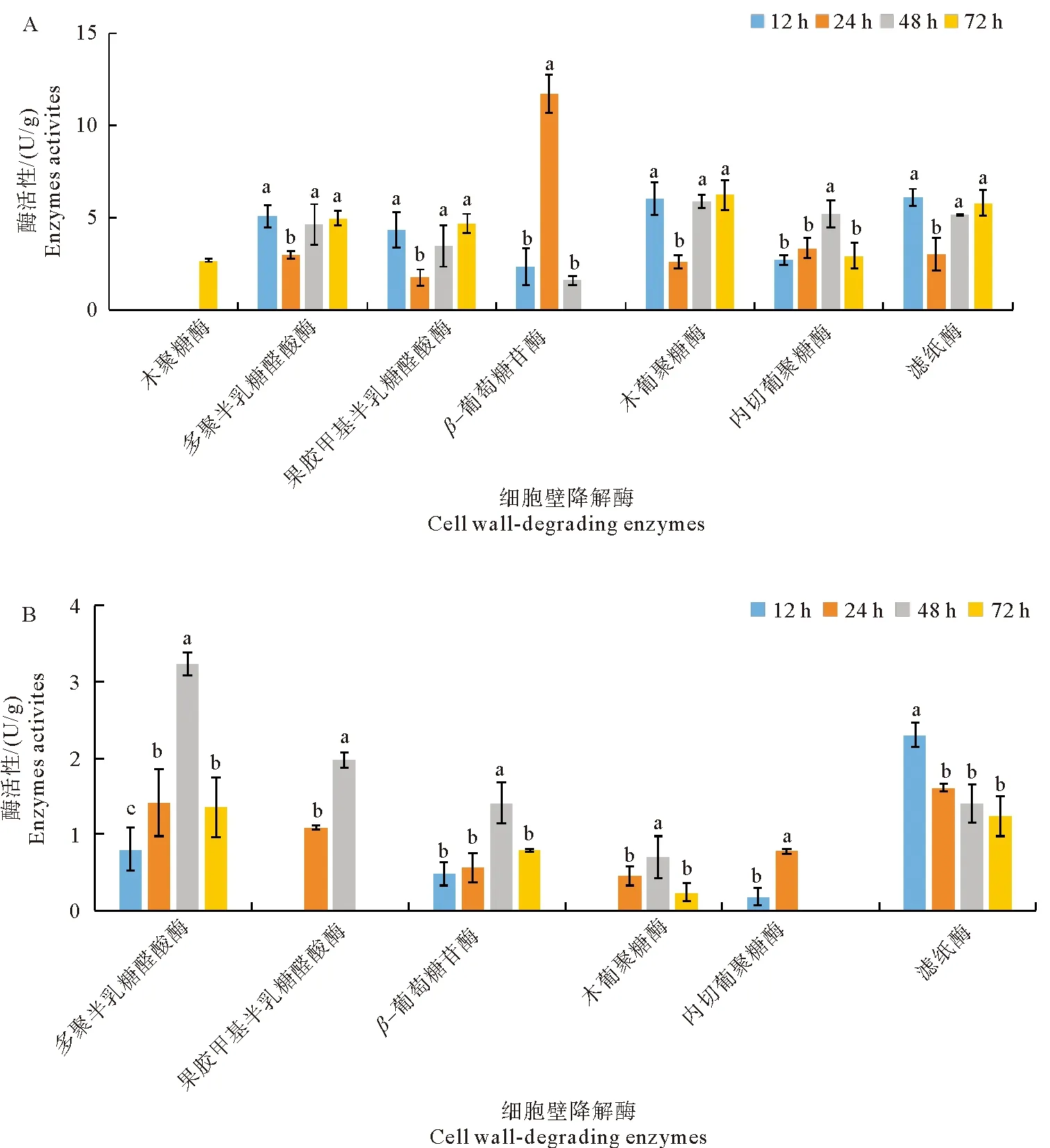
图3 苹果轮纹病菌侵染成熟果实(A)和幼果(B)产生细胞壁降解酶活性变化
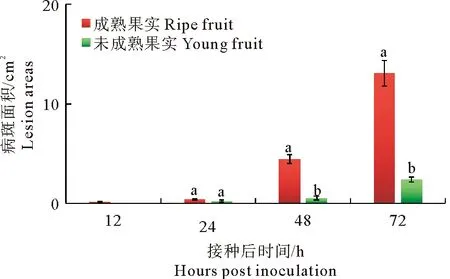
图4 苹果轮纹病菌接种成熟果实和幼果后病斑面积变化
3 讨论
本研究对苹果轮纹病菌分泌的细胞壁降解酶种类和活性进行了系统研究,发现该病菌在液体培养基和侵染成熟果实过程中均能产生PG、PMG、EG等7种细胞壁降解酶;在侵染幼果时未检测到木聚糖酶,仅产生6种细胞壁降解酶。然而,在发病苹果枝条中均未检测到上述细胞壁降解酶,说明该病菌侵染机制非常复杂,除细胞壁降解酶外存在其他重要的致病因子。Reveglia等[17]报道,葡萄座腔菌在致病过程中,可产生二丙烯酸(spencertoxin)、蜂蜜曲霉素(mellein)及其衍生物等多种毒素,但轮纹病菌产生的毒素种类及作用机制等尚不清楚。
利用5种碳源均可诱导苹果轮纹病菌产生多种细胞壁降解酶,但在蔗糖培养基中分泌的细胞壁降解酶活性和种类显著大于其他4种碳源,且轮纹病菌在此培养基中生长量最大,说明该病菌产生细胞壁降解酶活性与菌丝生长呈正相关。Ramos等[18]研究发现,玉米碳腐病菌在果胶作为碳源时,可产生高活性的PG和PMG且出现时间较早,而在CMC作为碳源时,诱导该病原菌产生的纤维素酶活性较低且出现时间较晚。本研究中轮纹病菌在果胶培养基中分泌的PG和PMG最大酶活性均出现在培养72 h的发酵液中,但PG酶活性(39.62 U/mL)显著大于PMG酶活性(5.43 U/mL);以CMC为碳源时,轮纹病菌产生的两种纤维素酶(β-葡萄糖苷酶和FPA)活性均较低,且出现时间较晚,说明不同病原菌在不同碳源诱导条件下,产生细胞壁降解酶活性变化存在明显差异。
木聚糖酶是多种植物病原真菌的重要致病因子,已有研究发现,苹果树腐烂病菌木聚糖酶基因VmXyl1敲除后,突变体致病力显著降低;灰葡萄孢菌木聚糖酶基因xyn11A缺失突变体对番茄和葡萄浆果的致病力降低70%[19-20]。然而,轮纹病菌仅在蔗糖为碳源的培养基中分泌木聚糖酶,且酶活性较低,该病原菌侵染果实过程中,仅在接种后72 h的成熟果实中检测到木聚糖酶活性,说明木聚糖酶可能不是轮纹病菌的重要致病因子。
苹果轮纹病菌在侵染果实过程中,可产生高活性的果胶酶(PG和PMG),尤其在侵染幼果时,产生的PG酶活性显著高于其他5种细胞壁降解酶,表明该酶在轮纹病菌致病过程中发挥重要作用。洪坤奇[21]利用基因敲除技术,获得了轮纹病菌两个果胶酶基因的缺失突变体△Bdpl1-3和△Bdpg1-2,发现其对苹果果实的致病力均明显降低,但△Bdpl1-3在苹果枝条上的致病力无明显变化,结合本研究结果,推测与轮纹病菌在苹果枝条中不产生细胞壁降解酶有关。本研究发现,轮纹病菌有伤接种幼果后,病斑扩展缓慢,且未出现水渍状、软腐病斑,推测与其产生的细胞壁降解酶活性低有关,这与自然条件下,轮纹病菌侵染的幼果并不发病,待果实近成熟或储藏期才开始发病的特点相一致[2]。
本研究测定了轮纹病菌产生的细胞壁降解酶在苹果果实中的动态变化,在成熟果实中,PG、PMG、木葡聚糖酶和FPA在接种后12 h时酶活性水平较高,但于接种后24 h出现了一个明显的低谷,而此时β-葡萄糖苷酶活性快速升高并达到峰值,说明轮纹病菌致病过程中各细胞壁降解酶存在协同作用,且有其他致病因子如毒素等的参与,哪种是关键致病因子及各致病因子间如何协调作用等,有待深入研究。
