亚麻籽胶-紫花苜蓿叶蛋白改性物的制备及乳化性能研究
2021-07-07辛小丽王志娟甘文梅乜世成
高 红,张 炜,辛小丽,王志娟,甘文梅,乜世成,宋 林
青海师范大学化学化工学院,西宁 810008
紫花苜蓿(MedicagosativaL.)是一种优质豆科类牧草,由于其营养成分丰富、品质优良、蛋白含量高等特点而被国内外研究学者所青睐[1]。紫花苜蓿产量高、市场价格低,是一种优质的天然资源。此外紫花苜蓿叶中的粗叶蛋白含量可达70%左右,且氨基酸种类丰富,其中含有人体必需氨基酸含量达40.6%[2,3]。由于其自身的功能特性优于动物蛋白,所以常做为动物的辅助饲料。然而紫花苜蓿叶蛋白(alfalfa leaf protein concentrates,ALPCs)功能性质存在局限性,乳化活性不显著,在应用时往往需要添加具有高乳化活性的糖类物质,来提高其在食品、医药等领域的利用价值。对ALPCs进行糖基化改性,提高其乳化性能具有潜在的利用价值。目前,常用的蛋白乳化改性方法有化学改性法、物理改性法和酶改性法等。其中化学改性法中的糖基化改性法是一种温和绿色的蛋白质改性方法。通过控制时间、温度、pH及加热蛋白质与糖类接枝反应程度,以期实现产物的改性。已有研究表明糖基化改性可改善蛋白质的乳化性,乳化稳定性及抗氧化能力等。目前对ALPCs的研究只停留在产物制备及抗氧化活性的研究[4],对其乳化性及乳化稳定性的研究尚未报道。因此,为了弥补ALPCs乳化性方面的不足,本研究采用糖基化改性法优化制备复合物,对其复合物的乳化性能进行研究。
研究报道多糖可以改善蛋白质的乳化性能,亚麻籽胶(flaxseed gum,FG),又称为富兰克胶,是由酸性多糖和中性多糖组成的一种天然新型亲水胶体[5]。研究表明亲水胶体由于其含有一定量的结合蛋白,使得FG本身持有良好的乳化性,增稠性及起泡性。此外,FG是国家绿色食品发展中心认定的绿色健康安全的食品专用添加剂[6,7]。将FG与ALPCs糖基化结合,在改善蛋白质性能方面表现出来巨大的潜力,已成为食品领域研究热点之一。
目前常用的糖基化改性方法主要有干法改性法和湿法改性法[8],干法反应温度受限,一般为60~65 ℃,而湿法反应温度较广泛,一般包括低温反应(60~62 ℃)和高温反应(100~120 ℃)。由于湿热反应具有反应周期短,与底物接触充分等的优势,故本实验在湿热高温条件下进行改性,利用响应面优化制备复合物,采用FG对ALPCs进行糖基化修饰研究,通过ALPCs-FG的乳化性能测定及对ALPCs-FG的官能基团变化和微观结构进行表征,为ALPCs资源的开发和ALPCs-FG的乳化性能研究提供理论参考。
1 材料与方法
1.1 原料与试剂
紫花苜蓿(采集于青海大学试验田);亚麻籽胶(北京索莱宝科技有限公司,分析纯);邻苯二甲醛(购于上海麦克林生化科技有限公司);盐酸、氢氧化钠(购于天津市恒兴化学试剂制造有限公司);所有试剂均为分析纯,除非另有说明。
1.2 仪器与设备
101A-1E电热鼓风干燥箱(上海仪器实验厂有限公司);磁力搅拌器(广州仪器设备有限公司);PB-10pH计(上海梅特勒-托利多仪器有限公司);高压灭菌器(上海审安医疗器械厂);IKA分散均质机(广州仪科实验室技术有限公司);DelsaMax PRO型激光粒度分析仪;X—射线粉末衍射仪(日本岛津公司);傅里叶变换红外光谱仪(美国赛默飞公司);扫描电子显微镜(日本JEOL公司);高速离心机(湖南湘仪实验仪器开发有限责任公司)
1.3 试验方法
1.3.1 紫花苜蓿叶蛋白(ALPCs)的提取
参考Liu等[9]的提取方法,略微改动。将提取的ALPCs在其等电点(pH=4.0)下,70 ℃条件下絮凝10 min。用无水乙醇洗去ALPCs中的色素,直至洗出液接近无色,冷冻干燥得ALPCs。
1.3.2 单因素条件下紫花苜蓿叶蛋白-亚麻籽胶(ALPCs-FG)的制备
1.3.2.1 不同pH值下ALPCs-FG的制备
按照1∶1的底物比(m(ALPCs)∶m(FG))准确称取五份0.2 g的ALPCs于五个锥形瓶中,并分别加入0.1 g的FG,随后加入100 mL蒸馏水将其配成溶液,超声10 min使其溶解。用0.1 mol/L的盐酸、氢氧化钠溶液调配五份溶液,其pH调为2.0、4.0、6.0、8.0、10.0。将调好pH值的五份溶液放入高压灭菌器中反应,设定反应温度为90 ℃、反应时间为2 h,反应结束后立即用冷水停止其反应。随后溶液用离心机离心5 min,其转速为8 000 rpm,上清液保留并除去未反应的杂质,得到ALPCs-FG,对ALPCs-FG的功能性质进行测定(乳化性及其乳化稳定性)。单因素试验均做三次。
1.3.2.2 不同配比下ALPCs-FG的制备
按照1∶1、2∶1、3∶1、1∶2、1∶3的底物(m(ALPCs)∶m(FG))配比准确称取质量为0.1、0.2、0.3、0.1、0.1 g的ALPCs于五个锥形瓶中,并依次加入质量为0.1、0.1、0.1、0.2、0.3 g的FG,随后加入100 mL蒸馏水将其配成溶液,超声10 min使其溶解。用0.1 mol/L的氢氧化钠溶液调节五份溶液的pH值都为8.0。将调好pH值的五份溶液放入高压灭菌器中反应,设定反应温度为90 ℃,时间为2 h,反应结束后立即用冷水中止其反应。随后溶液用离心机离心5 min,其转速为8 000 rpm,上清液保留并除去未反应的杂质,得到ALPCs-FG,对ALPCs-FG的功能性质进行测定(乳化性及其乳化稳定性)。单因素试验均做三次。
1.3.2.3 不同时间下ALPCs-FG的制备
准确称取0.1 g ALPCs于五个锥形瓶中并加入0.1 g的FG,随后加入100 mL蒸馏水将其配成溶液,超声10 min使其溶解。用0.1 mol/L的氢氧化钠溶液调节五份溶液的pH值都为8.0。将调好pH值的五份溶液放入高压灭菌器中反应,反应温度设为90 ℃,反应时间分别设为30、60、90、120、150 min,反应结束后立即用冷水中止反应。随后溶液用离心机离心5 min,其转速为8 000 rpm,上清液保留并除去未反应的杂质,得到ALPCs-FG,对ALPCs-FG的功能性质进行测定(乳化性及其乳化稳定性)。单因素试验均做三次。
1.3.2.4 不同温度下ALPCs-FG的制备
准确称取五份0.1 g ALPCs于五个锥形瓶中并分别加入0.1 g的FG,随后加入100 mL蒸馏水将其配成溶液,超声10 min使其溶解。用0.1 mol/L的氢氧化钠溶液调节五份溶液的pH值都为8.0。将调好pH值的五份溶液放入高压灭菌器中反应,反应时间设为2 h,反应温度分别设为30、50、70、90、110 ℃,反应结束后立即用冷水中止反应。随后溶液用离心机离心5 min,其转速为8 000 rpm,上清液保留并除去未反应的杂质,得到ALPCs-FG,对ALPCs-FG的功能性质进行测定(乳化性及其乳化稳定性)。单因素试验均做三次。
1.3.3 响应面试验方案
在单因素试验的基础上,以ALPCs-FG的乳化性作为响应值,采用BOX-Behnken试验原理设计进行工艺条件优化,各因素水平设计如表1所示。

表1 响应面因素水平设计
1.3.4 乳化性的测定方法
根据Turgeon等[10]的研究方法,略有修改。利用浊度法进行测定,选取波长在500 nm处对ALPCs-FG的乳化性(EAI)及其乳化稳定性(ESI)进行计算。
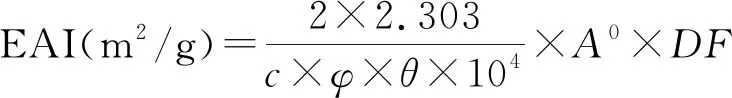
(1)
(2)
其中:DF-稀释倍数,100;φ-比色皿光程;C-蛋白质质量浓度,g/mL;θ-乳液中油相所占比,25%;A0-0 min时的吸光度;A10-10 min时的吸光度;t-10 min
1.3.5 接枝度测定
参考Church等[11]的方法,稍作修改,采用OPA法测定接枝度。80 μL 1 mg/mL的样品溶液中加入4 mL邻苯二甲醛试剂,混合均匀,35 ℃水浴2 min,OPA试剂为空白对照。在340 nm下测吸光值。
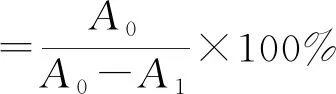
(3)
其中:A0:ALPCs的吸光值;A1:ALPCs-FG的吸光值。
1.3.6 傅里叶红外光谱测定
参考Wu等[12]的方法,采用KBr压片法。分别取适量冷冻干燥后的ALPCs和ALPCs-FG与一定量溴化钾混合,研磨成粉末后压片,设置分辨率为4 cm-1,扫描次数32次,随后用Nicolet iS50FT-IR型傅里叶变换红外光谱仪作全波段(4 000~400 cm-1)扫描。
1.3.7 粒径分布测定
参考Hu[18]的方法,略有改动。配置质量浓度为1.0%(W/V)蛋白溶液(ALPCs和ALPCs-FG),将蛋白溶液溶于0.01 moL/L(pH=7.0)磷酸盐溶液中。添加微量0.02 %NaN3,其目的防止微生物污染。室温磁力搅拌2 h,4 ℃过夜,使蛋白充分水合。次日离心10 min,取上清液,加入大豆油(油相比φ=25%),在转速为5 000 rpm下高速均质乳化5 min,得测样乳液,将乳液置于DelsaMax PRO型激光粒度分析仪比色皿中测定其粒径大小。
1.3.8 X-射线衍射分析
采用X-射线粉末衍射仪(日本岛津公司)铜靶Kɑ射线(40 kv,30 mV),将膜样品用橡皮泥固定在检测器上,记录样品在2θ=100到2θ=800之间的X-射线衍射(XRD)强度并用jade 6.0分析软件分析样品晶体结构变化。
1.3.9 扫描电镜分析
用导电双面胶将样品固定在检测台上,将样品(ALPCs和ALPCs-FG)撒在双面胶上,吹去多余的粉末,真空下喷金后置于KYKY-EM3200型扫描电子显微镜对样品进行表面结构分析。
2 结果与分析
2.1 不同因素对紫花苜蓿叶蛋白乳化性、乳化稳定性的影响
2.1.1 pH值对改性后紫花苜蓿叶蛋白乳化性、乳化稳定性的影响
由图1可知ALPCs在pH值为4.0时有最低的乳化性,而乳化稳定性在pH值为4.0时最高,这主要是因为ALPCs的等电点在3.2~4.4之间。当pH值为4.0时,ALPCs在蒸馏水中几乎没有溶解性,这也间接表明ALPCs与FG之间没有发生糖基化反应。改性的ALPCs的乳化性在pH值为4.0时呈现最低值,而此时的乳化稳定性最好。由于本文是以乳化性为响应值,从图中可以看出ALPCs在碱性溶液中具有较好的乳化性,在pH为8.0时具有较高的乳化性,因此,选定pH 8.0作为最佳条件。

图1 反应pH对乳化性、乳化稳定性的影响Fig.1 The effect of reaction pH on emulsification and emulsification stability
2.1.2 底物配比对改性后紫花苜蓿叶蛋白乳化性、乳化稳定性的影响
由图2可知,当ALPCs与FG的质量比从3∶1变化到1∶3时,ALPCs的乳化性、乳化稳定性的变化与ALPCs和FG之间的配比变化非常显著,这主要是因为FG本身具有较强的乳化性,将其接枝到ALPCs中致使ALPCs乳化能力增强,FG在产物的乳化能力中起主导作用,但当FG含量持续增加后反而使美拉德产物中具有乳化能力的位点减少,导致其乳化能力降低、乳化稳定性下降。因此,确定ALPCs与FG质量比1∶1为最佳比例。

图2 底物配比对乳化性、乳化稳定性的影响Fig.2 The effect of substrate ratio on emulsification and emulsification stability
2.1.3 时间对改性后紫花苜蓿叶蛋白乳化性、乳化稳定性的影响
由图3可知,改性的ALPCs的乳化性随反应时间的变化呈现先慢慢增加后急剧下降的趋势,乳化性在120 min时达到最大值,而乳化稳定性随反应时间变化不明显,表明乳化稳定性跟反应时间相关性差。乳化性变化明显是因为随着反应时间的延长,反应更加充分,使ALPCs中被引入更多亚麻籽胶的亲水基团,反应时间在150 min时乳化性最小,可能是因为ALPCs-FG体系中油-水分界面间的平衡被破坏,从而降低ALPCs乳液的乳化性。因此,选择反应时间为120 min时为最佳反应时间。
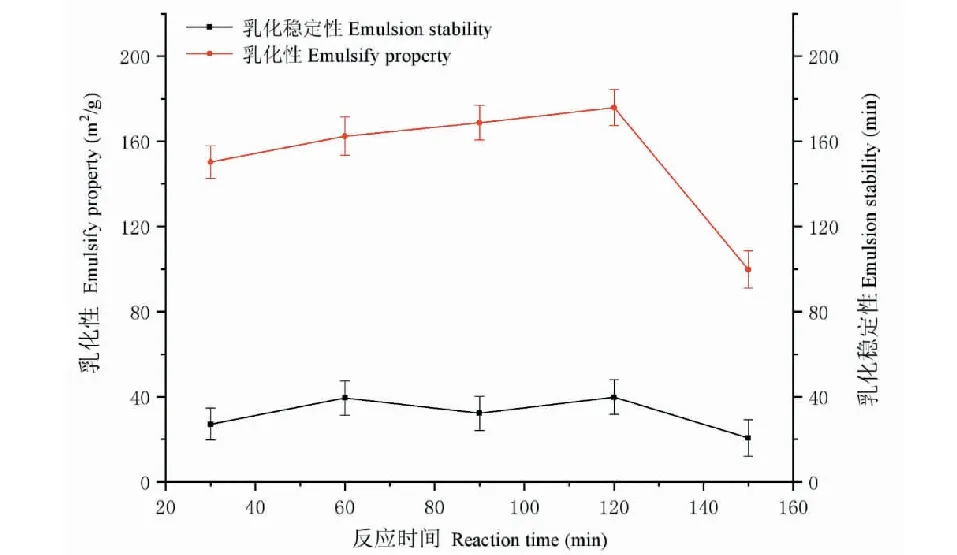
图3 反应时间对乳化性、乳化稳定性的影响Fig.3 The effect of reaction time on emulsification and emulsification stability
2.1.4 温度对改性后紫花苜蓿叶蛋白乳化性、乳化稳定性的影响
从图4中可知,反应体系温度在30~90 ℃之间,ALPCs-FG的乳化性随着反应温度的上升而逐渐变大。在这个温度范围内,乳化稳定性在68 ℃左右时达到最大值。这主要是因为反应速率跟体系的温度有关,在适宜的温度下可促使ALPCs结构伸展,使ALPCs中更多的疏水基团暴露,导致大量亲水基团、疏水基团分别与水层、油层相结合。而反应温度在90 ℃时具有良好的乳化性,温度在110 ℃左右时乳化性降低,可能是由于温度升高导致ALPCs质发生聚集。因此,选择90 ℃作为最佳反应温度。
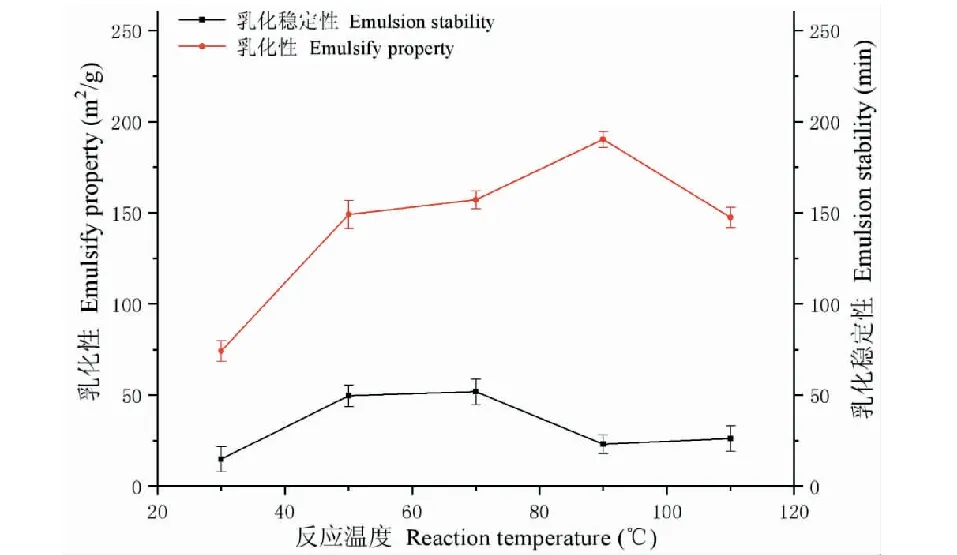
图4 反应温度对乳化性、乳化稳定性的影响Fig.4 The effect of reaction temperature on emulsification and emulsification stability
2.2 响应面试验设计及方差检验分析
通过响应面试验设计对表2数据进行多元回归拟合,得出回归方程:
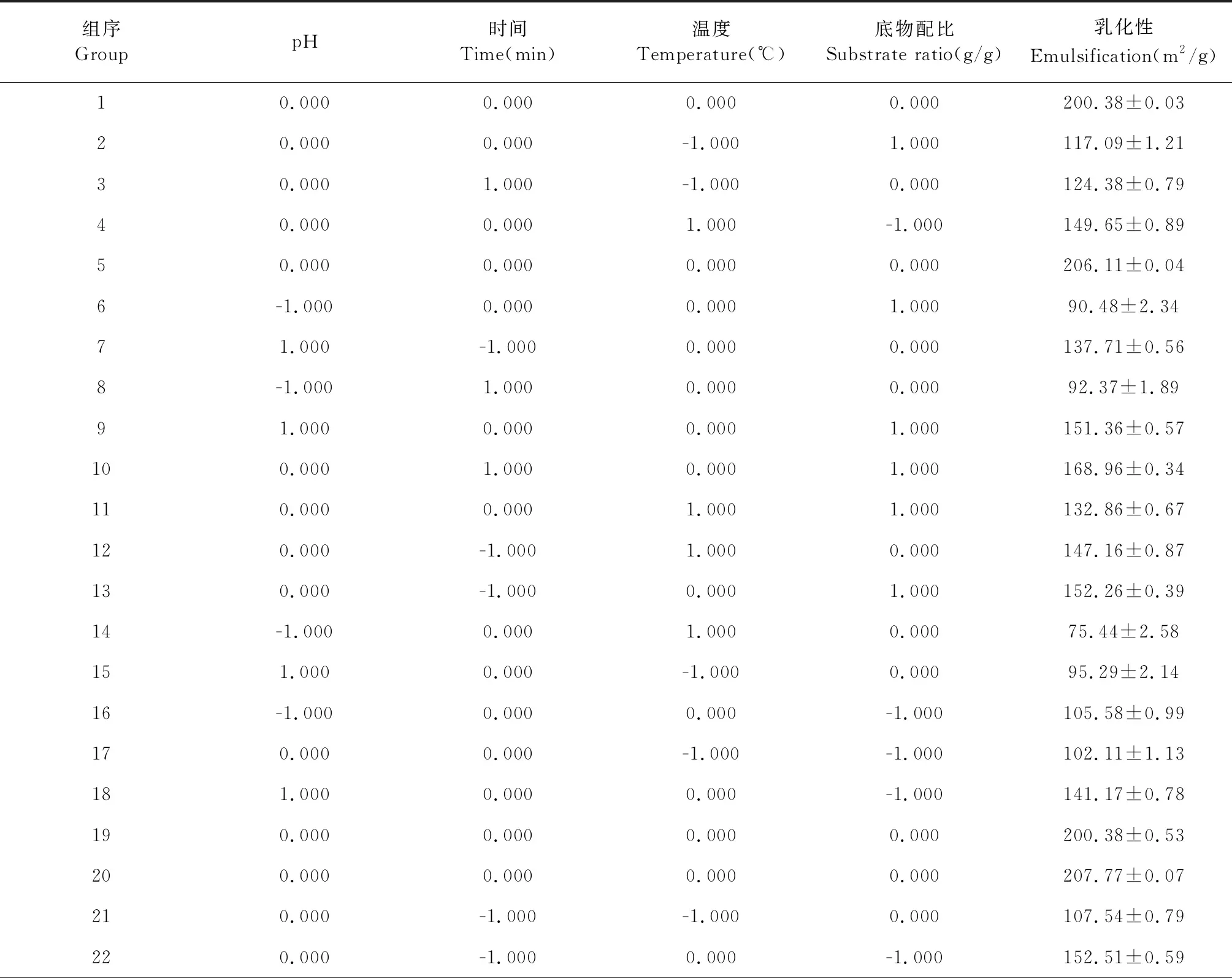
表2 响应面设计及结果

续表2(Continued Tab.2)
R=203.73-21.94A+9.052B+9.56C-1.53D-13.51AB-16.95AC-6.22AD-5.57BC+1.36BD-7.94CD-52.682-21.64B2-51.54C2-27.092
(4)

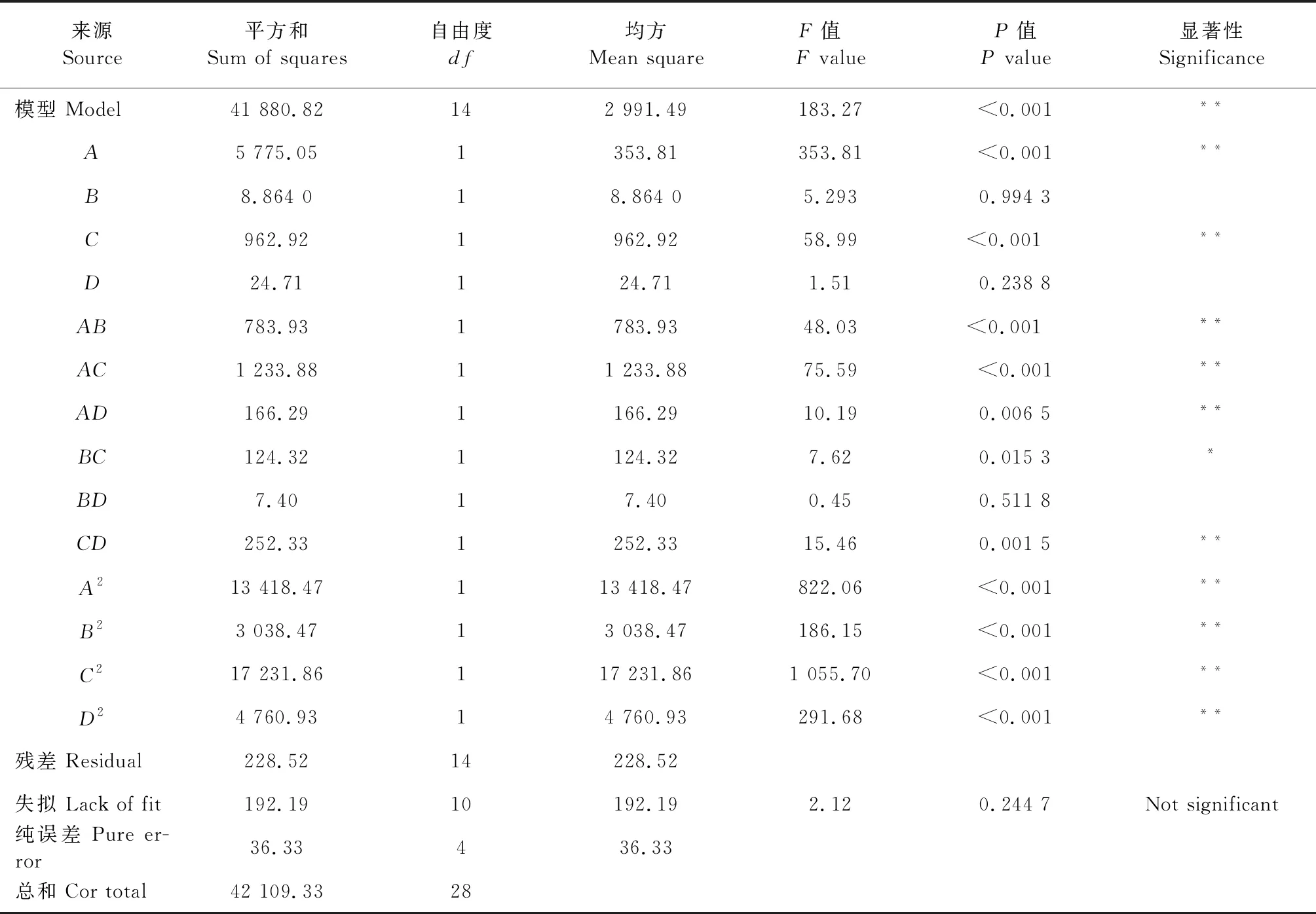
表3 改性后紫花苜蓿叶蛋白乳化性线性回归分析表
2.3 响应面3D分析图及最佳条件确定
根据回归方程得出不同因素交互作用的响应面3D图,如下图5所示。
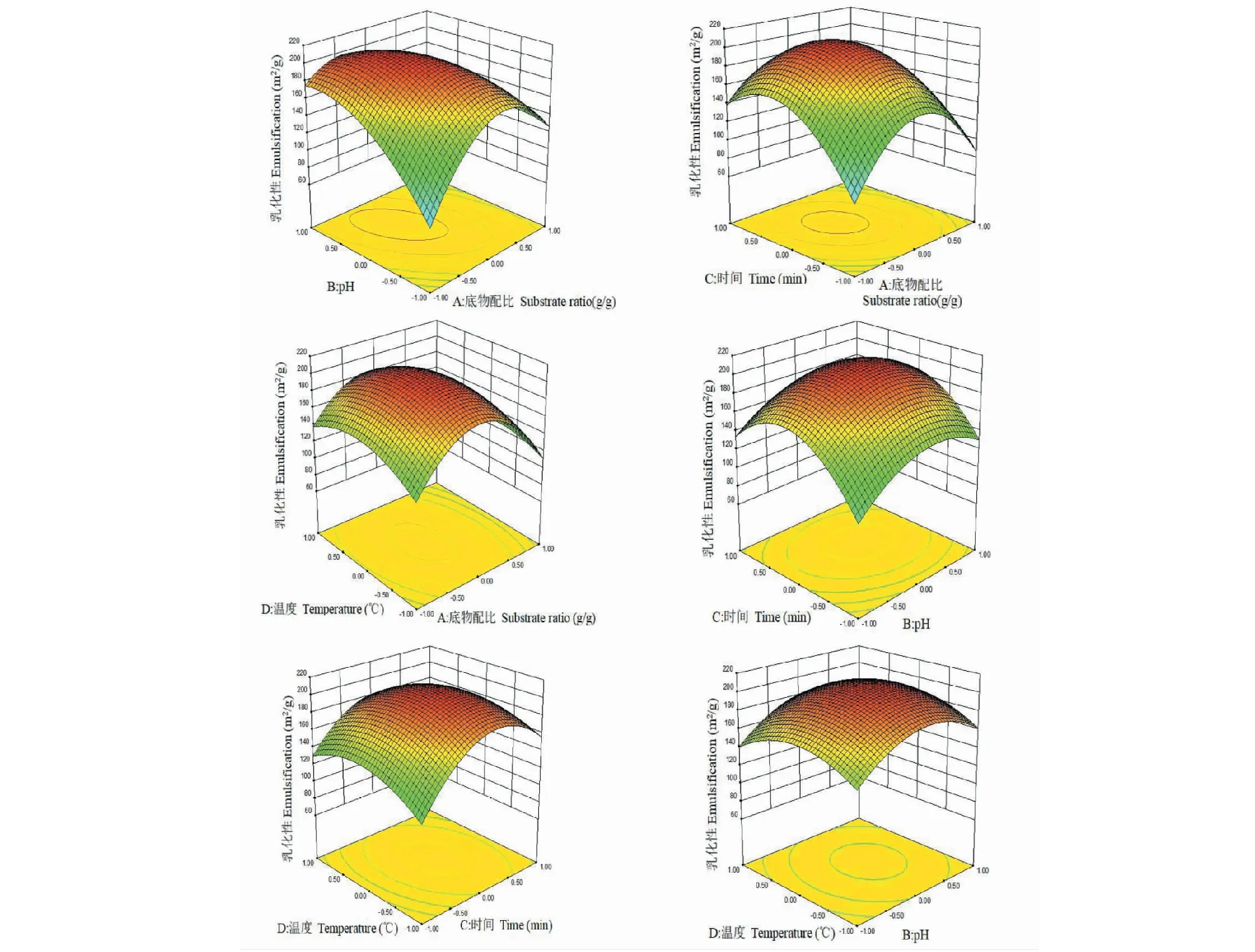
图5 两因素相互作用对改性后ALPCs乳化性影响的响应面图Fig.5 Response surface plots for the effect of the interaction of two factors on the emulsification of ALPCs after modification
根据拟合模型得出:当反应pH值为8.47,反应时间为123.63 min,反应温度为89.62 ℃,底物配比为1∶1.07时,ALPCs的乳化性达206.94 m2/g,为了验证模型的可靠性,从实际情况出发,对最佳条件进行调整:选取反应pH值为8.0,反应温度为90 ℃,反应时间为124 min,底物配比[m(ALPCs)∶m(FG)]为1∶1作为最佳反应条件,最优条件下进行三次平行验证试验,得到改性后ALPCs乳化性为200.78 m2/g,与理论预测值的相对误差为3%,表明结果可行,该模型结果与模拟结果基本一致。在此条件下的接枝度达23.9%,优化后的ALPCs乳化性比未改性的ALPCs乳化性提高了12.20%,乳化稳定性提高至31.06 min,比未改性蛋白提高了31.83%。
2.4 傅里叶红外光谱分析
ALPCs和FG价接后,蛋白质分子中羟基含量增加,3 500~3 200 cm-1是-OH 的特征官能团吸收峰,3 200~2 800 cm-1是C-H的特征伸缩振动吸收峰。蛋白质的特征官能团吸收峰是:酰胺Ⅰ带-NH的特征吸收峰,其位置在1 690~1 630 cm-1之间;酰胺Ⅱ带-NH的弯曲振动吸收峰,其位置在1 530~1 560 cm-1之间;酰胺Ⅲ带 分别是C-N和N-H的弯曲振动吸收,其特征峰在1 240~1 450 cm-1之间。从红外图(图6)中可以看出FG在3 390~3 429 cm-1处具有较宽的吸收峰,在2 930 cm-1处有C-H伸缩振动峰。图中两个峰比较得出:酰胺Ⅰ带处的特征峰从1 643 cm-1移至1 653 cm-1;酰胺Ⅱ带处的特征吸收峰从1 521cm-1处移至1 514 cm-1;酰胺Ⅲ带的特征吸收峰从1 238 cm-1移至1 236 cm-1。由于发生蓝移现象导致吸收峰变小,改性后的ALPCs-FG在1 027 cm-1处有强的吸收峰,该吸收峰是糖分子中C-O-C官能团的伸缩振动同时也是糖环存在的特征吸收峰。说明糖基化反应可以提高复合物的乳化性和乳化稳定性[14]。

图6 ALPCs及ALPCs-FG红外光谱图Fig.6 FTIR spectra of ALPCs and ALPCs-FG
2.5 粒径分析
粒径的变化与ALPCs聚集程度及与FG反应的糖基化程度有关。两种物质的粒径分布如下,从图7中可以看出ALPCs-FG粒径比ALPCs的粒径大。本研究中ALPCs的粒径为603 nm,而ALPCs-FG的粒径为771 nm。表明糖基化反应显著增大了ALPCs-FG的粒径,该现象与Wang等[15]、Mou等[16]、Hu等[17]研究结果一致。主要原因可能是高温糖基化反应导致蛋白质发生热聚变[18],致使ALPCs-FG粒径增大。此现象与Rao等[19]的研究现象不一致,可能是由于蛋白成分不同,且乳液体系成分多而复杂。体系之间发生的反应都将影响粒径的变化,具体影响机理有待进一步研究讨论。但就本文而言,ALPCs-FG的乳液微粒显著大于ALPCs,FG和ALPCs发生糖基化反应形成了共价键,糖基化反应通过对ALPCs的包覆提高了乳液的稳定性[17]。由于嫁接的亲水性多糖能够在蛋白质表面迅速吸附,形成水-油膜层厚度增大[20],对维持整个体系的乳化稳定性也有作用。此外,ALPCs-FG共价复合物的空间位阻效应会对乳液中液滴的聚集和大液滴的形成起到抑制作用,从而进一步提高其有乳液的乳化性和稳定性[21],可见糖基化反应对修饰后的共价复合物乳化性及乳化稳定性有所提高。
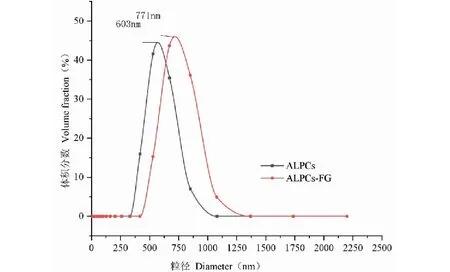
图7 ALPCs及ALPCs-FG粒径分布图Fig.7 Diameter distribution of ALPCs and ALPCs-FG
2.6 X-射线衍射分析
XRD衍射图谱主要是由结晶衍射形成的尖峰与无定形区域组成的。ALPCs和ALPCs-FG的衍射图谱如图8所示。ALPCs的衍射图谱在2θ=11.500,2θ=290处有两个强峰,在2θ=20.600和2θ=23.300处有两个弱峰。ALPCs-FG在2θ=11.600和2θ=29.400处有两个强峰,在2θ=20.600,2θ=23.100,2θ=27.400和2θ=31.800处出现了四个弱峰,表明经过美拉德反应后的产物结晶结构发生了显著的变化。糖基化产物的结晶结构越来越趋于无定形结构,这与Li等[22]的研究现象一致。经过jade软件对X射线衍射图谱进一步分析后结果表明:ALPCs的晶粒尺寸范围在348~534 nm,而ALPCs-FG的晶粒尺寸范围在422~537 nm。主要原因可能是蛋白质与多糖的糖基化反应增加了蛋白质聚合链的分子流动性,进而扰乱了蛋白质分子内部的排列次序,降低了空间位阻效应,导致晶粒尺寸增大[23]从而进一步提高复合物的乳化性和乳化稳定性。有关报道也表明糖基化反应可以增加复合物的晶粒尺寸[24]。
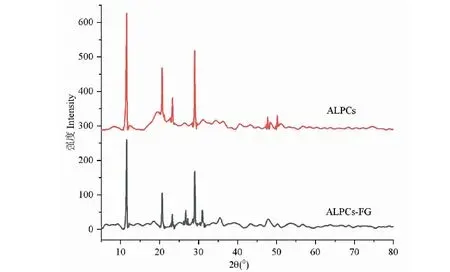
图8 ALPCs和ALPCs-FG的XRD谱图Fig.8 XRD spectra of ALPCs and ALPCs-FG
2.7 扫描电镜分析
蛋白质的结构在一定程度上与蛋白质所持有的功能性质有着很大的联系。用扫描电镜观察他们的颗粒特征。如图9所示,ALPCs是一种无序不规则的颗粒结构,表面凹凸不平,有空洞现象。当与FG发生糖基化反应时,其表面微观结构发生了显著变化,后者结构表面密集程度增加,ALPCs不规则颗粒的刚性结构消失,形成了表面无定形的颗粒[25]。因此,可以推断出由于多糖分子(FG)与ALPCs发生糖基化反应,导致蛋白肽链断裂分子扩散,进而有利于多糖分子嵌入蛋白空隙中,使得共价复合物表面更加紧密。有关研究表明随着多糖分子的引入增加了乳液的粘度,使得蛋白质肽链之间的相互作用减弱,空间位阻效应降低,表明糖基化反应对乳液的乳化性和乳化稳定性有明显的改善作用[26]。

图9 不同比例尺寸下ALPCs和ALPCs-FG的SEM图Fig.9 SEM of ALPCs and ALPCs-FG in different scale sizes
3 结论
本研究通过BOX-Behnken响应面法优化制备ALPCs-FG共价复合物,最优条件为:pH值为8.0,温度为90 ℃,反应时间为124 min,底物配比[m(紫花苜蓿叶蛋白)∶m(亚麻籽胶)]为1∶1作为最佳反应条件时乳化性最好。该条件下产物的乳化性最显著可达200.78 m2/g,与未改性的蛋白相比乳化性提高了12.20%。乳化稳定性提高了31.83%,最优条件下的接枝度达23.9%。对其ALPCs-FG结构表征分析发现:红外图谱中存在糖环结构,表明FG成功嫁接在紫花苜蓿叶蛋白上;粒径分析结果表明糖基化反应使得粒径增大;X-射线衍射图谱表明了复合物晶粒尺寸发生了变化,说明糖基化反应发生;扫描电镜结果表明复合物表面密集程度增加且结构不定型。综上分析,糖基化反应可以显著提高ALPCs-FG的乳化性和乳化稳定性。
