基于网络药理学和分子对接探讨黄芪抗肝癌的作用机制研究
2021-07-07任晋宏侯宇芯王禹璇薛慧清李青山
姚 红,任晋宏,侯宇芯,王禹璇,薛慧清,李青山
山西中医药大学 基于炎性反应的重大疾病创新药物山西省重点实验室,太原 030619
黄芪为豆科植物蒙古黄芪和膜荚黄芪的干燥根,产于中国东北、华北及西北,具有补气升阳,益卫固表,利水消肿,消毒排脓之功效[1]。研究表明通过各种癌症模型和细胞系,已发现黄芪能对肿瘤细胞直接抗增殖或促凋亡作用来缩小或稳定肿瘤[2]。黄芪注射液对不同时期的肝癌均具有一定程度的抑制细胞增殖活性作用,具体机制为,黄芪注射液通过G1/S期阻滞和caspase-9/3途径激活抑制细胞增殖活性并诱导细胞凋亡,从而抑制肝癌的发展[3]。黄芪注射液中分离得到黄酮类、皂苷类、蒽醌类和芳香烃等其它化合物[4]。总结了近年黄酮类化合物在抗肿瘤作用机制及药效学方面的进展[5],其抗肝癌作用靶点及机制尚不完全明确,本文运用网络药理学方法搜集出黄芪中潜在的有效物质,并对抗肝癌作用靶点及药效进行研究,为后期黄芪抗肝癌分子机制的实验研究提供理论依据。
肝癌是世界上最常见的恶性肿瘤之一,在全球范围内居第二位。在肝癌的早期阶段,手术切除,肝移植,局部消融和其他治疗方法可以提高患者的生存率[6]。肝癌是一种多基因疾病,具有复杂的发病机制和信号转导途径,单一的治疗方式很难取得成功的治疗效果。因此,利用靶向药物调控多种信号通路已成为肝癌治疗的新范式[7]。
1 材料
1.1 实验细胞株
人源肝癌细胞株HepG2为山西中医药大学科研实验中心细胞室保存。
1.2 药品与试剂
药品:槲皮素(货号MB2127:大连美仑生物技术有限公司研制);山奈酚(货号MB6888:大连美仑生物技术有限公司研制);毛蕊异黄酮(货号MB6778:大连美仑生物技术有限公司研制);华良姜素(货号B30148:上海源叶生物科技有限公司);芒柄花素(货号485723:大连美仑生物技术有限公司研制);异鼠李素(货号S9111:selleckchem)
试剂:胎牛血清与DMEM高糖培养基(美国Gibco);青-链霉素与胰蛋白酶(博士德生物工程有限公司);MTT与DMSO(北京索莱宝科技有限公司);Trizol、扩增与逆转录试剂盒(日本TaKaRa公司)。
1.3 仪器
生物安全柜、CO2培养箱(新加坡ESCO公司);离心机(中国中科中佳公司);荧光定量PCR仪(美国Thermo公司);Multiskan FC酶标仪(美国赛默飞世尔科技公司);
2 方法
2.1 数据库及软件
本研究使用的数据库有,PubChem (https://pubchem.ncbi.nlm.nih.gov/ ),String (https://string-db.org/cgi/input.pl),TCMSP(http://lsp.nwu.edu.cn/tcmsp.php),Genecards (https://www.genecards.org),Uniprot(https://www.uniprot.org),OMIM(http://www.omim.org),微生信(www.bioinformatics.com.cn),PBD(http://www.rcsb.org),VENNY2.1.0(https://bioinfogp.cnb.csic.es/tools/venny),Swiss Target prediction(http://www.swisstargetprediction.ch),和DAVID 6.7(https://david.ncifcrf.gov);软件有GraphPad 5.0;Cytoscape 3.7.2及SYBYL-X 2.0。
2.2 黄芪化学成分筛选及作用靶点预测
运用中药系统药理学数据库与分析平台(TCMSP)进行黄芪活性成分的查询及筛选。以生物利用度(oral bioavailability,OB)≥30%、类药性(drug-like,DL)≥0.18的化合物作为候选成分,查找每个活性成分以Drug Bank为参考范围的相关靶点。通过Unitprot数据库规范蛋白靶点名称。在PubChem数据库中根据成分名称查询相应的SMILES号且在Swiss Target Prediction数据库根据SMILE号预测活性成分对应的靶点。所有主要活性成分经过预测、检索和校对去重后,确认与主要活性成分相关的靶蛋白信息。把TCMSP平台中的靶点与Swiss Target Prediction数据库中的靶点合并删除重复值。
2.3 肝癌疾病靶点的预测
利用Genecards数据库及OMIM数据库网站检索以“liver cancer”为关键词,其中Genecards以Relevance score≥20为参考值,获取疾病肝癌相关的基因。
2.4 黄芪活性成分与关键靶点相映射构建核心靶点作用网络
获得黄芪活性成分的对应靶点以及肝癌的靶点蛋白之后,取两者的交集靶点蛋白,在String数据库绘制蛋白-蛋白相互作用PPI网络,用Cytoscape 3.7.2软件进行蛋白网络结构可视化处理。使用插件CytoNCA来评估交叉点。CytoNCA提供了三种中心度度量来过滤数据,包括度中心度(degree centrality,DC)、接近度中心度(closeness centrality,CC)及中间中心度(betweenness centrality,BC)。首先,对数据进行“DC≥2×DC中位数”的筛选标准,然后通过“DC,BC和CC大于或等于其中位数”的筛选标准将其筛选为核心目标[8]。
2.5 核心靶点基因功能富集和通路富集分析
采用DAVID 6.7数据库[9]对黄芪抗癌靶点进行基因生物过程(GO)富集分析与信号通路(KEGG)富集分析,限定物种为Homo sapiens,获得GO功能富集分析结果(P<0.05)及KEGG 信号通路富集分析结果(P<0.05),利用微生信平台对KEGG通路和GO富集分析进行可视化分析。利用Cytoscape 3.7.2软件构建“黄芪成分-靶点-KEGG通路-肝癌” 网络。
2.6 药物成分-核心靶点分子对接
筛选出的主要活性成分通过PubChem下载其“SDF”格式,导入SYBYL-X 2.0软件进行优化修饰;将“1.4”项下筛选的主要蛋白靶点通过PDB数据库。筛选条件设定如下:1)通过X-晶体衍射获得蛋白质结构;2)蛋白质的晶体分辨率均方根偏差(RMSD)值越小越好;3)分子对接文献中报道的蛋白质结构的优先选择;4)该生物来自Homo sapiens。选择其最佳蛋白晶体结构,并下载其“pdb”格式文件。导入Surflex-Dock软件[10]去除小分子配体、所有氨基酸及水分子,寻找蛋白靶点与活性成分靶点的最相接的小分子,对其加氢进行分子对接,通过对接分值来判断其结合活性。
2.7 MTT法验证
从山西医科大学成钟老师获得的人肝癌细胞株HepG2复苏,加入含10%胎牛血清与1%青-链霉素的DMEM培养基,放置于37 ℃,5% CO2培养箱中培养。
将HepG2接种到96孔板中,每孔细胞密度为0.8×104个。细胞贴壁后,分别加入100 μmol/L的槲皮素、毛蕊异黄酮、山奈酚、芒柄花素、异鼠李素及华良姜素,培养48 h。前期每孔加入浓度为0.1 mg/mL MTT在37 ℃黑暗中进行4 h的培养,在后期培养中,去除培养基,添加100 μL的DMSO。Multiskan FC酶标仪(检测吸光度OD值,波长490 nm)。
2.8 RT-qPCR分析
筛选出抑制效果较好的一个化合物进行定量RT-qPCR分析,将HepG2细胞加入3、15、75 μmol/L的华良姜素处理48 h。按照制造商的说明,使用Trizol试剂从HepG2细胞中提取总RNA。逆转录试剂盒将提取的RNA转录成cDNA。RT-qPCR的步骤如下:在95 ℃预变性15 min,在95 ℃变性10 s,在60 ℃退火20 s,在72 ℃延伸30 s,40个循环。
2.9 数据处理
结果通过统计学软件GraphPad 5.0进行处理,在方差齐性条件下采用单因素方差分析One-way ANOVA,P<0.05为显著性差异,P<0.01为极显著性差异。
3 结果
3.1 黄芪化学成分筛选及作用靶点预测
通过中药系统药理学数据库与分析平台(TCMSP)检索黄芪化学成分,以生物利用度(oral bioavailability,OB)≥30 %、类药性(drug-like,DL)≥0.18为筛选条件,得到20个黄芪化学成分,如表1,在TCMSP平台与Swiss Target Prediction数据库中的靶点,去重后得到202个靶点。

表1 黄芪活性成分信息

续表1(Continued Tab.1)
3.2 肝癌疾病靶点的筛选
以Genecards数据库及OMIM数据库进行检索,分别获取肝癌相关的疾病靶点1063个和441个,将上述肝癌相关靶基因与202个预测靶基因输入Venny 2.1.0数据库取交集和构建韦恩图(见图 1),获得共同靶基因88个,即黄芪潜在抗肝癌作用靶点。
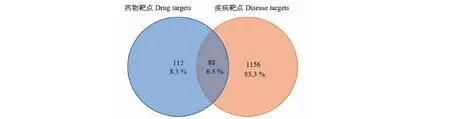
图1 黄芪潜在抗肝癌作用靶点筛选Fig.1 Screening of potential anti-liver cancer targets of Astragalus Radix
3.3 蛋白-蛋白互作PPI 网络构建
将上述88个靶基因上传至String平台,物种设定为“Homo sapiens”,其余参数默认,获得蛋白相互作用数据信息;然后导入Cytoscape 3.7.2软件中绘制PPI网络。PPI网络中共有88个节点(靶基因)通过473条边发生相互作用(见图2)。根据degree值来设定节点的大小和颜色深浅,靶基因的degree值越大相对应的节点越大和颜色越深,而2个靶基因之间关系值的评分(combine score)高低则由边的粗细表示,即combine score越高则边的线条越粗。使用CytoNCA通过拓扑分析对PPI网络的交叉点进行了中央网络评估,根据DC≥31、BC≥0.056和CC≥0.595 5总共筛选了6个潜在的核心目标(见表2)。通过拓扑与PPI分析结果表明TP53、MAKP1、AKT1、IL6、MAPK8及VEGFA可以被认为是黄芪抗肝癌的关键靶基因。且六个靶点相对应的黄芪活性成分有槲皮素、山奈酚、毛蕊异黄酮、芒柄花素、异鼠李素与华良姜素(如表3)。
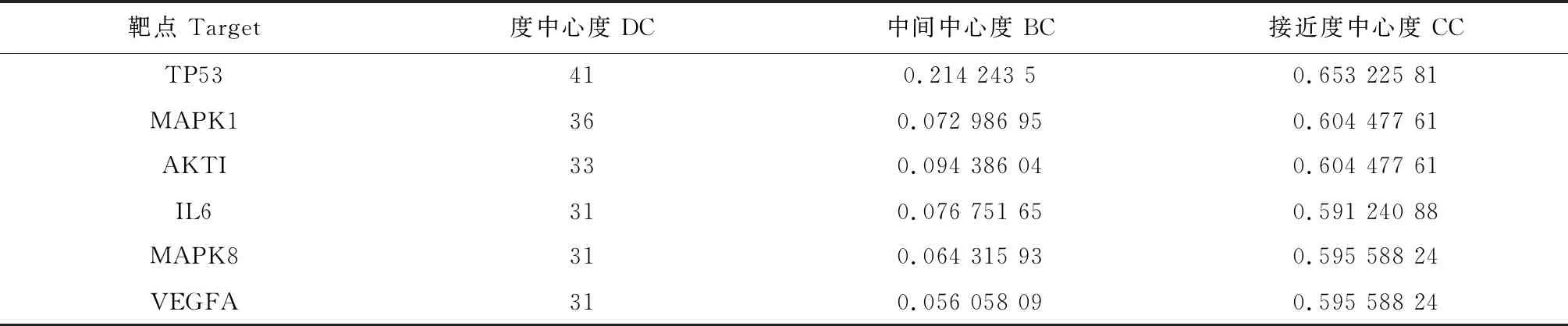
表2 6个潜在核心目标的拓扑参数
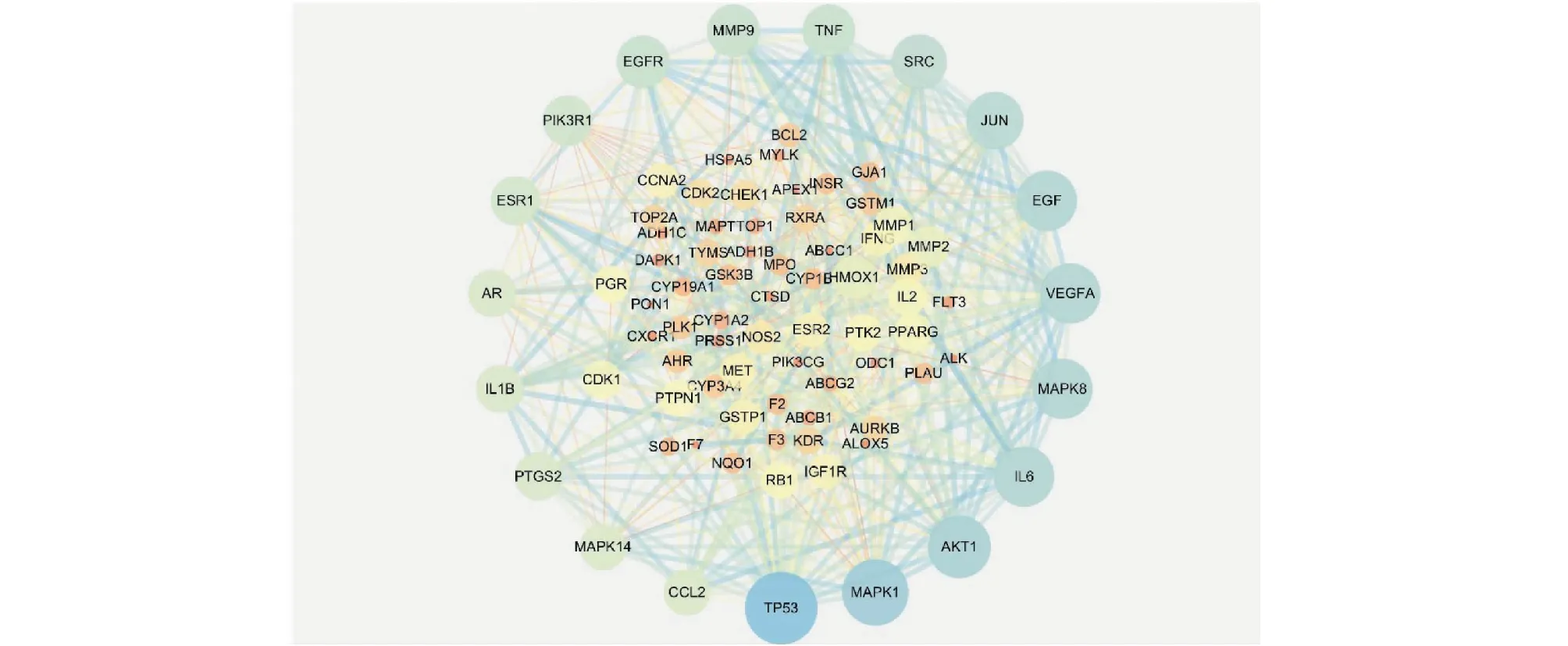
图2 黄芪潜在抗肝癌靶点 PPI 网络Fig.2 Astragalus Radix potential anti-liver cancer target PPI network

表3 关键靶点所对应的化合物
续表3(Continued Tab.3)
3.4 核心靶点GO功能富集和KEGG通路富集分析
将黄芪治疗肝癌88个靶点上传至DAVID生物信息在线数据库进行GO富集分析,以P<0.05作为蛋白质生物学功能具有显著性的反应,确定GO分析总数为487条,其中生物学过程(biological process,BP)372条,主要涉及序列特异性DNA结合转录因子活性的正向调控、凋亡过程的负调控、RNA聚合酶II启动子的转录正调控、炎症反应、细胞周期调节、细胞增殖调节等;细胞成分(cell component,CC)48条,涉及细胞核、细胞细胞质、细胞外空间、核染色质、RNA聚合酶II转录因子复合物等;分子功能(molecular function,MF)67条,与蛋白磷酸酶结合、染色质结合、转录调控DNA结合、细胞因子活性、MAP激酶活性等相关。均取排名靠前的10个条目作图(见图3)。
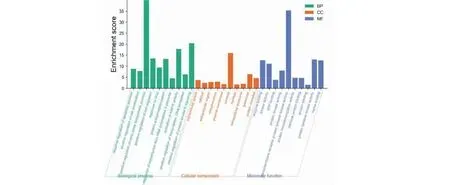
图3 黄芪活性成分潜在抗肝癌靶点的生物过程分析柱状图Fig.3 A histogram of the biological process analysis of the potential anti-liver cancer targets of the active ingredients of Astragalus Radix
黄芪抗癌靶点获得KEGG通路富集分析,得到100条通路(P<0.05),按富集基因数目排序后取前20条信号通路作图(见图4)。黄芪抗肝癌的主要靶点主要涉及PI3K-Akt 信号通路(20个靶点占23%)、Hepatitis B信号通路(15个靶点占18%)、HIF-1信号通路(13个靶点占16%)及肿瘤坏死因子TNF信号通路(13个靶点占16%)等。研究报道山奈酚通过下调AKT和FAK通路抑制肾癌细胞的侵袭和迁移[11]。黄芪提取物[12]通过PI3K/AKT/mTOR途径抑制细胞增殖和诱导细胞凋亡,证实了黄芪提取物的抗肿瘤作用。

图4 黄芪抗肝癌关键靶点参与的通路富集信息柱状图Fig.4 A histogram of information enrichment of pathways involved in key targets of Astragalus Radix anti-liver cancer
为了系统和全面地解释黄芪抗肝癌的作用机制,使用Cytoscape软件构建了药物化合物-核心靶点-通路-疾病网络(见图5)。结果如图5所示,6个黄芪主要活性成分节点、6个靶基因,20个KEGG信号通路节点。节点与节点的边代表发生相互作用的活性成分、肝癌靶基因和通路之间的联系,这些途径与6中心靶标紧密相互作用。

图5 “黄芪-成分-靶点-KEGG通路-疾病”网络Fig.5 "Astragalus Radix-components-targets-KEGG pathway-disease" network
3.5 活性成分-关键靶点分子对接
基于PPI网络的分析,选取黄芪中6个活性成分与6个核心靶点进行分子对接。在PDB数据库得蛋白ID编号为3q05(TP53)、1unq(AKT1)、4nif(MAPK1)、4nci(IL6)、4yr8(MAPK8)及4zff(VEGFA)。一般认为,Dock系统对接分数>4.25时,表明分子与靶点之间存在结合活性,对接分数>5.0证明结合活性较高,对接分数>7.0说明两者存在强烈的结合活性[13],对接分数≥7.0的活性成分利用Surflex-Dock软件绘制氢键图和飘带图(见图6),由图可见,槲皮素与TP53在SER-241、ARG-248、ARG-273、VAL-274、ALA-276、CYS-277和ARG-280处形成氢键;与MAPK1在THR-110、MET-108、LYS-114、ASP-111、GLN-105、ILE-103和LYS-54处形成氢键;异鼠李素与TP53在SER-240/SER-241、ARG-273、VAL-274、THR-284、ALA-276和ARG-280处形成氢键;与MAPK1在ASP-111、LYS-151、ASP-167,AR-67和ALA-35处形成氢键;与MAPK8在ARG-192、HIS-230、ASN-284和SER-249处形成氢键;山奈酚与MAPK1在THR-110、LYS-114、ASP-111、AEG-67、GLY-37、LYS-151和ASP-167处形成氢键;芒柄花素与MAPK1在LYS-54和SER-153处形成氢键;毛蕊异黄酮与MAPK1在ASP-167、ARG-67和LYS-114处形成氢键。华良姜素与MAPK1在LYS-54、LYS-151、LYS-153、ASP-111和LYS-114处形成氢键。
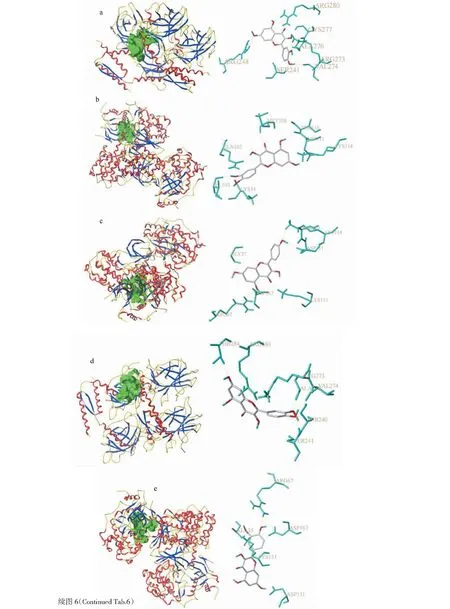

图6 黄芪活性成分-核心蛋白对接模式Fig.6 Astragalus Radix active ingredient-core protein docking mode注:a:槲皮素与TP53对接图(7.432 0);b:槲皮素与MAPK1对接图(7.034 0);c:山奈酚与MAPK1对接图(8.090 7);d:异鼠李素与TP53对接图(8.513 4);e:异鼠李素与MAPK1对接图(8.806 8);f:异鼠李素与MAPK8对接图(7.095 5);g:芒柄花素与MAPK1对接图(7.684 2);h:毛蕊异黄酮与MAPK1对接图(8.468 0);i:华良姜素与MAPK1对接图(7.794 4)。Note: a: Docking diagram of quercetin and TP53 (7.432 0);b: Docking diagram of quercetin and MAPK1 (7.034 0);c: Docking diagram of kaempferol and MAPK1(8.090 7);d: Docking diagram of isorhamnetin and TP53 (8.513 4);e: Docking diagram of isorhamnetin and MAPK1(8.806 8);f: Docking diagram of isorhamnetin and MAPK8(7.095 5);g: Docking diagram of formononetin and MAPK1 (7.684 2);h: Docking diagram of calycosin and MAPK1 (8.468 0);i: Docking diagram of jaranol and MAPK1(7.794 4).
3.6 MTT法
分子对接结果探究这6种黄芪活性成分对肝癌细胞HepG2的影响,采用MTT法初步筛选。在同一浓度下,与对照组相比,发现华良姜素对HepG2细胞抑制作用较强于其他五种活性成分(见图7),且P<0.001,表明华良姜素对HepG2细胞抑制作用有显著性差异,选出华良姜素进行后续实验分析。
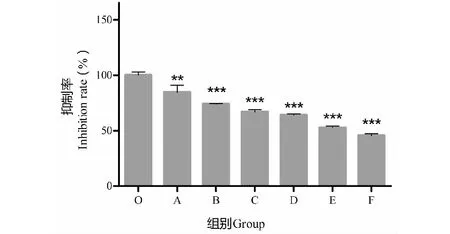
图7 黄芪6个活性成分对HepG2细胞的影响Fig.7 The effect of active components from Astragalus Radix on HepG2 cells注:与对照组相比,*P<0.05;**P<0.01;***P<0.001。O:对照组;A:山奈酚;B:毛蕊异黄酮;C:槲皮素;D:芒柄花素;E::异鼠李素;F:华良姜素。Note: Compared with control,*P<0.05;**P<0.01;***P<0.001.O: Control group;A: Kaempferol;B: Calycosin;C: Quercetin;D: Formononetin;E:Isorhmnetin;F: Jaranol.
3.7 RT-qPCR分析
通过荧光定量PCR检测TP53、MAPK1、AKT1、IL6、MAPK8与VEGFA基因的mRNA在加不同浓度的华良姜素后表达水平变化(见图8),6个基因均出现上调趋势,随着给药剂量的增加,mRNA的表达量增多。且给药组中高剂量基因变化有极显著(P<0.01)性差异。由此说明华良姜素对肝癌HepG2细胞有抑制作用
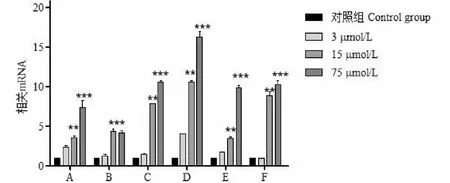
图8 不同浓度的华良姜素对6个基因mRNA表达含量Fig.8 Different concentrations of Jaranol on the mRNA expression of 6 genes注:与对照组相比,*P<0.05;**P<0.01;***P<0.001。a:APK1蛋白;b:MAPK8蛋白;c:IL6蛋白; d:TP53蛋白;e:VEGFA 蛋白;f:AKT1蛋白。Note: Compared with control,*P < 0.05;**P < 0.01;***P < 0.001.a: MAPK1 protein;b: MAPK8 protein;c: IL6 protein;d: TP53 protein;e: VEGFA protein;f:AKT1 protein.
4 讨论
黄芪是一种常用的补气药,研究表明黄芪提取物可能是一种潜在的抗肿瘤药物。道地药材恒山黄芪的多糖成分具有抑制人宫颈癌细胞Si Ha的增殖、粘附、铺展以及迁移运动的活性[14]。槲皮素是一种天然植物类黄酮,其生物活性已得到广泛研究,对白血病,乳腺癌,肝癌,卵巢癌,结直肠癌,胃癌和子宫内膜癌的恶性细胞生长具有明显的抑制作用[15]。经研究报道槲皮素通p53/Bcl-xl增强阿霉素介导的抗肝癌作用[16]。山萘酚通过下调miR-21和上调PTEN以及灭活PI3K/AKT/mTOR信号通路来抑制HepG2细胞的增殖,迁移和侵袭[17]。毛蕊异黄酮与异阿魏酸配伍组合是通过细胞周期调控因子cyclin D1、CDK6和p21介导的细胞周期调控来抑制HepG2细胞增殖[18]。
本研究通过TCMSP 筛选出黄芪20个有效成分,成分靶点与疾病靶点交集出88个共同靶点。经PPI网络与拓扑分析筛选出6个关键蛋白及相对应的6个单体化合物,经上述分子对接分数可知。成分与靶点具有一定的结合性,MAPK8/Fox O信号通路对于癌症和脂肪肝的发展非常重要。研究证实他莫西芬通过MAPK8/Fox O信号通路在乳腺癌细胞(MCF-7、T47D、ZR-75和MDA-MB-231)和肝细胞(LO2)中起作用。通过干扰MAPK8/Fox O信号传导途径诱导脂肪肝[19]。He等[20]研究表明,用脂多糖诱导乳腺炎小鼠,检测到MAPK信号通路中p38MAPK、ERK和JNK的磷酸化水平升高,参与炎症反应。黄芪蛋白通过影响p53信号通路导致HepG2细胞发生程序性坏死,从而导致肝癌细胞的生长受到抑制[21]。
靶点富集分析表明:黄芪可能通过凋亡过程的负调控、ATP结合、蛋白质复合物等生物功能及PI3K-Akt 信号通路、Hepatitis B信号通路、HIF-1信号通路及肿瘤坏死因子信号通路起抗肝癌作用。MTT结果显示6个化合物均对肝癌HepG2细胞有一定地抑制作用,RT-qPCR结果显示不同浓度的华良姜素均能使6个基因呈上调趋势,且与PI3K-Akt 信号通路、Hepatitis B信号通路、HIF-1信号通路及肿瘤坏死因子信号通路所涉及的基因一致。已确定PI3K-Akt信号通路在许多人类癌症中差异表达。例如,PIK3R1在肝细胞癌和肾癌中起抑癌作用[22]。Wu等[23]发现 TNF-α单体干预肝癌细胞中NF-κB活化,可使细胞凋亡增加,siRNA可通过特异性抑制NF-κB/p65编码的mRNA,下调P-gp水平,促进肝癌细胞凋亡。Chen 等[24]研究发现HBp / FOXO3 / miRNA-30b-5p / MINPP1轴通过糖酵解旁路促进HBV阳性HCC细胞的发育。还提出了miRNA-30b-5p / MINPP1作为HBV阳性HCC早期诊断的新型生物标志物和抗肿瘤治疗的潜在药物靶标。
基于网络药理学与分子对接,本研究阐述了中药黄芪治疗肝癌的有效活性成分、潜在作用靶点及发挥药效的生物学通路。实验验证为后续研究其药理作用机制实验验证奠定基础。
