鹑鸡肠球菌对万古霉素耐药性监测及耐药基因研究
2021-07-07周万青
谢 晖,周万青,沈 瀚
0 引 言
肠球菌是临床常见革兰阳性条件致病菌,可导致人体多器官感染。鹑鸡肠球菌(Enterococcusgallinarum,EG)作为肠球菌中少见菌种,近年来临床感染及分离率不断增加[1-3],可造成泌尿道、腹腔、胆道感染以及败血症等。而耐万古霉素肠球菌(vancomycin resistant enterococci,VRE)的不断检出[4-5],给临床该类感染带来极大挑战。造成耐药的决定基因包括vanA、vanB、vanC、vanD、vanM等,不同基因的表达可表现对万古霉素和替考拉宁的不同药敏结果[6],常见vanA介导屎肠球菌大多对万古霉素和替考拉宁呈高水平耐药。鹑鸡肠球菌一般携带染色体介导的万古霉素低水平耐药vanC基因,虽然体外药敏试验可呈现低水平耐药或敏感结果,但不建议临床使用。目前,已有对万古霉素高水平耐药鹑鸡肠球菌菌株临床报道,可能与vanA基因的获得有关[7]。因此,本研究调查我院临床分离鹑鸡肠球菌的耐药性及携带万古霉素耐药相关基因情况,为鹑鸡肠球菌耐药监测及耐药基因的流行提供理论依据。
1 材料与方法
1.1 菌株收集我院2019年1-12月临床分离非重复鹑鸡肠球菌15株,主要分离自分泌物(2株)、腹水(3株)、胆汁(4株)、尿液(3株)及血液样本(3株)。所有菌株均经Vitek 2 Compact GP板卡鉴定并经VITEK MS质谱复核。粪肠球菌ATCC51299、金黄色葡萄球菌ATCC25923、粪肠球菌ATCC29212为本实验室保存菌株。
1.2 主要试剂与仪器Vitek 2 Compact 全自动鉴定仪及配套 GP 鉴定卡、GP67 药敏卡(法国生物梅里埃公司);万古霉素 E-test 试纸条(郑州安图生物公司);DNA提取试剂盒及胶回收试剂盒[天根生化科技(北京)有限公司];2×Taq Mix(DBI 公司);营养肉汤(上海科玛嘉微生物技术有限公司);PCR 引物由上海生工生物有限公司公司合成;2720 Thermal Cycler PCR仪、ABI 3730XL基因测序仪(ABI公司);Gel-Doc XR型凝胶成像分析系统(美国Bio-Rad 公司)。
1.3 药敏试验采用 Vitek 2 Compact 配套 GP67 药敏卡检测菌株对常规药物敏感性。采用E-test法复核万古霉素最低抑菌浓度(minimum inhibitory concentration,MIC),判定标准参照美国临床和实验室标准协会CLSI 2019[8]。
1.4 DNA提取挑取纯培养菌落接种到营养液体培养基中,37 ℃ 180 r/min 16 h,采用DNA提取试剂盒提取菌液基因组DNA,具体操作依据试剂盒说明书进行。所提核酸用于全基因组测序及基因扩增。
1.5 PCR扩增和序列分析参照文献[9]方法合成万古霉素耐药相关基因vanA、vanB、vanC1及vanC2/3,引物序列见表1。反应体系20 μL:2×TaqMix 10 μL,DNA模板2 μL,上、下游引物 (10 μmol/L)各1 μL,ddH2O 6 μL。 PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 7 min。PCR产物经15 g/L琼脂糖凝胶电泳,阳性扩增产物经琼脂糖凝胶电泳后切胶回收,采用柱层析法纯化后经ABI 3730XL基因测序仪进行Sanger双向测序,正反向测序片段采用DNAMAN8软件拼接,结果经碱基局部对准检索工具(Basic Local Alignment Search Tool,BLAST)与GenBank进行比对,该部分由上海生工生物工程公司完成。

表1 万古霉素耐药基因的引物序列及产物大小
1.6 全基因组测序分析采用Illumina HiSeq 2000测序技术进行全基因组DNA测序,委托上海泽塔生物科技有限公司完成。简要步骤:对样本DNA进行双端测序(Paired-end,PE),构建450 bp 文库;对测序结果进行质量剪切后,利用MicrobeTrakr plus v. 0.9.1软件对序列进行拼接,得到最优的组装结果。采用GeneMarkS+v.4.11基因注释软件对测序结果进行预测。将预测得到的基因序列分别与KEGG、COG、GO数据库进行BLAST比对,获得预测基因的注释信息。利用Center for Genomic Epidemiology 网站 (http://www.genomicepidemiology.org)中的ResFinder3.2及PlasmidFinder 软件对耐药基因及质粒分型进行预测分析。
2 结 果
2.1 药敏试验结果15株鹑鸡肠球菌对青霉素、氨苄西林、高浓度庆大霉素、左氧氟沙星耐药率分别为20%、33.3%、33.3%、26.7%;对万古霉素的MIC值集中在4 mg/L和8 mg/L,所占比例分别为40%和33.3%,MIC中位数为4 mg/L,检出1株(6%)万古霉素高水平耐药株编号EG17906(MIC为256 mg/L);所有菌株对利奈唑胺敏感。编号EG17906菌株对替考拉宁(MIC为24 mg/L)耐药,对青霉素、氨苄西林、高浓度庆大霉素、左氧氟沙星均敏感。
2.2 耐药基因检测15株鹑鸡肠球菌中均检出vanC1基因;编号EG17906同时检出vanA基因。电泳结果见图1。
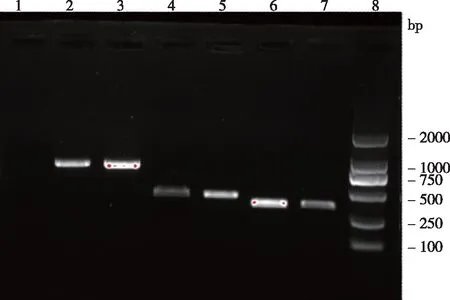
1:阴性对照;2、3: vanC1;4、5: vanA;6、7:van C2/3;8:Marker
2.3 全基因组测序分析EG17906基因组大小为3765197 bp,鸟嘌呤(Guanine, G)和胞嘧啶(Cytosine, C)所占的比率GC含量为40.4%,总基因数为3754,基因组含有3592个编码序列,60个tRNA编码基因以及10个完整的rRNA基因编码的操纵子,有160个重叠群,其中N50含量达到190271,同时有8个L50。耐药基因预测分析该菌株携带VanC1XY、VanHAX、erm(A)、erm(A)、tet(O)、cat(pC221)。全基因序列提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库,GeneBank号为JABMDB000000000。
3 讨 论
本研究结果显示,鹑鸡肠球菌对青霉素、氨苄西林、高浓度庆大霉素、左氧氟沙星的耐药率在35%以下;对万古霉素大多呈现为敏感或低水平耐药(MIC值集中在4 mg/L和8 mg/L),与该菌株天然携带vanC1基因相关。但仍有文献报道检出高水平耐药菌株[10]。本研究亦检出万古霉素高水平耐药菌株编号EG17906(MIC为256 mg/L),该菌株对万古霉素(MIC为256 mg/L)和替考拉宁(MIC为24 mg/L)耐药,对青霉素、氨苄西林、高浓度庆大霉素、左氧氟沙星均敏感。所有菌株对利奈唑胺敏感。
鹑鸡肠球菌的定植和感染流行率呈相关[11]。健康志愿者粪便样本鹑鸡肠球菌的携带率约为9%[12];另两个研究显示住院患者直肠拭子中鹑鸡肠球菌分离率分别为5.2%[13]和 1.2%[14]。而据日本2005-2014年回顾性研究,在肠球菌导致的血流感染中鹑鸡肠球菌占2.7%,是万古霉素耐药致肠球菌血流感染的第三大病因[15]。
肠球菌对糖肽类药物耐药可表现为VanA表型、VanB表型和VanC 表型。VanA表型一般由vanA基因介导,造成菌株对万古霉素和替考拉宁呈高水平耐药,VanB表型一般由vanB基因介导,造成菌株对万古霉素耐药而对替考拉宁敏感,VanC 表型菌株一般对万古霉素呈现出低水平的固有耐药,由vanC基因介导。vanA基因可存在于可接合传递的质粒上,并造成肠球菌间或葡萄球菌耐药基因的获得进而造成上述菌株对糖肽类药物的高水平耐药。作为染色体携带vanC基因的鹑鸡肠球菌,一般对万古霉素呈低水平耐药或体外敏感。但不断有文献报道同时携带vanA和vanC基因菌株造成的临床感染[10],表明糖肽抗性的表型和基因型特征可能并不总是一致的。而在本研究调查中,同样存在vanA和vanC1介导高水平万古霉素耐药的鹑鸡肠球菌,提示这种耐药菌株存在全球性的流行性。本院存在vanA介导耐药屎肠球菌的播散流行,对于鹑鸡肠球菌vanA基因的获得是否与屎肠球菌有关尚待研究。耐药表型与耐药基因一般呈现一致性。而目前耐药基因的确定一般采用PCR扩增及测序。本研究分离菌株经PCR检出vanA和vanC1基因,同时对该菌株进行全基因组测序同样验证了上述基因的存在,并发现vanA基因周围存在表达调控基因。
虽然目前临床未将万古霉素作为鹑鸡肠球菌的临床首选治疗药物,但仍不能放松对鹑鸡肠球菌在万古霉素等药物中的监测,以更早地发现可能存在的菌株播散,预防可能存在的耐药基因的水平传递或菌株的克隆播散。这一事实突出了严格执行抗生素政策以及更严格遵守感染控制措施,以防止耐抗生素细菌出现和传播的重要性。
