金花茶多糖分离纯化、结构表征及其体外抗氧化性
2021-07-06韦雅渊宁恩创
龚 雯 唐 婕 韦雅渊 宁恩创 韦 璐
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西农业职业技术学院,广西 南宁 530007)
金花茶(CamelliaNitidissimaChi)属山茶科山茶属,是国家一级保护植物,主要分布于中国广西壮族自治区[1]。由于含有特殊的色泽基因KNA,其花瓣呈金黄色半透明状,被人们誉为“茶族皇后”“植物界的大熊猫”[2]。金花茶叶含有茶多糖、茶多酚、皂苷、黄酮等功能性成分,具有抗氧化[3]、降血糖[4]、降血脂[5]、降血压[6]、护肝[7]等功能。
多糖(Polysaccharide)是一类对所有生物体都至关重要的生物大分子,在结构上由醛糖或酮糖通过糖苷键连接而成[8]。金花茶多糖已被证实具有保肝[7]、降血脂[9]、抗氧化活性[10]等功能,但有关金花茶多糖不同分级的抗氧化性比较与分析尚未见报道。研究拟采用水提醇沉的方法提取金花茶粗多糖,通过DEAE-阴离子交换法对金花茶多糖进行分级纯化,采用凝胶渗透色谱法(GPC)分析分子量,PMP柱前衍生高效液相色谱法分析单糖构成,傅里叶红外光谱法分析官能团,并对各多糖级分进行体外抗氧化活性分析,旨在为金花茶天然抗氧化剂的开发利用及金花茶高附加值产品的研发提供依据。
1 材料与方法
1.1 材料与试剂
金花茶叶干制品:广西桂人堂金花茶产业集团股份有限公司;
无水乙醇:分析纯,成都市科隆化学品有限公司;
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):分析纯,上海麦克林生化试剂有限公司;
双氧水、过硫酸钾、抗坏血酸、邻苯三酚、Tris-HCl:分析纯,国药集团化学试剂有限公司;
DEAE-52纤维素:上海源叶生物科技有限公司。
1.2 仪器与设备
电热恒温鼓风干燥箱:DZF6021型,上海精宏实验设备有限公司;
旋转蒸发仪:EYELA N-3000型,上海亚荣生化仪器厂;
电子天平:TLE204E型,梅特勒—托利多仪器上海有限公司;
数控超声波清洗机:JAC-300N型,山东省济宁市奥波超声电气有限公司;
紫外可见分光光度计:HP-845型,上海仪电分析仪器有限公司;
光栅型多功能微孔板检测仪(酶标仪):InfiniteM200PRO型,奥地利TECAN公司;
高效液相色谱仪:Waters2969型,安捷伦科技有限公司;
示差折光检测器:2414型,美国Waters Corporation公司。
1.3 试验方法
1.3.1 金花茶粗多糖提取 参照刘茜等[11]的方法并稍作修改。
金花茶叶干制品→剪切碾碎→热水浸提[料液比(m金花茶叶∶V蒸馏水)1∶55(g/mL),时间2.5 h,温度92 ℃]→旋蒸浓缩(浓缩比10∶1)→醇沉(4倍体积乙醇)→离心→复溶→Sevage法脱蛋白→聚酰胺树脂吸附脱色→离心过滤→透析→冷冻干燥→粗多糖
1.3.2 金花茶多糖分离、纯化 参照田晓春[12]的方法并稍作修改。配制15 mg/mL的金花茶粗多糖溶液10 mL,离心,取上清液缓慢加入2.6 cm×60 cm的DEAE-52 纤维素层析柱中,按流速15 mL/h,20 min/管,以去离子水、0.1,0.2,0.3,0.4,0.5 mol/L的NaCl溶液依次进行梯度洗脱。以管数为横坐标,吸光度为纵坐标绘制洗脱曲线,收集浓缩同一峰洗脱液,透析并冻干,获得多糖组分,按式(1)计算多糖回收率。
(1)
式中:
c——回收率,%;
m——回收样品质量,mg;
M——上样量,mg。
1.3.3 多糖组分理化指标测定
(1)总糖含量:采用苯酚硫酸法[13]。
(2)糖醛酸含量:采用咔唑硫酸法[14]。
(3)蛋白质含量:采用考马斯亮蓝法[15]。
(4)多酚含量:采用福林酚法[16]。
(5)还原糖含量:采用DNS法[17]。
1.3.4 金花茶多糖分子量分析 参照邵淑宏[18]的凝胶渗透色谱法(GPC)并稍作修改。超纯水配置1 mg/mL多糖溶液,过0.22 μm滤膜后待测。色谱条件:色谱柱为TSKgel-G400PWXL,RID-10A示差检测器,柱温为常温,流动相为超纯水,流速0.5 mL/min。
1.3.5 金花茶多糖单糖组成测定 参照黄小兰等[19]的PMP柱前衍生高效液相色谱法并稍作修改。
(1)多糖水解:取金花茶多糖约10 mg,加入2 mol/L的硫酸溶液2 mL,105 ℃水浴6 h,加入4 mol/L的氢氧化钠溶液2 mL,备用。
(2)衍生化:取单糖标准品溶液、金花茶多糖水解储备液、单糖混合物标准液各400 μL,加入0.5 mol/L的PMP甲醇溶液200 μL,0.3 mol/L的NaOH溶液200 μL,混匀。70 ℃水浴100 min,冷却至室温,添加0.3 mol/L的盐酸200 μL中和溶液。添加氯仿1 mL,涡旋混匀30 s,静置,弃下层。反复萃取3次,取水层溶液过0.22 μm 滤膜,待HPLC进样分析。
(3)色谱条件:色谱柱为VenusilMP-C18,2.1 mm×30 mm,5 μm,采用Agilent 1200色谱系统,测定波长250 nm,柱温30 ℃,流量1 mL/min,流动相为0.05 mol/L 的磷酸盐缓冲溶—乙腈(V磷酸盐缓冲液∶V乙腈为83∶17),样本数量15 μL,持续时间80 min。
1.3.6 傅里叶红外光谱 称取干燥样品1 mg,加入约100 mg KBr研磨并封闭样品颗粒,制成透明压片,于400~4 000 cm-1内进行光谱扫描。
1.3.7 金花茶多糖的抗氧化性
(2)
式中:

A0——邻苯三酚自氧化速率;
AX——加入金花茶多糖后邻苯三酚自氧化速率。
(2)ABTS+·清除能力:参照文献[21]。按式(3)计算ABTS+·清除率。
(3)
式中:
C2——ABTS+·清除率,%;
As——样品组吸光值;
A0——空白组吸光值。
(3)DPPH·清除能力:参照文献[21]。按式(4)计算DPPH·清除率。
(4)
式中:
C3——DPPH·清除率,%;
As——样品液组吸光值;
Ab——样品对照组吸光值;
Ac——空白组吸光值。
(4)·OH清除能力:参照文献[21]。按式(5)计算·OH 清除率。
(5)
式中:
C4——DPPH·的清除率,%;
As——添加样品溶液和水杨酸钠溶液组的吸光值;
Ab——不添加水杨酸钠溶液,而用 0.3 mL去离子水取代组的吸光值;
Ac——用去离子水代替样品溶液组的吸光值。
1.4 数据处理
各试验均重复3次,采用SPSS 19.0和Origin 10.0软件对试验数据进行分析和作图,并计算半数抑制浓度IC50值。
2 结果与分析
2.1 金花茶多糖的分离纯化
以DEAE-52纤维素对金花茶粗多糖进行分离,得到洗脱曲线如图1所示。将洗脱液中含量较多的多糖分别收集、浓缩、透析、冻干后得到3个多糖级分,分别为去离子水洗脱的TPS1、0.2 mol/L NaCl溶液洗脱的TPS2、0.3 mol/L NaCl溶液洗脱的TPS3,测定其理化指标和回收率见表1。由表1可知,各多糖级分的中性糖和酸性糖含量存在差异:TPS1中中性糖成分较多,TPS2和TPS3中糖醛酸含量较高,且糖醛酸含量TPS3>TPS2。这可能是因为洗脱液盐浓度越高,得到的多糖酸性强度越强,糖链上含有的酸性基团如硫酸基、羧基也越多[22-23]。

表1 TPS1、TPS2、TPS3的化学组成及回收率†

图1 金花茶粗多糖的洗脱曲线
2.2 金花茶多糖的平均分子质量
采用凝胶渗透色谱(GPC)测定TPS1、TPS2、TPS3的纯度及分子量,用葡聚糖标准品建立的校正曲线方程为:lgMw=-0.008 7t3+0.366 3t2-5.304 6t+31.37,R2=0.999 6。由图2可知,TPS1是由两个不同分子量(1.55×105,1.05×104Da)的组分构成的混合多糖,TPS2和TPS3为均一组分,分子量分别为4.21×105,6.67×105Da。

图2 TPS1、TPS2和TPS3的GPC分析图谱
2.3 金花茶多糖的单糖构成
采用PMP柱前衍生高效液相色谱法测得TPS1、TPS2和TPS3的单糖构成如表2所示,图3为8种单糖标准品混合的PMP衍生物及3种金花茶多糖的HPLC图谱。由表2、图3可知,3种金花茶多糖级分的单糖种类及比例存在差异:TPS1主要由葡萄糖、半乳糖、阿拉伯糖构成,且未检出葡萄糖醛酸和半乳糖醛酸成分;TPS2与TPS3主要由鼠李糖、半乳糖醛酸、半乳糖、阿拉伯糖构成,TPS3中半乳糖醛酸摩尔百分比高于TPS2。
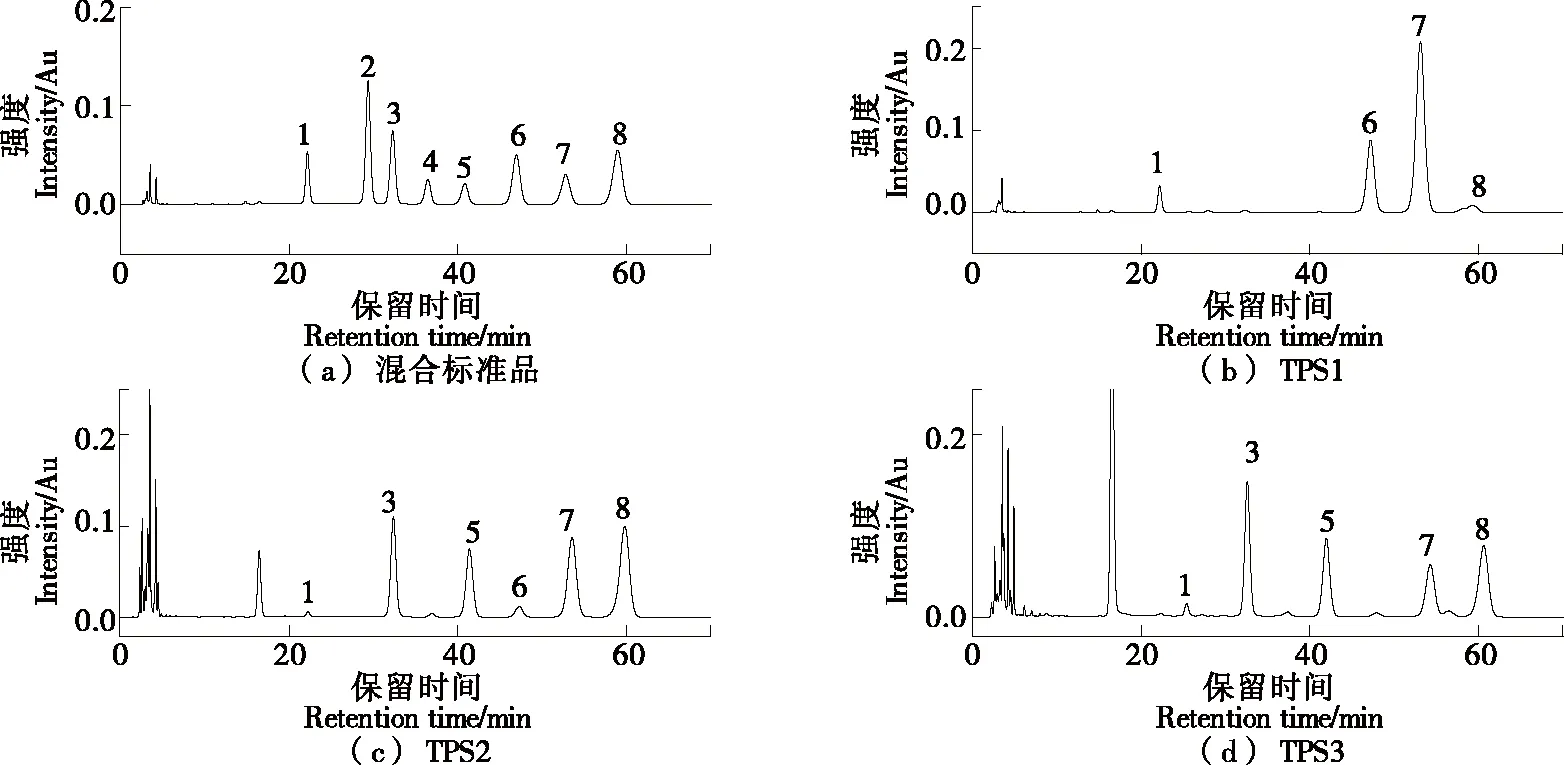
1.甘露糖 2.核糖 3.鼠李糖 4.葡萄糖醛酸 5.半乳糖醛酸 6.葡萄糖 7.半乳糖 8.阿拉伯糖
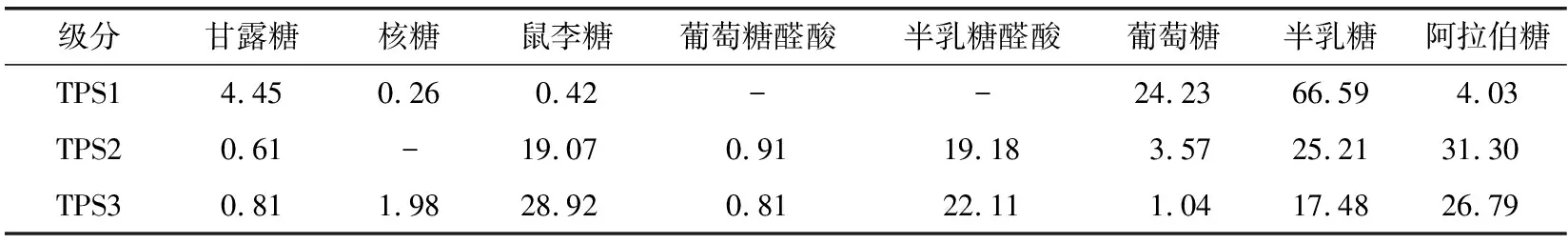
表2 TPS1、TPS2、TPS3的单糖组成
2.4 金花茶多糖的傅里叶红外光谱


图4 TPS1、TPS2和TPS3的红外光谱图
2.5 金花茶多糖的抗氧化性
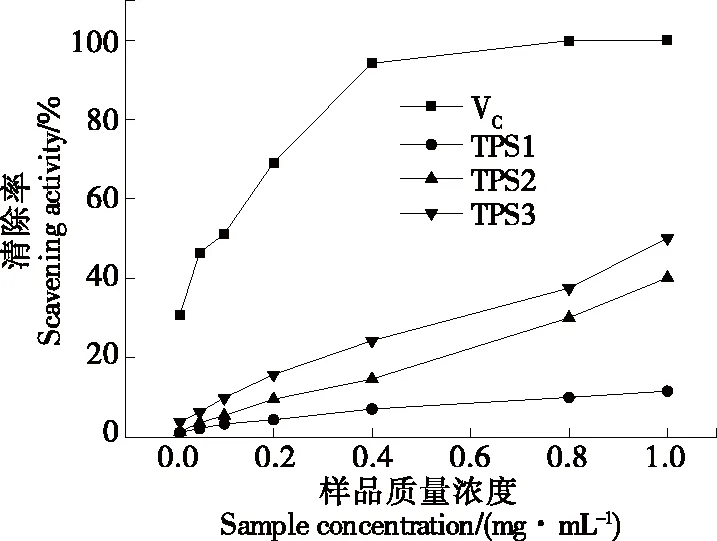
图5 样品对的清除率
2.5.2 ABTS+·清除能力 由图6可知,TPS1、TPS2和TPS3对ABTS+·具有一定的清除能力,且呈剂量依赖关系。当多糖质量浓度为1 mg/mL时,TPS1、TPS2、TPS3和维生素C对ABTS+·的清除率分别为42.31%,62.27%,69.96%,94.79%,对ABTS+·清除能力的IC50值依次为TPS1(1.742 mg/mL)>TPS2(0.749 mg/mL)>TPS3(0.534 mg/mL)>维生素C(0.018 mg/mL)。叶润等[29]研究发现,油菜叶多糖对ABTS+·清除能力的IC50值为1.63 mg/mL;岳峥嵘等[30]研究发现,铆钉菇多糖对ABTS+·清除能力的IC50值为10.28 mg/mL。综上,金花茶多糖具有一定的ABTS+·清除能力,其中TPS3的最佳。

图6 样品对ABTS+·的清除率
2.5.3 DPPH·清除能力 由图7可知,TPS1、TPS2和TPS3对DPPH·具有较好的清除能力,且呈明显的剂量依赖关系。当多糖质量浓度为1 mg/mL时,TPS1、TPS2、TPS3和维生素C对DPPH·清除率分别为44.30%,65.10%,71.95%,99.90%,对DPPH·清除能力的IC50值依次为TPS1(1.748 mg/mL)>TPS2(0.725 mg/mL)>TPS3(0.557 mg/mL)>维生素C(0.006 mg/mL)。陈浩[31]研究表明普洱茶多糖对DPPH·清除能力的IC50值为1.45 mg/mL;张阳等[32]研究发现,南酸枣多糖对DPPH·清除能力的IC50值为3.08 mg/mL。综上,金花茶多糖具有较好的DPPH·清除能力,其中TPS3的最佳。

图7 样品对DPPH·的清除率
2.5.4 ·OH的清除能力 由图8可知,TPS1、TPS2和TPS3具有较好的·OH清除能力,且呈明显的量效关系。当多糖质量浓度为1 mg/mL时,TPS1、TPS2、TPS3和维生素C对·OH的清除率分别为56.15%,77.28%,84.56%,89.40%,对·OH清除能力的IC50值依次为TPS1(0.989 mg/mL)>TPS2(0.583 mg/mL)>TPS3(0.233 mg/mL)>维生素C(0.012 mg/mL)。石玉涛[33]研究发现,·OH清除率最高的茶多糖其IC50值为1.14 mg/mL;熊磊等[34]研究发现黄金茶多糖对·OH清除能力的IC50值为1.713 mg/mL。综上,金花茶多糖具有较强的·OH清除作用,且TPS3较TPS2和TPS1具有更强的清除能力。

图8 样品对·OH的清除率
TPS1、TPS2和TPS3均具有一定的抗氧化性,但较阳性对照维生素C组存在一定差距,而这种差距来源于维生素C和多糖提供氢质体及接收电子程度的难易程度[35]。3种金花茶多糖级分TPS1、TPS2和TPS3的抗氧化性各不相同,抗氧化性TPS13 结论

