不同PPIs联合莫沙必利、铝碳酸镁治疗GERD合并食管裂孔疝的临床疗效观察
2021-07-06李美荣王晓伟牛美娜王海翠朱双双
李美荣,王晓伟,牛美娜,王海翠,朱双双
0 引言
胃食管反流病(Gastroesophageal reflux disease,GERD)是指胃内容物反流进入食管、口腔或肺而引发的特异性症状和/或并发症,为消化系统常见病,近年来我国患病率呈上升趋势,部分地区已接近欧美国家[1]。GERD病因复杂,是多因素作用的结果。食管裂孔疝(Hiatal hernia,HH)是指膈肌薄弱和食管裂孔扩大而引发的腹腔内脏器进入胸腔所致的病变。HH可减弱食管抗反流防御机制和酸清除能力,是 GERD发病及进展的重要影响因素[2]。研究表明,GERD合并HH与未合并HH的GERD相比,患者的反流、酸暴露症状更严重,发生食管狭窄、消化道溃疡等并发症的风险更大[3]。质子泵抑制剂(Proton pump inhibitors,PPIs)是治疗GERD的首选药物,2019共识意见[4]建议,对于难治性GERD,应加大PPIs的用药剂量,同时为了更好地控制症状及促进黏膜愈合,治疗周期应至少延长至8周。临床实践发现,有些患者对部分PPIs的反应性差,症状消除不明显,复发率高,临床疗效不令人满意。因此,如何选择PPI 药物以优化 PPI 治疗,是临床研究的热点之一。本研究拟通过观察不同种类PPIs联合胃肠动力药莫沙必利、铝碳酸镁治疗GERD合并HH的疗效,为合理使用PPIs提供参考依据。
1 资料与方法
1.1 一般资料 选取2017年3月至 2019年8月我院120例GERD合并HH患者,所有患者均符合《新编食管病学》[5]中GERD及HH诊断标准。纳入标准:①24 h食管pH值监测提示有病理性酸反流,与患者反酸、烧心等症状有关;②高分辨率食管测压显示下食管括约肌压力低于正常,抵御反流功能减弱;③胃镜检查发现HH,存在胸闷、咳嗽、哮喘等食管外症状;④检查前1周内停止使用抗酸药及胃动力药;⑤年龄18岁以上;⑥患者对检查和治疗的依从性高。排除标准:①有严重心肺肝肾等疾病、消化系统器质性病变、恶性肿瘤、凝血机制异常、腹部手术史;②近2周持续使用糖皮质激素、钙拮抗剂治疗;③对所用药物难以耐受;④妊娠期、哺乳期妇女。
将纳入患者按照随机数字表法分为研究组和对照组,各60例。研究组,男37例,女23例;年龄23~71岁,平均(46.98±17.26) 岁;病程3.5~7年,平均(6.45±1.38)年;类型包括滑动型49例、食管型7例、混合型2例、巨大型2例。对照组,男38例,女22例;年龄 22~70岁,平均(45.69±18.07)岁;病程4~8年,平均(6.27±1.29)年;类型包括滑动型51例,食管型5例,混合型3例,巨大型1例。两组患者一般资料比较,差异无统计学意义(P>0.05)。
1.2 治疗方法 所有患者治疗期间以易消化、低刺激食物为主,适当摄入高蛋白类食物,少食多餐,用餐后避免弯腰、平卧。对照组餐前口服兰索拉唑肠溶片(汕头鮀滨制药厂,规格:15 mg/片,国药准字 H10980136),30 mg/次,1次/d;餐前口服枸橼酸莫沙必利(商品名:瑞琪,江苏豪森药业,规格:5 mg/片,批号:20171109) 5 mg,3次/d;同时口服铝碳酸镁咀嚼片(商品名:达喜,拜耳医药保健有限公司,规格:0.5 g/片,批号:20160310) 1 g,3次/d,餐后1 h嚼服。疗程8周。研究组餐前口服埃索美拉唑镁肠溶片(阿斯利康制药公司,规格:20 mg/片,国药准字H20046380),40 mg/次,1次/d;同时口服枸橼酸莫沙必利和铝碳酸镁。疗程8周。
1.3 疗效评定标准 根据内镜黏膜分级及临床症状评分进行疗效评定。内镜分级判断标准:黏膜正常为0 级;点条状糜烂2 处以下为Ⅰa级;点条状糜烂2 处或以上为Ⅰb 级;有条状糜烂,融合率75%以下为Ⅱ级;糜烂呈全周性,融合率75%及以上为Ⅲ级[6]。根据反酸、烧心、胸痛等典型症状的严重程度及发生频率进行临床症状评分。无烧心、反酸、胸骨后不适等症状为0分;有轻微临床症状,每月均发生为1分;有较明显临床症状,每周均发生为2分;有很明显临床症状,且每天均发生为3分[7]。临床症状积分降低≥80%,内镜下黏膜正常或程度改善2级及以上为显效;临床症状积分降低50%~79%,内镜下黏膜正常或程度改善1级为有效;临床症状积分降低<50%与内镜下黏膜均无改善甚至加重为无效[8]。
1.4 观察指标
1.4.1 酸反流及胃蛋白酶原Ⅰ(PepsinogenⅠ,PGⅠ) 采用pH 值监测仪(荷兰MMS公司)行食管24 h pH-阻抗监测,指标包括酸暴露时间和酸反流次数。分别于治疗前后采用真空促凝管抽取患者空腹静脉血,3 000 r/min 离心10 min,分离血清,待统一检测。采用双抗体夹心ELISA法检测PGⅠ血清水平(试剂盒购自上海江莱生物科技有限公司)。
1.4.2 胃肠激素及一氧化氮 抽取两组患者空腹静脉血5 ml,离心,取上清,采用放射免疫法测定两组治疗前后胃动素(Motilin,MOT)、胃泌素(Gastrin,GAS)、血管活性肠肽(Vasoactive intestinal peptide,VIP)等胃肠激素水平,检测试剂盒由上海史瑞可生物科技有限公司提供。血清一氧化氮(NO)水平检测采用硝酸还原酶法,检测试剂盒由上海彩佑实业有限公司提供。
1.4.3 药物不良反应 观察记录两组患者治疗期间不良反应的发生情况。
2 结果
2.1 两组内镜黏膜分级比较 治疗后,两组患者内镜黏膜分级均有改善,研究组优于对照组,差异有统计学意义(Z=4.19,P<0.05)。见表1。
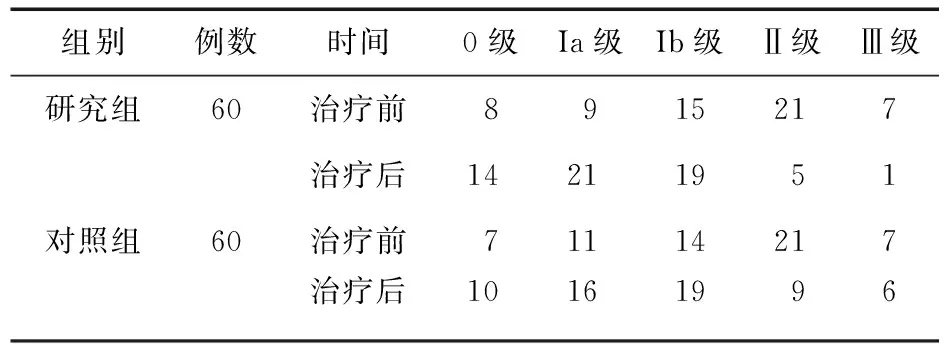
表1 两组患者内镜黏膜分级比较(例)
2.2 两组临床症状评分比较 两组治疗后反酸、烧心、胸痛等评分下降(P<0.05),且研究组低于对照组(P<0.05)。见表2。
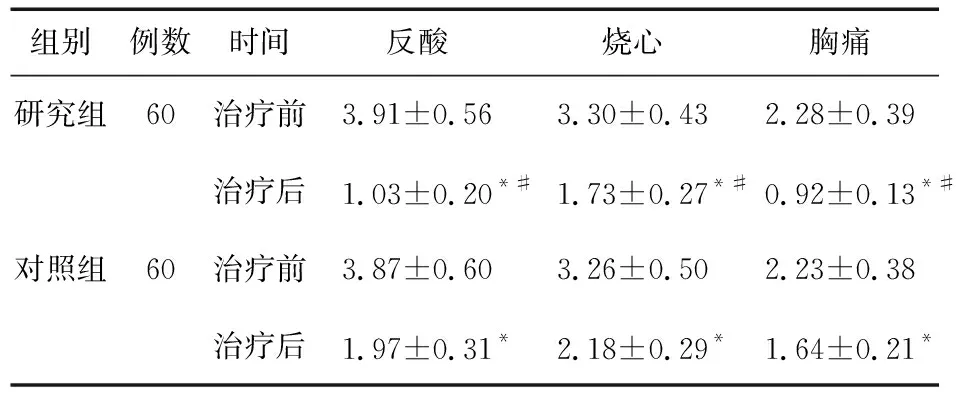
表2 两组患者临床症状评分比较(分)
2.3 两组临床疗效比较 研究组总有效率高于对照组(91.67%vs.71.67%,P<0.05)。见表3。

表3 两组患者临床疗效比较[例(%)]
2.4 两组酸反流情况及PG血清浓度水平比较 治疗后,两组患者酸暴露时间、酸反流次数、PGⅠ水平均低于治疗前(P<0.05),且研究组低于对照组(P<0.05)。见表4。

表4 两组患者酸反流情况及PG血清浓度水平比较
2.5 两组血清胃肠激素及NO浓度水平比较 治疗后,两组患者MOT、GAS水平增高,VIP、NO水平下降(P<0.05),且研究组MOT、GAS高于对照组(P<0.05),VIP、NO低于对照组(P<0.05)。见表5。
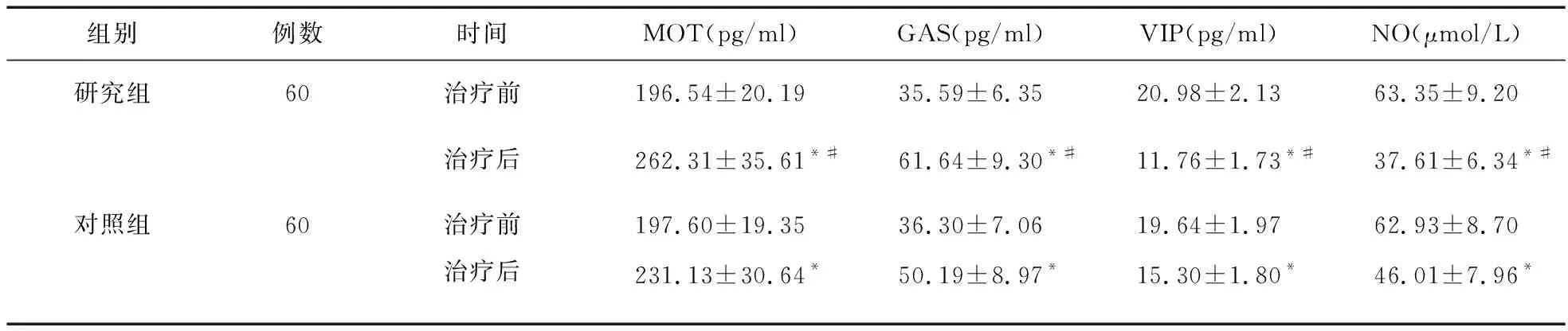
表5 两组患者血清胃肠激素和NO水平比较
2.6 两组药物不良反应比较 两组治疗期间均未出现严重不良反应,部分患者发生腹泻、腹痛、乏力、恶心呕吐等轻微不良反应,未影响治疗。两组不良反应发生率差异无统计学意义(P>0.05)。见表6。

表6 两组患者不良反应比较[例(%)]
3 讨论
近年来随着工作生活压力的增大和高脂饮食方式的改变,我国 GERD 患病率呈现逐年增长趋势。抑酸分泌是治疗GERD的主要方法,在食管黏膜愈合及反流症状控制方面,PPIs明显优于H2受体阻滞药。
埃索美拉唑是近年研发的奥美拉唑的S-异构体,其口服后1 h 即达血药高峰,肝代谢率低,生物利用率高,对胃酸分泌的抑制作用增强。与兰索拉唑、泮托拉唑、奥美拉唑等第一代PPIs相比,埃索美拉唑与CYP450 酶系统的亲和力小,潜在药物相互作用少,个体差异小。埃索美拉唑口服后,首过效应少,生物利用度高,药学效应强于第一代PPIs。埃索美拉唑40 mg与奥美拉唑60~80 mg的抑酸强度相当[9]。一项多中心随机双盲临床试验证实,埃索美拉唑对轻度GERD的疗效与奥美拉唑相比,差异无统计学意义,但对于中重度GERD的疗效更优[10]。单纯的抗酸疗法无法显著改善胃反流,故临床上多以PPIs联合促动力药使用。促动力药如莫沙必利能有效增加食管下括约肌压力、加速胃排空、刺激食管蠕动以及增强食管对酸的清除力[11-12]。铝碳酸镁具有独特的层状结构,嚼服后能够吸附于黏膜表面,直接中和胃酸,降低食管内酸度;同时还能可逆性结合胃蛋白酶和胆汁酸,抑制卵磷脂激活,迅速缓解烧心症状,其抑酸作用优于法莫替丁[13],是治疗GERD的良好药物。
HH可进一步加重GERD胃肠功能紊乱和临床症状,为GERD的高危因素之一。2019版GERD外科诊疗共识[4]建议,对于合并HH的GERD患者,PPI剂量应加倍。治疗周期以8周为佳[14],研究显示,疗程8周可将疗程4周的临床症状缓解率及食管黏膜愈合率增加10%[15]。一项早期随机双盲临床试验显示,对于1次/d、30 mg/次口服兰索拉唑,烧心症状仍不能缓解的患者,改用埃索美拉唑40 mg/d口服,其烧心症状得到明显改善,其临床疗效与双倍剂量兰索拉唑相当[16]。本研究中,采用埃索美拉唑治疗的研究组患者黏膜愈合、核心症状、酸反流等方面均明显优于对照组,分析原因可能为埃索美拉唑是近年新研发的PPIs,达血药高峰时间更短、肝代谢率更低、生物利用率更高、抑制胃酸分泌的靶向作用更强。研究表明,埃索美拉唑单一剂量给药即可使患者胃内pH值大于4的时间达到12 h以上[17]。在用药不良反应方面,研究组不良反应发生率略低于对照组,但差异无统计学意义(可能与样本量有关),分析可能原因,埃索美拉唑作为一种新型的光学异构体,其光学性质更趋于稳定[18],不良反应更少,表明埃索美拉唑治疗可使GERD合并HH患者获益更大。一项有关PPIs在治疗RE中的疗效的网状 Meta分析[19]结果也显示,众多PPIs中,埃索美拉唑与莫沙必利联用治疗RE的效果最好,尤其适宜于短期、大剂量应用治疗。
GERD是多种因子共同参与和作用的结果,在GERD的发病机制中,胃酸可促使PG转化为胃蛋白酶,从而引发食管黏膜的病理改变,导致反流的相关症状[20-22]。PGⅠ是由胃主细胞分泌的,在提示反流症状方面比PGⅡ更敏感,其血清浓度能够客观反映患者的反流程度[23]。GAS可调节消化腺分泌、提高食管括约肌张力和增强胃肠蠕动[24-26];MOT具有促进胃蠕动和收缩食管括约肌的作用;而VIP有抑制胃蠕动、降低食管括约肌张力以及胃排空延缓的作用。NO作为一种重要的信使分子和炎症介质,可激活鸟苷环化酶,增加环磷鸟苷生成,后者可使细胞内钙离子浓度降低,从而影响下食管括约肌功能;此外,NO还可与超氧化物反应形成过氧化亚硝酸,破坏胃食管交界处上皮完整性,造成该处黏膜损伤[27]。研究证实,血清NO表达水平与GERD病情程度密切相关[28]。本研究中,两组患者治疗后MOT、GAS水平增高,PGⅠ、VIP、NO水平下降,且研究组优于对照组,表明研究组治疗方案在改善胃肠分泌、抑制胃酸、缓解炎症等方面具有明显优势,这可能是其疗效增益的内在机制之一。
综上所述,与兰索拉唑联合莫沙必利、铝碳酸镁相比,埃索美拉唑联合莫沙必利、铝碳酸镁治疗GERD合并HH的疗效更为显著。
