新型非贵金属体系催化丙烷脱氢宏观动力学的研究
2021-07-05余秋玲潘相米李南锌吴砚会
韩 伟,余秋玲,潘相米,梁 衡,艾 珍,李 扬,李南锌,吴砚会
(1. 西南化工研究设计院有限公司 国家碳一化学工程技术研究中心 工业排放气综合利用国家重点实验室,四川 成都 610225;2. 内江师范学院 数学与信息科学学院,四川 内江 641100)
小分子饱和烃脱氢制取烯烃的技术早在20世纪30年代便已实现工业化,但由于二战以后炼油技术的发展, 蒸汽裂解副产的丙烯足够满足市场需求,导致烷烃脱氢这一技术路线未受到重视[1,2]。 近十多年以来, 随着全世界页岩气产业的快速发展,其副产的凝析液为全世界提供了大量廉价的乙烷和丙烷资源,同时石油产量的不断提高,其伴生气中的丙烷产量也越来越大。 因此人们开始重新关注C3~C5烷烃直接催化脱氢技术, 该领域的专利申请和公开文献数量也随之出现增长[3-5]。
目前已产业化的直接脱氢工艺主要有UOP公司的Oleflex工艺、Lummus-Houdry公司 的Catofin 工艺、Krupp Uhdewcng公司的STAR工艺、Linde-BASFStatoil共同开发的PDH工艺等[1,5]。 其中,Oleflex工艺和Catofin工艺占据全球90%以上的市场份额, 我国已投产和在建的烷烃脱氢装置均采用以上两种技术中的一种。 但这两种工艺仍旧面临一些问题[6-9]:Oleflex工艺催化剂(Pt-Sn/Al2O3体系)价格昂贵,移动床工艺操作复杂;Catofin工艺采用6~8个反应器,切换频繁,而且催化剂毒性大(Cr2O3/Al2O3体系)。 为了避免以上问题,西南化工研究设计院有限公司正在开发新型非贵金属体系(非Cr非Pt)的低碳烷烃脱氢催化剂,并取得了一定的进展[10]。
本文采用该新型催化剂,在固定床反应器上测定了其丙烷脱氢制丙烯的反应速率,并得到了相应的脱氢动力学模型,对以后适合该催化剂体系的反应器选型和工艺优化提供理论基础。
1 实验部分
1.1 气体及试剂
丙烷、氢气、氮气,纯度分别为99.9%,成都宏锦化工有限责任公司;非Pt非Cr脱氢催化剂为自制,采用等体积浸渍法制备, 其活性组分为Zr-Ga-W-Co-Fe-Zn,载体为MgO-Al2O3复合物。
1.2 活性评价方法
催化剂样品的活性评价在微型固定床反应器上进行。 反应管为石英管,催化剂装填量4~10 g,颗粒度20~40 目,反应温度580~640 °C,反应压力常压(100 kPa),原料气为纯丙烷,进料体积空速为500~2000 h-1,气体经减压阀及预热器进入反应器。 反应产物分流后在两台安捷伦6820气相色谱仪上同时进行分析:一台采用5A分子筛毛细柱,N2为载气,恒温80 °C,TCD检测器;另一台采用PLOT-Q毛细柱,N2为载气,60 °C恒温5 min,后以10 °C/min升温至200 °C,FID检测器。 通过色谱峰面积及校正因子计算相应产物的体积分数,脱氢反应的丙烷转化率和产物选择性通过碳平衡计算[11]。
1.3 实验结果分析
在正式测试活性数据之前,对选定的反应器及相关条件的合理性进行了验证。 分别在空速500和2500 h-1、 温度600 °C和常压条件下进行了空管测试,无催化剂时丙烷转化率分别为2.2%和1.8%。 此外,在丙烷体积空速500~2500 h-1、反应温度600 °C条件下,反应管中催化剂分别装填4 g、6 g、8 g、10 g,常压测试其丙烷脱氢性能。 结果显示,在同一空速条件下,丙烷脱氢转化率平均相对偏差0.79%。 这表明,反应管材质对脱氢活性无影响;反应器高径比合理,可假设为理想平推流反应器。
在动力学实验条件下, 空速范围500~2500 h-1,反应温度范围580~640 °C,催化剂装填量8 g,自主开发的非Cr非Pt催化剂的丙烷脱氢制丙烯的数据如表1所示。

表1 新型催化剂上的丙烷脱氢制丙烯实验数据
从表1中可看出,随着温度的增加,丙烷转化率上升,丙烯选择性下降;随着W/F数据的减小(W/F与空速成反比), 丙烷转化率下降, 丙烯选择性上升,这符合丙烷脱氢受热力学控制的特点。
2 宏观动力学研究
2.1 宏观动力学模型的建立
2.1.1 新型催化剂脱氢反应体系
在丙烷脱氢制丙烯反应过程中存在脱氢、裂解、加氢、芳构化和结焦等多种反应过程[12,13]。 在高温状态和催化剂存在的情况下,其中丙烷脱氢生成丙烯是主要反应,该过程在热力学上属于强吸热的可逆反应过程,而副反应偏离平衡较远,可视为不可逆反应过程[14,15]。 由实验室数据可知,在较低温度和较低空速下, 裂解及后续加氢等副产物甲烷、乙烷、乙烯选择性明显增加。 而本文的实验条件空速较大, 因此在反应过程中主要以一次反应为主,烯烃的二次裂解困难[16-19]。 综合上述分析并根据实验数据,可认为在本实验条件下的反应过程中,存在以下三个主要反应过程:

反应式(1)和(2)是两个一次并行反应过程,反应式(2)和(3)是两个串联反应过程。由于本文的目的是建立反应宏观动力学模型,而反应式(3)的发生并不会引起气相副产物总量的减少,因此本文将反应式(2)和(3)简化为:

式中,C1代表甲烷,C2代表乙烯和乙烷两种副产物。
2.1.2 新型催化剂脱氢宏观动力学模型
丙烷催化脱氢是一个气固两相的多相催化反应过程, 在催化剂装填量固定不变和常压的情况下,根据反应速率方程的定义,该反应速率表达式如下所示:

式中,k1、k-1分别是反应(1)的正、逆反应速率常数;K则是反应速率平衡常数,只与温度有关,其值如表1所示。
2.2 动力学模型参数估算及校验
2.2.1 生成速率的计算
本实验过程中可采用各物质的分压变化来替代其浓度变化,因此分别以pC3H6和p副产物对W/F作图,自变量对应曲线点处的斜率即为丙烯和副产物的生成速率[11]。结合本文数据特点,在Eviews 10.0中使用指数函数y = y0+ A·exp(R0·x)对表1中的相关数据进行拟合,拟合结果如表2所示;对不同温度下拟合方程的R2≥ 0.99,且F值很大,表明拟合结果良好可靠。 对该函数求导,代入自变量数据得到对应的生成速率,列于表2中。
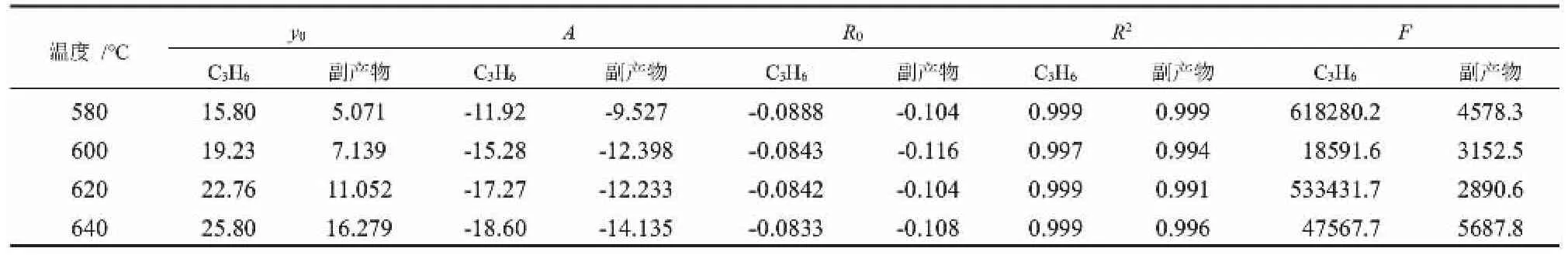
表2 不同温度下pC3H6-W/F和p副产物-W/F拟合曲线参数值
2.2.2 动力学参数拟合及校验
在软件Eviews 10.0中进行动力学方程的回归计算。 在公式(6)~(10)式中,α、β、γ、θ、k10、k20、E1、E2为待测参数。 采用非线性回归方法,求得如下结果:α =1.95,β = 0.38,γ = 1.63,θ = 5.67,k10= 2.25 × 105,k20= 5.27 × 104,E1= 154.42 kJ,E2= 262.31 kJ。 因此,本文中丙烷脱氢主反应和副反应的宏观反应速率方程分别为:
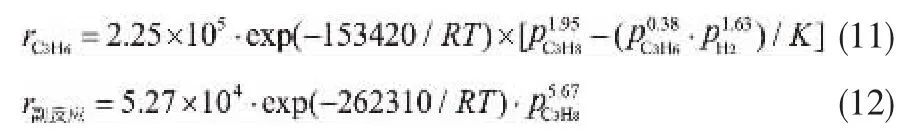
为了验证式(11)和(12)两个宏观动力学模型的适应性,对上述模型进行相关性分析、F方差检验和拟合值校验[20-22]。在本文实验条件下,查得F0.05数值[23]以及由Eviews 10.0得到相关系数R2和F统计数值见表3,丙烷脱氢和丙烷裂解反应速率拟合值与实验值比较如图1和图2所示。

图1 脱氢反应速率实验值与拟合值比较
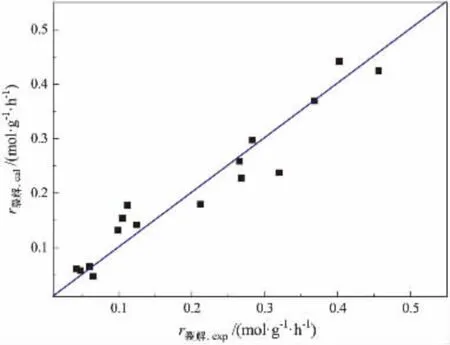
图2 裂解反应速率实验值与拟合值比较
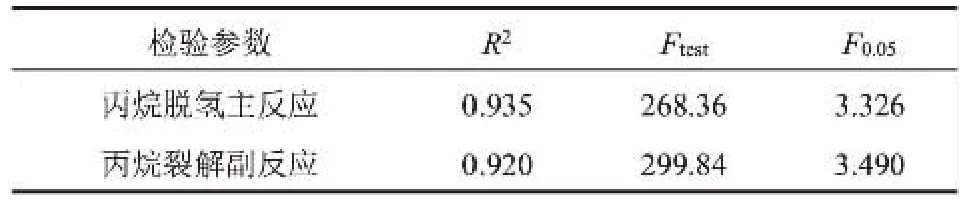
表3 统计检验结果
在化学反应的动力学模型中,针对非线性方程的参数估计,一般认为相关系数R2>0.9,FC> 10F0.05时,即表明在给定95%的置信度下,所建立的动力学模型是可靠的[15,17]。 由表3结果可知,在本文实验条件范围内,式(11)和(12) R2均大于0.9,且FC远大于10F0.05。
由图1和图2可知,脱氢主反应及裂解副反应的实验值和拟合值的数据点都分布在对角线附近,而且脱氢反应、裂解反应的拟合值与实验值的平均相对误差分别为-0.69%和1.36%;同时由式(5)计算可知,总反应速率的拟合值与实验值的平均相对误差为3.41%。 这说明该动力学模拟值均能较好地吻合实验值。目前在丙烷脱氢领域,Pt基催化剂脱氢活性优良,因此其活化能E1相对较小,Pt/Al2O3基催化剂脱氢活化能在60~100 kJ/mol[13,24],而ZrO2催化剂脱氢活化能则为150~300 kJ/mol[25], 因此本文非Pt非Cr体系脱氢活化能153.42 kJ/mol符合该催化体系的特点。 综上所述,在本文实验条件的范围内,所建立的动力学模型及由实验数据拟合得到的参数是高度显著和可信的。
3 结论
在微型固定床反应器中,采用自主开发的新型脱氢催化剂体系,考察了其催化丙烷脱氢的性能,并建立了该体系丙烷脱氢制丙烯过程的宏观动力学模型。 基于该动力学模型,采用非线性回归,得到了该动力学模型的相关参数数据。 相关性系数R2、F方差检验和拟合值校验结果显示,本文建立的丙烯生成速率方程、丙烷裂解速率方程具有较高的可靠性,由此得到总反应速率方程的拟合值和实验值的平均偏差为3.41%。 这表明,依据本文实验条件建立的丙烷脱氢宏观动力学方程具有较高的合理性和可信性,该方程能够为未来该反应体系的放大提供理论依据。
符号说明
W为催化剂质量,g;F为原料丙烷的摩尔流量,mol/h;pC3H8为产物中丙烷分压,kPa;pC3H6为产物中丙烯分压,kPa;pH2为产物中氢气分压,kPa;p副产物为产物中副产物分压,kPa;r总为丙烷总反应速率;rC3H6为丙烯的生成速率;r副产物为副产物C1和C2的生成速率;k1为脱氢反应速率常数;k2为裂解反应速率常数;k10,k20为Arrhenius方程指前因子;ɑ、β、γ、θ为对应方程中各分压的指数项;E1为脱氢活化能,kJ/mol;E2为裂解活化能,kJ/mol;K为反应速率平衡常数。
