他克莫司及其血药浓度检测方法研究进展
2021-07-05曹爱霖王学彬
曹爱霖,王学彬,王 卓*,徐 宁
(1.浙江工业大学药学院新药开发研究所,杭州 310014;2.海军军医大学长海医院药学部,上海 200433)
治疗药物监测(therapeutic drug monitoring,TDM)是通过测定血药浓度并观察药物临床治疗效果,根据药动学原理调整给药方案,从而达到理想治疗效果的一种方法。目前临床主要针对具有治疗指数窄、个体间血药浓度差异大、非线性药动学特征等特点的药物开展TDM。
他克莫司(tacrolimus,又称FK506)是从链霉素属分离提取的强效免疫抑制性二十三元环大环内酯类抗生素,口服吸收后,血浆中游离的他克莫司会被转运至T细胞,最终形成他克莫司-他克莫司结合蛋白-Ca2+-钙调蛋白-钙调磷酸酶的五聚物发挥药理作用[1],产生强大的免疫抑制作用,临床主要用于预防肾脏、肝脏等器官移植术后的排异反应。目前,国际最新指南均强烈推荐肾脏移植患者术后长期使用包含钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)的免疫抑制方案,其中首推他克莫司[2-3]。他克莫司在体内分布广泛、清除率低,口服后需要数天时间达到稳态血药浓度,并且治疗窗窄,低浓度下易出现排异反应,高浓度时肾毒性和神经毒性增加[4],即使血药浓度在治疗窗内,患者也常发生肾毒性、消化系统不适等药品不良反应。他克莫司在不同器官移植患者的药动学及药效学有明显个体差异,给临床治疗时的药物剂量调整带来难度,因此选择合适的方法对他克莫司开展TDM,获得精准的血药浓度,显得尤为重要。
1 他克莫司的体内分布
他克莫司口服后经胃肠道吸收,生物利用度为20%~25%,吸收后呈双相分布,因其可与红细胞广泛结合,红细胞中的他克莫司浓度平均可达血浆浓度的约15倍,比值受红细胞比容、血浆蛋白和他克莫司浓度影响。血浆中98.8%的他克莫司与血浆蛋白结合,主要结合血清白蛋白和α-1-酸性糖蛋白;红细胞内的他克莫司并不与血红蛋白结合,而是与他克莫司结合蛋白(FK506-binding proteins,FKBP)结合(主要是FKBP-12),且红细胞对他克莫司的摄入会因他克莫司浓度的升高而出现饱和。他克莫司在血浆中与血浆蛋白的结合同样存在饱和现象[4]。
他克莫司的高血浆蛋白结合率使得其半衰期长而清除率低,但不同的人群会出现药物体内分布的差异,如妊娠期妇女会因血浆蛋白和红细胞计数降低而出现游离的他克莫司比例升高及他克莫司清除率升高的情况[5]。
2 他克莫司的体内代谢
他克莫司的代谢主要依赖肝脏及肠壁内的CYP3A4和CYP3A5,代谢产生至少15种甲基化、羟基化或去甲基化的代谢产物,以13-O-去甲基他克莫司(M-Ⅰ)和15-O-去甲基他克莫司(M-Ⅲ)为主,其中M-Ⅰ的药理活性为他克莫司的10%,而31-O-去甲基他克莫司(M-Ⅱ)虽然活性与他克莫司相似,但体内含量几乎难以检测[5]。
3 他克莫司血样的稳定性
目前,临床检测他克莫司浓度的样本主要是全血,血样的稳定性决定了后续检测结果的精确度和准确性。他克莫司全血样本在22 ℃或4 ℃可以保存14 d,在-20 ℃可以保存1个月,在-70 ℃可保存1年[6-7];代谢产物M-Ⅰ、M-Ⅱ和M-Ⅲ在室温下可以保存3 d,-20 ℃可以保存1个月,-80 ℃可保存1年[6,8]。反复冻融3次并不会大幅度影响定量检测结果,但-80 ℃保存6个月以上会使样本中的游离他克莫司浓度增加30%[5]。因此,临床检验窗口在收到患者的血样后应及时处理和检测,如需长期保存,应在冷藏30 min后再进行冷冻保存。
4 他克莫司目前常用检测方法
因为他克莫司在血浆中和红细胞中与血浆蛋白的结合是非线性的,单纯测红细胞中或者血浆中的他克莫司浓度并不能反映他克莫司的真实浓度,他克莫司的全血浓度更能反映临床事件,因此必须要检测其全血浓度[9],且检测过程中需要对血样进行破红细胞处理。
他克莫司在全血中的治疗浓度区间为5~20 μg/L,在全血的检测限为0.5~1 μg/L[10]。研究者在近30年开发出多种他克莫司的血药浓度检测方法(见表1),主要分为三大类:一是色谱法,主要是LC-MS/MS法;二是免疫法,包括化学发光微粒子免疫检测法、酶放大免疫检测法等;三是基于微采样等新技术的检测法,主要是体积吸收微采样联合液质法等。
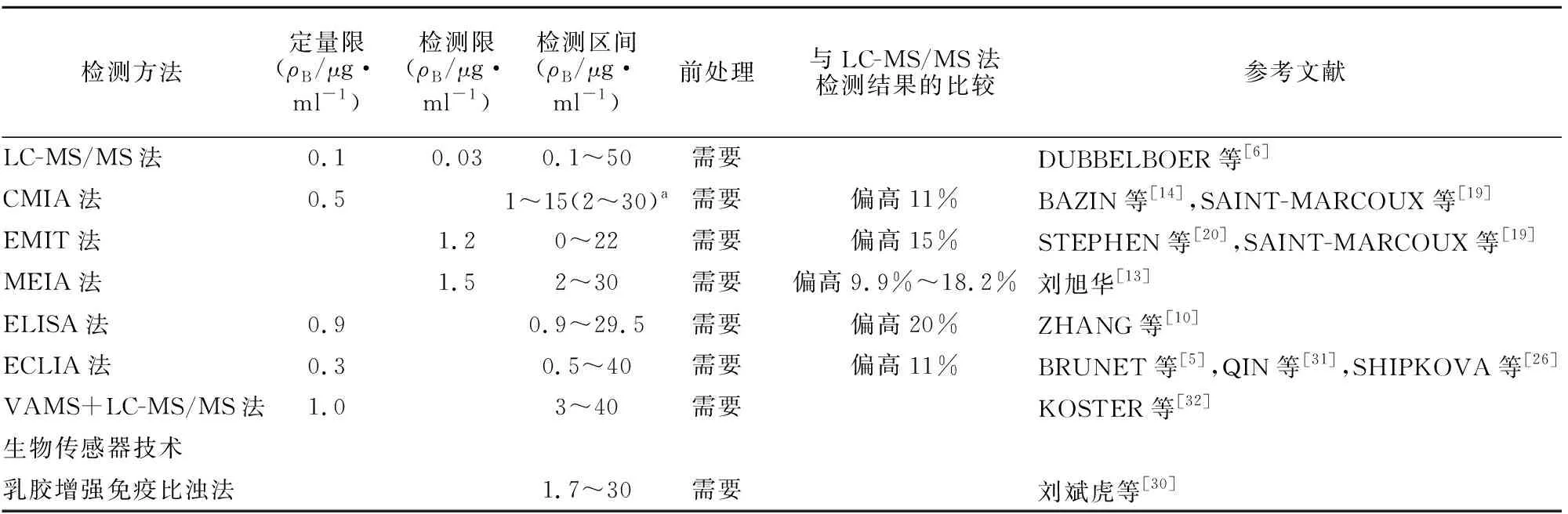
表1 不同他克莫司血药浓度检测方法比较Table 1 Comparison of different detection methods of tacrolimus in blood
4.1 LC-MS/MS法 LC-MS/MS法是检测免疫抑制药物血药浓度的金标准[10],此方法有更高的灵敏度和特异性、更低的检测限和定量限,通过检测质荷比(m/z)进行定量。与免疫法相比,LC-MS/MS法更易区分待测物与结构相似的代谢物。DUBBELBOER等[6]成功建立并验证了他克莫司及其代谢物M-Ⅰ、M-Ⅱ和M-Ⅲ的LC-MS/MS定量分析方法,待测血样需要经过蛋白沉淀剂和固相萃取(solid-phase-extraction,SPE)处理,因为此方法避免了代谢产物对他克莫司检测的干扰,故检测出来的血药浓度略低于免疫化学法的检测结果。Lee等[11]报道了一种UPLC-MS法,可以同时快速测量全血中的环孢素和他克莫司,适合治疗浓度区间较大的免疫抑制剂。SALLUSTIO等[12]研究表明,在定量检测全血中他克莫司浓度时,与免疫法和常规HPLC法相比,LC-MS/MS法在重复性和精确性方面有显著优势。
然而,LC-MS/MS法的缺点也很明显,主要包括检测耗时长、仪器昂贵、血样需要经过预处理、血样需要集中到有资质的实验室(如中心实验室)进行测定。
4.2 化学发光微粒子免疫检测法 化学发光微粒子免疫检测(chemiluminesent microparticle immunoassay,CMIA)法是近十年发展起来的一种免疫分析技术,利用免疫反应的特异性和化学发光的高敏感性,以测量吖啶酯标记物在碱性介质中发生化学反应所产生的光子量为基础,以类磁颗粒作为包被载体[13]。类磁颗粒的作用主要是增加反应的表面积,提高反应灵敏度,缩短反应时间,反应过程中采用磁力吸附分离,冲洗彻底,因而具有更高的特异性。CMIA法在国内外应用广泛,可实现多样本、多品种同时检测,目前主要利用雅培公司生产的Architect系列机型实现血样检测,全血样品中他克莫司的浓度在1~15 ng/ml范围内,CMIA法和金标准LC-MS/MS法的检测结果相关性较好[14]。金瑛等[15]收集了581份全血样本,分别用LC-MS/MS法和CMIA法进行他克莫司浓度检测,结果显示CMIA法检测结果与LC-MS/MS法检测结果的相关系数为0.902 4,相关性良好,结果重复性好,但大量样本的CMIA法检测结果平均值略高于LC-MS/MS法检测结果[(9.21±3.65) ng/mlvs(6.30±2.69) ng/ml]。
4.3 酶放大免疫检测法 酶放大免疫检测(enzyme multiplied immunoassay technique,EMIT)法,又称为酶增强免疫检测技术,于1972年由RUBENSTEIN首先提出,1974年应用于苯妥英钠TDM项目,1990年开始应用于免疫抑制剂的检测[16]。EMIT法的原理是受检品中的药物和试剂中用葡萄糖-6-磷酸脱氢酶(G-6-PD)标记的药物竞争定量的抗体结合位点,酶标记的药物与抗体结合后将丧失活性,存留下来的具有活性的酶将抗体试剂中的烟酰胺嘌呤二核苷酸(NAD)转化为还原态(NADH),从而导致吸光度的改变。酶浓度的变化反映了待测样品中药物的浓度[17]。
随着EMIT法的广泛应用,其缺点也逐步显现出来。研究显示,在应用EMIT法检测时,检测结果会因样本中存在某些与待测药物有相似结构的抗原而出现交叉反应,从而使检测结果出现偏差[18]。SAINT-MARCOUX等[19]分别采用EMIT、CMIA和LC-MS/MS法检测45例肾移植术后患者的他克莫司血药浓度和药动学参数,结果显示,EMIT法和CMIA法检测的平均浓度分别比LC-MS/MS法检测的平均浓度高15%和11%,且在3.0~5.0 ng/ml浓度范围内的样本检测结果并不可靠[5]。但是,EMIT法相对于微粒酶免疫分析法前处理时间更短,且可实现单样本检测,而检测结果相似[20]。
4.4 微粒酶免疫分析法 微粒酶免疫分析(microparticles enzyme immunoassay,MEIA)法所用仪器为雅培公司的全自动免疫分析仪(IMx),操作方便,检测时间短,结果可迅速反馈临床,但专一性不强,易与代谢产物发生免疫反应,从而使监测结果发生偏差[13],且不同批次试剂盒差异较大,更换试剂盒需重新制作质控数据分布图,以便校正测定结果[21]。李鹏飞等[22]利用IMx仪器和液相色谱-串联质谱仪对他克莫司全血样品进行了798例次的浓度测定,结果显示,MEIA法测定心、肺、肝、肾移植患者的他克莫司浓度分别比LC-MS/MS法检测结果高9.9%、13.2%、13.1%和18.2%,并且由于他克莫司个体药动学差异大,这种偏差很难控制在一定范围内。目前MEIA的试剂盒已经停产,雅培公司生产的Architect系列机型已全面取代IMx用于临床检测。
4.5 酶联免疫吸附法 酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法是实验室检测他克莫司的早期用法,具有灵敏度高、特异性强的特点,能够有效保证检测结果的准确性。同时,ELISA法操作简便,所需设备少,能够快速检测全血中他克莫司的浓度。平行对照研究[23]显示,ELISA法检测的他克莫司血药浓度与LC-MS/MS法检测结果存在一定的相关性,ELISA法的测定结果要普遍高于LC-MS/MS法的测定结果(AUC0~24 h高20.1%)。在较高质量浓度组(≥10 ng/ml),两种检测方法结果的偏差与ELISA法的试剂与他克莫司在体内的代谢产物发生交叉反应,干扰检测结果有关。此外,ELISA法检测他克莫司还受患者肝功能的影响[24],与肝功能正常的患者相比,肝功能损伤患者的检测结果偏高。分析原因是损伤的肝功能影响了他克莫司在肝脏的代谢,蓄积的他克莫司代谢产物对ELISA法检测结果产生干扰,使结果偏高。
4.6 电化学发光免疫分析法 电化学发光免疫分 析(electrochemiluminescent immunoassay,ECLIA)法由罗氏诊断产品有限公司研发,借助于电化学发光全自动免疫分析仪(cobase 411等)实现了他克莫司全血浓度检测。其检测原理为标记在抗体上的化学发光剂三联吡啶钌[Ru(bpy)3]2+与电子供体三丙胺在阳电极表面发生氧化还原反应,生成三价的吡啶钌[Ru(bpy)3]3+,后被还原形成激发态的二价吡啶钌[Ru(bpy)3]2+*,激发态的二价吡啶钌衰减成基态吡啶钌[Ru(bpy)3]2+时,会发射一个波长为620 nm的光子,周而复始,被信号接收器捕获[25]。该方法于2014年被引入国内,小范围应用于临床环孢素和他克莫司的TDM,具有检测范围广、精密度高、结果与LC-MS/MS法检测结果相关性好、检测速度快等优势,但是也有检测成本高等缺点。SHIPKOVA等[26]针对ECLIA法测定他克莫司全血浓度与LC-MS/MS法作了头对头研究,结果显示ECLIA法的测定结果与LC-MS/MS法存在11%的偏差,可能是标记抗体与活性代谢物M-Ⅱ相互作用所致。2018-01-03罗氏诊断产品有限公司在国家食品药品监督管理总局(CFDA)官网上发布了对电化学发光全自动免疫分析仪(cobas 8000)的主动召回公告,原因是仪器在极少数情况下会出现核心模块自动将控制单元软件的系统设置重置为默认值,导致数据不匹配。
4.7 体积吸收微采样联合液质法 体积吸收微采样(volumetric absorptive microsampling,VAMS)技术[27]是Neoteryx公司研发的,可以克服血细胞比容对检测结果影响的微创采样技术。患者在家中利用微型取样器采集指尖血,储存在VAMS装置中,送到实验室,应用50%甲醇溶液、0.2和0.5 mol/L的硫酸锌甲醇溶液进行萃取,然后经涡旋、声波降解等步骤处理,最后使用LC-MS/MS法进行定量检测。VAMS技术可以让患者在家中就实现血液采集,方便、微创、经济,且储存在VAMS装置中的他克莫司全血样品在43 h内稳定可靠[27]。目前,VAMS技术联合LC-MS/MS法检测他克莫司血药浓度尚不成熟,检测结果的可信度有待进一步研究。
4.8 生物传感器技术 生物传感器技术(biosensors techniques)自首次报道至今已有近60年的历史,目前广泛应用于医药、工业生产、环境卫生等领域,主要依靠换能器表面的生物分子受体与待测分析物的相互作用来实现检测[28]。依据设计不同,传感器可以分为光学传感器技术(如表面等离子共振光谱、表面增强拉曼光谱等)、机械传感器技术(如石英晶体微天平等)和电化学传感器技术。在TDM领域,生物传感器技术主要用于抗肿瘤药甲氨蝶呤和氨基糖苷类抗菌药物的检测,但鲜有关于免疫抑制剂的报道[29]。生物传感技术虽然具有敏感度高、选择性高的优势,但也存在标准化程度不够、可控性差等劣势[28],这些劣势限制了其在免疫抑制剂血药浓度检测中的应用由实验室走向临床的脚步,但随着纳米生物传感技术的开发应用日趋成熟,在不久的将来,有望实现他克莫司的快速、精确检测。
4.9 胶乳增强免疫比浊法 上海云泽生物科技有限公司于2018年申请了基于高灵敏度胶乳增强免疫比浊法(latex-enhanced immunoturbidimetry)测定全血样品中他克莫司浓度的发明专利[30],主要检测原理是将他克莫司抗体交联在聚苯乙烯乳胶微球表面,与他克莫司蛋白复合物反应,带动聚苯乙烯微球聚集,产生一定浊度,而全血中的他克莫司竞争性结合聚苯乙烯微球表面的单克隆抗体,此时的浊度与全血中的他克莫司浓度成反比,从而利用全自动生化仪在400~800 nm波长下检测他克莫司浓度。该方法于2020年1月授权公开,目前尚无文献报道。
5 小 结
他克莫司自20世纪90年代初研发问世至今已有30年,目前有完全取代环孢素临床地位的趋势,但他克莫司和环孢素一样,在临床应用时也需要定期监测血药浓度,依据血药浓度监测结果并结合临床表现来调整用药剂量。他克莫司的血药浓度检测方法经历了更新换代,检测方法的进步为个体化医疗服务提供了技术保障,对促进临床合理用药有重要意义。虽然LC-MS/MS法仍然是检测他克莫司血药浓度的金标准,但在精准检测血药浓度的同时,如果可以兼顾快速、便捷,将有助于提高患者的依从性,为临床安全用药提供帮助。新一代的检测技术如微流控芯片技术、拉曼光谱技术[33]等已经在实验室取得了初步成果,如果能成功走向临床,必将为患者提供更好的就诊体验。
