紫茶多酚含量测定及其抗氧化活性研究
2021-07-05曾棋平杨丽娜吴坤林蔡小辉陈锦珊
曾棋平,杨丽娜,吴坤林,蔡小辉,陈锦珊
(联勤保障部队第九〇九医院/厦门大学附属东南医院药剂科,福建漳州 363000)
唐代茶圣陆羽曰:“茶,紫者为上”,此处“紫”指鲜茶叶的颜色,主要因富含花青素而呈紫色[1]。肯尼亚位于非洲东部,地处赤道,境内海拔1500~2000米,昼夜温差大且紫外线照射强烈,为紫茶的生长提供了得天独厚的条件,产量丰富且品质优越。紫茶的化学成分复杂,包括多酚、氨基酸、碳水化合物、蛋白质、挥发性化合物、矿物质、微量元素和生物碱(咖啡因、茶碱、可可碱)等。其中,多酚是主要的生物活性物质[2]。多酚类化合物是一类复杂的具有多个酚羟基的次生代谢产物,主要包括酚酸、黄酮类、木脂素类和单宁等化合物[3]。现代药理学研究表明,天然植物中含有的多酚具有抗肿瘤[4]、抗氧化[5]、抗纤维化[6]、抗菌[7]等功效,因此成为国内外学者关注和研究的热点。目前,紫茶多酚的质量控制方法及抗氧化活性研究尚未见报道。作者采用铁氰化钾-氯化铁比色法测定肯尼亚紫茶中多酚的含量,并对其体外抗氧化活性进行初步研究,从而为其进一步开发利用提供理论依据。
1 仪器和试药
1.1 仪器 UV-2550型紫外可见分光光度计、AUX220型电子分析天平(精度:0.1 mg)均由日本岛津公司提供;HH-2数显恒温水浴锅(江苏省金坛市友联仪器研究所);KQ-500B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 药品和试剂 紫茶粉(产于非洲肯尼亚, 由火烈鸟茶叶有限公司提供, 批号20181030); 没食子酸对照品(中国食品药品检定研究院, 批号110831-201605); 1,1-二苯基-2-三硝基苯肼(DPPH, 福州飞净生物科技有限公司, 批号201806); 铁氰化钾(温州市化学用料厂); 水杨酸(山东新华制药股份有限公司, 批号16185); 六水合三氯化铁、磷酸二氢钾、三氯乙酸、硫酸亚铁、过氧化氢、盐酸、乙醇等试剂均购自西陇科学股份有限公司。 以上试剂均为分析纯, 水为纯化水(联勤保障部队第九〇九医院/厦门大学附属东南医院自制)。
2 方法和结果
2.1 溶液的制备
2.1.1 紫茶多酚供试品溶液 取紫茶粉末约5.0 g,精密称定,置圆底烧瓶中,加入50%乙醇500 ml,85 ℃水浴回流提取30 min,将提取液过滤,用50%乙醇补足减失的重量并稀释至500 ml,摇匀。再精密吸取1 ml置于100 ml量瓶中,加纯化水稀释至刻度,即得紫茶多酚供试品溶液。
2.1.2 没食子酸对照品溶液 精密称取干燥至恒重的没食子酸对照品14.2 mg,置于50 ml量瓶中,加纯化水溶解并稀释至刻度,摇匀。精密吸取溶液10 ml,置于100 ml量瓶中,制备成质量浓度为28.4 μg/ml的没食子酸对照品溶液。同法制备质量浓度为26.0 μg/ml的没食子酸对照品溶液,避光保存,备用。
2.2 实验条件的优化
2.2.1 检测波长的确定 分别精密吸取紫茶多酚供试品溶液和质量浓度为28.4 μg/ml的没食子酸对照品溶液各1.0 ml,置25 ml量瓶中,依次加入0.1 mol/L的FeCl3溶液2.0 ml、1%K3[Fe(CN)6]溶液1.0 ml、0.1 mol/L的HCl溶液2.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白对照,在波长380~900 nm的范围内进行扫描(见图1),确定最大吸收波长。由图1可见,没食子酸对照品溶液和紫茶多酚供试品溶液经显色反应后的光谱吸收曲线基本一致,且两者均在775 nm处有最大吸收峰。因此,选择775 nm作为紫茶多酚的检测波长。

图1 紫茶多酚的紫外扫描光谱图1:没食子酸对照品溶液;2:紫茶多酚供试品溶液
2.2.2 FeCl3用量的考察 在室温条件下,精密吸取紫茶多酚供试品溶液0.5 ml,各6份,分别置25 ml量瓶中,加入1%K3[Fe(CN)6]溶液1.5 ml和0.1 mol/L的HCl溶液2.5 ml,再依次加入0.1 mol/L的FeCl3溶液0.2、0.5、1.0、2.0、3.0、4.0 ml,分别用纯化水稀释至刻度,摇匀,避光放置60 min。以相应试剂为空白对照,在775 nm处测定吸光度,考察FeCl3用量对显色效果的影响,结果见图2A。由图2A可见,在考察范围内,随着FeCl3用量增加,生成可溶性普鲁士蓝的量也不断增加,当FeCl3的用量为1.0 ml时,所测样品的吸光度为0.651,恰好在0.3~0.7范围内,满足测定需求,因此选择FeCl3的用量为1.0 ml。
2.2.3 K3[Fe(CN)6]用量的考察 在室温条件下, 精密吸取6份0.5 ml的紫茶多酚供试品溶液, 置 25 ml 量瓶中, 分别加入 0.1 mol/L的FeCl3溶液1.0 ml和0.1 mol/L的HCl溶液2.5 ml,再依次加入1%K3[Fe(CN)6]溶液0.2、0.5、0.8、1.0、1.5、2.0和2.5 ml,分别用纯化水稀释至刻度,摇匀,避光放置60 min。以相应试剂为空白对照,在775 nm处测定吸光度,确定K3[Fe(CN)6]用量对显色效果的影响,结果见图2B。由图2B可见,在考察范围内,当K3[Fe(CN)6]的用量为2.0 ml时,吸光度已达到最大,此时继续增加K3[Fe(CN)6],所测溶液的吸光度基本保持不变,表明溶液中生成的普鲁士蓝浓度已达到饱和,因此选择K3[Fe(CN)6]的用量为2.0 ml。
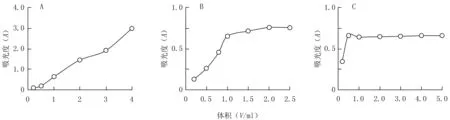
图2 检测试剂用量对显色效果的影响A:FeCl3;B:K3[Fe(CN)6];C:HCl
2.2.4 HCl用量的考察 在室温条件下,精密吸取6份紫茶多酚供试品溶液0.5 ml,分别置25 ml量瓶中, 加入0.1 mol/L的FeCl3溶液1.0 ml和1%K3[Fe(CN)6] 溶液2.0 ml,再依次加入0.1 mol/L的HCl溶液0.2、0.5、1.0、2.0、3.0、4.0、5.0 ml,分别用纯化水稀释至刻度,摇匀,避光放置60 min。以相应试剂为空白对照,在775 nm处测定吸光度,确定HCl用量对显色效果的影响,结果见图2C。由图2C可见,当HCl的用量为0.5 ml时,吸光度最大,故确定HCl的用量为0.5 ml。
2.2.5 反应时间的考察 确定0.1 mol/L的FeCl3溶液用量为1.0 ml,1%K3[Fe(CN)6]的用量为2.0 ml,HCl的用量为0.5 ml,考察避光放置时间对显色效果的影响,结果见图3。由图3可见,避光放置60 min后吸光度达到最大,继续延长放置时间对吸光度测定影响不大。因此,选择反应时间为60 min。
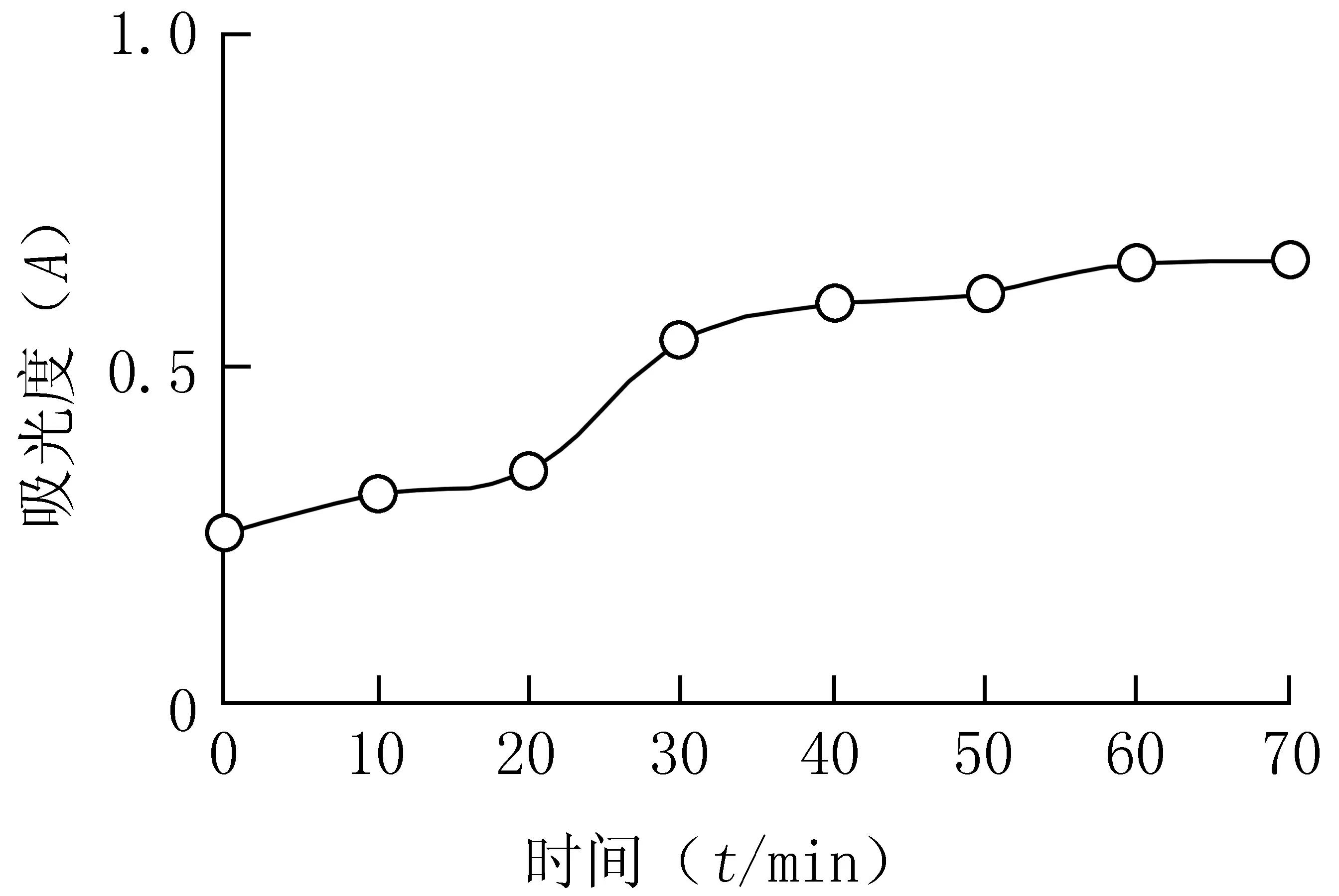
图3 反应时间对显色效果的影响
2.3 含量测定方法学考察
2.3.1 标准曲线的确定 分别精密吸取浓度为28.4 μg/ml的没食子酸对照品溶液0.2、0.3、0.5、0.8、1.0、1.2 ml,置25 ml量瓶中,依次加入0.1 mol/L的FeCl3溶液1.0 ml、1%K3[Fe(CN)6]溶液2.0 ml和0.1 mol/L的HCl溶液0.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白对照,在775 nm处测定吸光度。以没食子酸的质量浓度(x)为横坐标,以吸光度(y)为纵坐标,绘制标准曲线,得到线性回归方程:y=0.769 9x+0.027 3(r=0.999 7),表明没食子酸质量浓度在0.227~1.363 μg/ml范围内与吸光度呈良好的线性关系。
2.3.2 精密度试验 精密吸取28.4 μg/ml的没食子酸对照品溶液0.8 ml,按2.3.1项下方法进行显色反应,测定吸光度。结果没食子酸对照品溶液吸光度的RSD=0.15%(n=6),表明仪器精密度良好。
2.3.3 稳定性试验 精密吸取0.5 ml同一紫茶多酚供试品溶液6份,按2.3.1项下方法进行显色反应,避光放置60 min后每隔10 min测定一次吸光度,结果在60~120 min时间范围内,供试品溶液的RSD=1.24%(n=6),表明在60~120 min内反应产物的稳定性良好,满足测定需求。
2.3.4 重复性试验 按2.1.1项下方法,平行制备6份供试品溶液,各精密吸取0.5 ml,按2.3.1项下方法进行显色反应,测定吸光度。结果紫茶多酚的平均含量为421.5 mg/g,RSD=1.27%(n=6),表明该方法重复性良好。
2.3.5 回收率试验 精密吸取紫茶多酚质量浓度为42.15 μg/ml的供试品溶液0.25 ml,共6份,分别置25 ml量瓶中,精密加入26.0 μg/ml的没食子酸对照品溶液0.4 ml,按2.3.1项下方法进行显色反应,以相应试剂为空白对照,在775 nm处测定吸光度,计算多酚的含量。结果所测样品的平均回收率为100.28%,RSD=2.09%(n=6)。
2.4 样品含量测定 按照2.1.1项下方法配制3批紫茶多酚供试品溶液,分别精密吸取0.5 ml置25 ml量瓶中,依次加入0.1 mol/L的 FeCl3溶液1.0 ml、1%K3[Fe(CN)6]溶液2.0 ml和0.1 mol/L的HCl溶液0.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白对照,在775 nm处测定吸光度,计算紫茶多酚的含量,结果批号201908221、201908222、201908223的紫茶样品中多酚的含量分别为(421.5±1.5)、(422.8±2.1)、(422.1±1.2) mg/g(n=3)。
2.5 紫茶多酚抗氧化活性的测定
2.5.1 DPPH自由基清除率 取浓度为1.5、2.5、5.0、7.5、10.0、12.5、15.0、20.0 μg/ml的紫茶多酚溶液各2 ml置试管中,分别加入0.2 mmol/L的DPPH无水乙醇溶液2 ml,充分混匀后避光放置30 min,在517 nm波长处测定吸光度(A1);以无水乙醇作为空白对照,测定吸光度(A0);同时以无水乙醇代替DPPH,测定吸光度(A2)。按照下列公式计算:
DPPH自由基清除率=[1-(A1-A2)/A0]×100%。
以维生素C作为阳性对照,同法测定DPPH自由基清除率,结果见图4。由图4可见,紫茶多酚具有较强的DPPH自由基清除率,随着多酚浓度增加,DPPH自由基清除率增加,并呈现浓度依赖性。质量浓度在0.75~3.75 μg/ml范围内,紫茶多酚对DPPH自由基的清除能力略强于维生素C;质量浓度在5~10 μg/ml范围内,其对DPPH自由基的清除能力则弱于维生素C。分别将紫茶多酚和维生素C的质量浓度(x)对DPPH自由基的清除率(y)进行回归分析,得到紫茶多酚在质量浓度0.75~6.25 μg/ml范围内的线性回归方程为:y=11.77x+11.34(r=0.997 0);对应的维生素C的线性回归方程为:y=14.61x-2.43(r=0.985 4)。从回归方程求得紫茶多酚清除DPPH自由基的IC50为3.28 μg/ml,维生素C清除DPPH自由基的IC50为3.59 μg/ml。

图4 紫茶多酚对DPPH自由基的清除率曲线○:紫茶多酚;●:维生素C
2.5.2 羟基自由基清除率 取6 mmol/L的FeSO4溶液1 ml共8份,置试管中,加入10 mmol/L的水杨酸乙醇溶液1 ml,分别加入12.25、24.50、36.75、49.00、61.25、73.50、85.75、98.00 μg/ml的紫茶多酚溶液4 ml,最后加入6 mmol/L的H2O2溶液1 ml,置37 ℃水浴中反应0.5 h。在510 nm波长处测定吸光度(A1),以纯化水作为空白对照测定吸光度(A0),同时以纯化水代替水杨酸测定吸光度(A2),按照下列公式进行计算。
羟基自由基清除率=[1-(A1-A2)/A0]×100%。
以维生素C作为阳性对照,同法测定,结果见图5。由图5可见,紫茶多酚对羟基自由基的清除率呈浓度依赖性。分别将紫茶多酚和维生素C的质量浓度(x)对羟基自由基的清除率(y)进行回归分析,得到紫茶多酚在质量浓度7~56 μg/ml范围内的线性回归方程为:y=1.671x-4.088(r=0.991 5);维生素C在质量浓度7~35 μg/ml范围内的线性回归方程为:y=2.494x+13.640(r=0.979 3)。通过线性回归方程计算得到紫茶多酚清除羟基自由基的IC50为32.37 μg/ml,维生素C清除羟基自由基的IC50为14.58 μg/ml。从整体上看,在相同质量浓度下,紫茶多酚对羟基自由基的清除能力比维生素C更弱。

图5 紫茶多酚对羟基自由基的清除率曲线○:紫茶多酚;●:维生素C
3 讨 论
文献报道,多酚的含量测定方法有福林酚比色法、高锰酸钾滴定法、酒石酸亚铁分光光度法和铁氰化钾-氯化铁比色法等[8]。本研究采用铁氰化钾-氯化铁比色法对紫茶多酚含量进行测定,其原理是基于多酚类化合物的酚羟基具有较强的还原性,能将Fe3+还原成Fe2+,Fe2+与铁氰化钾发生化学反应生成普鲁士蓝沉淀,而该沉淀可在强酸性溶液中溶解。通过单因素考察对实验条件进行优化,确定显色反应的最优条件是加入0.1 mol/L 的FeCl31.0 ml、1%K3[Fe(CN)6] 2.0 ml和0.1 mol/L的HCl溶液0.5 ml,反应时间为60 min,根据反应后生成的普鲁士蓝溶液的吸光度计算紫茶多酚的含量。
多酚类化合物是良好的抗氧化剂,其抗氧化作用与化学结构中的邻位酚羟基极易被氧化密切相关。酚羟基可提供活泼氢,使自由基灭活,而自身被氧化生成含有邻二酚结构的自由基,具有较高的稳定性[9-10]。本研究通过DPPH自由基和羟基自由基清除法评价紫茶多酚的抗氧化活性。结果表明,在一定的质量浓度范围内,紫茶多酚对DPPH自由基和羟基自由基的清除能力呈浓度依赖性。当DPPH自由基的质量浓度为6.25 μg/ml,羟基自由基的质量浓度为56.0 μg/ml时,紫茶多酚对其清除率分别达到83.17%和83.91%。与维生素C相比,紫茶多酚清除DPPH自由基的IC50更低,而清除羟基自由基的IC50则更高。
综上所述,本研究建立的紫茶多酚含量测定方法操作简便,重复性好,可用于紫茶的质量控制。紫茶中的多酚含量较高,具有较强的抗氧化活性,可作为天然抗氧化剂资源进行研究和开发。
