miR-101、miR-122在妊娠期糖尿病患者血清和胎盘组织中表达及意义
2021-07-04陈丽霞张秀薇禤文婷尹镇钊陈松锦广东省东莞市人民医院内分泌科广东东莞523000
陈丽霞,张秀薇,禤文婷,尹镇钊,陈松锦 (广东省东莞市人民医院内分泌科,广东东莞 523000)
妊娠期糖尿病(GDM)是妊娠期较为常见的并发症,其指妊娠起始或妊娠过程中出现葡萄糖耐量受损。目前对于GDM 发病机制尚不十分明确,既往相关研究指出孕产妇高雌激素水平与其胰岛素抵抗有关,认为胰岛素抵抗是GDM 重要的病理机制[1]。近年来,随着GDM发生机制的研究进展,越来越多的研究证实多种miRNA 直接或间接参与GDM 的生物学行为机制进程,其中miR‑101 可在转录后调节多种基因的表达,与糖脂代谢异常、炎症反应等密切相关[2];而miR‑122 也被证实其参与了胰岛素分泌、糖酵解、脂肪细胞分化等生物学过程的调控[3]。因此,笔者认为两者可能与GDM的发生与进展、胰岛素抵抗、炎症反应、胎盘滋养层细胞的迁移与侵袭等具有一定关联。因此,本研究通过分析GDM 患者血清及胎盘中miR‑101 和miR‑122 的表达水平情况,分析其与胰岛素抵抗的相关性,以明确miR‑101与miR‑122在GDM预测、治疗及预后中的作用及意义。
1 资料和方法
1.1 病例与分组
选取2018年7月至2019年12月在东莞人民医院建档产检并分娩的GDM 孕妇42 例为观察组。纳入标准:(1)符合GDM 诊断标准,即行口服葡萄糖耐量试验显示:空腹血糖≥5.1 mmol/L;1 h血糖≥10.0 mmol/L;2 h 血糖≥8.5 mmol/L,满足任意一项即可诊断为GDM;(2)妊娠>16周;(3)在本院规律产检。排除标准:(1)既往无糖尿病或糖尿病家族史;(2)妊娠期高血压、高血脂、心脏病等其他妊娠合并症;(3)双胎妊娠;(4)全身感染性疾病。本研究已通过本院医学伦理委员会批准,患者及家属知情且签署同意书。并随机选取同期健康孕妇30例作为对照组。
1.2 方法
1.2.1 样本采集 所有孕产妇均于清晨空腹时采集静脉血取血清,−20 ℃冰箱中待检。胎盘组织获取于胎儿与胎盘娩出后,生理盐水洗净,取胎盘中央母体面脐带根部组织5 mm×5 mm×5 mm 大小2~4 块组织物,约重120 mg,静置−80 ℃冰箱中保存。
1.2.2 RNA 提取 采用RNAeasy extraction Kit 试剂提取血清RNA,用Trizol 试剂提取胎盘组织中RNA,同时采用Nanodrop 2 000 紫外可见分光光度计进行两样本中RNA 浓度及纯度检测。所有步骤均按试剂盒说明操作。
1.2.3 miRNA 逆转录 采用miRNA 逆转录及特异性检测试剂盒,引物采用miR‑101 特异性RT‑PCR 引物(Forward:5'‑CATCTTACCGGACAGTGCTGGA‑3',下游为通用引物)检测miR‑101 的表达。采用miR‑122特异性引物(Forward:5'‑TGGAGTGTGACAATG‑GTGTTTG‑3’,下游为通用引物)miR‑122的表达。
1.2.4 荧光实时定量PCR 试剂盒使用TaKaRa 公司,反应参数:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,共40 个循环。熔解曲线检测从65 ℃开始,每0.5 ℃检测1 次。miRNA 表达量以2‑ΔCt 表示,其中ΔCt=CtmiRNA–CtU6。
1.3 观察指标
(1)临床参数指标:年龄,身体质量指数(BMI)。(2)胰岛素抵抗相关指标:取血清,采用全自动电化学发光分析仪空腹血糖(FPG)及空腹胰岛素(FINS),胰岛功能采用稳态模型计算HOMA 胰岛素抵抗指数(HOMA‑IR)=(FPG×FINS)/22.5,HOMA 胰岛素分泌指数(HOMA‑IS)=(20×FINS)/FPG‑3.5。(3)两组血清及胎盘中miR‑101与miR‑122表达水平差异。
1.4 统计学处理
采用SPSS 21.0 统计学软件进行数据分析,计量资料以表示,采用t检验;采用Pearson 相关性分析血清miR‑101与miR‑122水平与临床参数和胰岛素抵抗相关指标的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 临床参数和胰岛素相关指标
观察组孕产妇BMI、FBG、FINS、HOMA‑IS 及HOMA‑IR 指标均高于对照组,差异有统计学意义(P<0.05 或0.01),见表1。
表1 两组临床参数和胰岛素相关指标比较 ()

表1 两组临床参数和胰岛素相关指标比较 ()
与对照组比较:aP<0.05,bP<0.01
2.2 miR‑101 和miR‑122 在两组血清和胎盘组织中表达水平
miR‑101和miR‑122在观察组血清和胎盘组织中表达水平均明显高于对照组(P<0.01),见表2 和图1、2。
图1 miR‑101的qPCR扩增曲线图
表2 miR‑101和miR‑122在两组血清和胎盘组织中表达水平比较 ()

表2 miR‑101和miR‑122在两组血清和胎盘组织中表达水平比较 ()
与对照组比较:aP<0.01
2.3 各项指标与血清miR‑101 及miR‑122 水平的相关性分析
血清miR‑101 水平与FBG 呈正相关,与FINS、HOMA‑IS 呈负相关(P<0.05);miR‑122 水平与FBG、HOMA‑IR 呈正相关,与FINS 呈负相关(P<0.05),见表3。
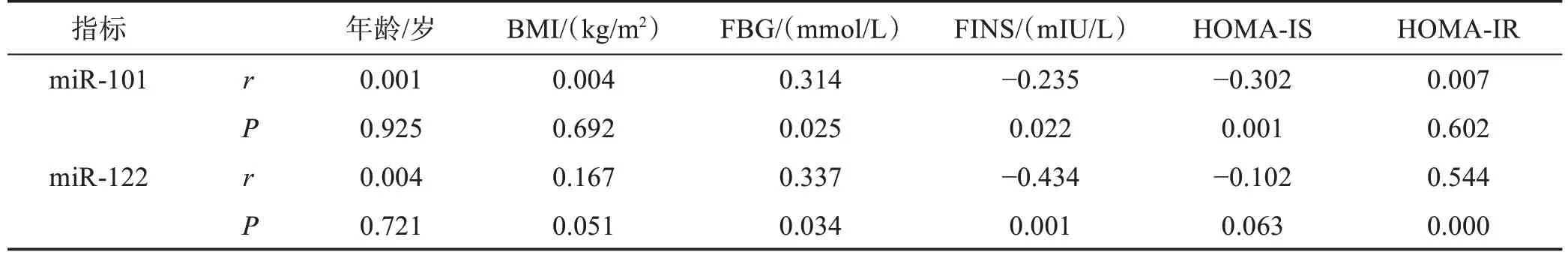
表3 各项指标与血清miR‑101及miR‑122水平的相关性分析
3 讨论
当前,随着孕妇饮食结构及生活方式的改变,GDM 发病率呈逐年上升趋势。GDM 易造成较多种不良妊娠结局,对母婴均有严重危害,甚至长远影响,早期诊断并及时治疗可提高孕妇及胎儿的预后[4]。因此,新的生物学标记物在早期诊断GDM 尤为重要。miRNA 是一类进化过程高度保守的、广泛参与多种疾病的发生与进展的小分子非编码RNA,其在代谢调控和细胞功能中起到“动态调节器”的作用[5]。而近年来miRNA与GDM 的相关研究较为新颖,同时也为本研究提供了理论支持。

图2 miR‑122的qPCR扩增曲线图
本研究结果显示,miR‑101及miR‑122水平在GDM 患者血清及胎盘组织中均呈高表达,提示两者可能直接或间接参与了GDM的发生和发展。有多项研究证实,miR‑101 可通过调控EZH2/H3K27me3 通路参与调控多种疾病的进展,其中在胚胎横纹肌肉瘤、肺癌、膀胱移行细胞癌中,其通过降低EZH2/H3K27me3 表达,从而抑制细胞增殖来影响肿瘤进展[6‑8]。胎盘形成的前提是胎盘滋养细胞对母体子宫内膜的侵入及黏附,而miR‑101 在此过程中可能通过调控EZH2/H3K27me3 通路来影响胎盘滋养细胞的功能,导致胎盘滋养细胞迁移及增殖能力降低,参与GDM 发病[9]。而针对miR‑122 而言,其是前体基因位于18q21.31位点,参与了糖酵解、脂肪细胞分化、胰岛素分泌等代谢相关的生物学过程调控[10‑11]。在胰岛素抵抗细胞模型中,miR‑122 呈高度表达,而通过转染miR‑122 模拟物,AMPK 基因表述水平下调,进而加重胰岛素抵抗程度[12]。另外,胰岛素抵抗水平是胰岛细胞功能的一个重要指标,本研究在GDM 产妇胰岛素抵抗相关指标均比正常产妇的明显增高,且在相关性分析中,GDM 产妇血清miR‑101 水平与FBG 呈正相关,与FINS、HOMA‑IS 呈负相关;miR‑122 水平与HOMA‑IR、FBG 呈正相关,与FINS 呈负相关。说明GDM 产妇在胰岛素分泌状态下,产妇血清miR‑101表达显著下调;而产妇呈胰岛素抵抗状态时,其血清miR‑122 表达显著上调,miR‑122 部分的结果与禤文婷[3]等的研究结果基本一致,但对于miR‑122 作用的靶向信号通路仍需作进一步的研究与探讨。
综上,miR‑101及miR‑122水平在GDM产妇血清及胎盘中均呈高表达状态,其可能直接或间接参与了GDM 的发生和发展。此外,miR‑101 表达与胰岛素分泌指数呈负相关;miR‑122 表达则与胰岛素抵抗指数呈正相关,因此可推断,通过干预miR‑101 及miR‑122 表达,可阻止胰岛细胞功能的抑制或分泌,或可能成为GDM诊断、治疗及预后的新靶点。
