PTEN、Twist1 与肿瘤浸润淋巴细胞PD1 的表达在三阴型乳腺癌中的临床病理意义
2021-07-03曹锦涛冯振中
李 然,曹锦涛,闵 锐,孙 帅,冯振中,2,李 楠
(1. 蚌埠医学院第一附属医院病理科/蚌埠医学院病理学教研室,安徽 蚌埠233030;2. 安徽医科大学第二附属医院病理科,安徽 合肥230000)
三阴型乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(ER)、孕激素受体(PR)以及人类表皮因子受体(Her2)均呈阴性表达的一类高度多样化与异质性的乳腺癌,占所有乳腺癌的15%~20%[1]。与其他类型乳腺癌相比,TNBC 患者的组织学与临床分期呈现高度侵袭性特征[2]。治疗方面,由于缺乏相应激素受体,传统的内分泌及靶向治疗效果不佳,术后复发转移风险高[3]。近年来,肿瘤浸润淋巴细胞(tumor infiltrating lympho‐cytes,TIL)及肿瘤免疫检查点阻断(immune check‐point blockade,ICB)疗法逐渐引起关注。程序性死亡受体1(programmed cell death protein 1,PD1)是肿瘤发生免疫逃逸的关键蛋白,研究表明PD1 高浸润的T 细胞代表T 细胞耗竭更多、更具侵袭性的生物 学 特 征,以 及 抗PD1/PDL1 治 疗 效 果 会 更 好[4]。上皮间质转化(epithelial-mesenchymal transition,EMT)参与相关免疫抑制机制也有报道[5]。本实验通过观察TIL 及PD1 受体阳性肿瘤浸润淋巴细胞(TILPD1)在TNBC 中的表达及对预后的影响,探讨PTEN/Twist1 在TNBC 中的表达,各蛋白之间是否存在关联,对患者预后的作用,探究TNBC 肿瘤组织中PTEN 对于EMT 标志蛋白Twist1 的影响与调控,进而观察PTEN/Twist1 对于下游TILPD1代表的T 细胞耗竭的调控,以期为TNBC 的相关免疫治疗提供思路与帮助。
1 材料与方法
1.1 材料收集
收集2013~2018 年蚌埠医学院第一附属医院诊断为乳腺癌患者标本,包括TNBC 患者标本76例,随机抽取其他类型乳腺癌(NTNBC)标本47 例。由两名以上资深病理医师阅片,根据最新版ASCO指南及AJCC 第八版指南进行组织学与临床的分级分期,并判断乳腺癌患者的ER、PR、Her-2 以及PTEN、Twist1 与TILPD1 的表达程度。实验通过了蚌埠医学院伦理委员会的批准,并严格遵守赫尔辛基宣言操作。纳入标准:患者术前未接受生物学治疗、放化疗等辅助治疗手段;患者无其他恶性肿瘤及慢性病病史;患者确诊为乳腺癌,并经阅片复习有明确乳腺癌免疫组化分型;患者对实验知情同意,同意医师定期随访。免疫组化结果若肿瘤组织不充分,存在非特异性染色则不纳入。
1.2 肿瘤浸润淋巴细胞(TILs)程度
通过苏木素-伊红(HE)染色切片,以肿瘤间质淋巴细胞浸润作为评估对象,低倍镜下观察淋巴细胞在间质区域内所占比例,并进行分级。TILs 分级评 分 依 据2014 年 国 际TILs 工 作 小 组 建 议 判 定[6],即:阴性:< 1% ;弱阳性:1%~20%;中等阳性:20%~50% ;强阳性:≥50%。
1.3 免疫组化
采取Envision 两步法进行免疫组化染色,一抗抗体来源见表1,二抗试剂、DAB 显色剂等均购自福州迈新生物科技有限公司。免疫组化判断标准:肿瘤区域随机选取5 个高倍视野,以细胞内定位区域出现棕黄染色为阳性。ER、PR 及Ki-67、Twist1 等核阳染色依据阳性细胞所占比例判断(−:<1%;+ :<25%;++:25%~70%;+++:>70% )。PTEN 在肿瘤细胞中,以及PD1 在肿瘤浸润淋巴细胞(TILPD1)中呈现胞膜或胞浆阳性,以>1%定义为阳性,依据阳性细胞百分比判断表达强度综合计数分析[7](阳性染色:淡黄色1 分;棕黄色2 分;黄褐色3 分。阳性细胞百分比:<1% 计0 分;< 5% 计1 分;25%~70% 计2 分;> 0% 计3 分。两者相加,<1 分为−;1~2 分为+;3~4 分为++;>5 分为+++)。
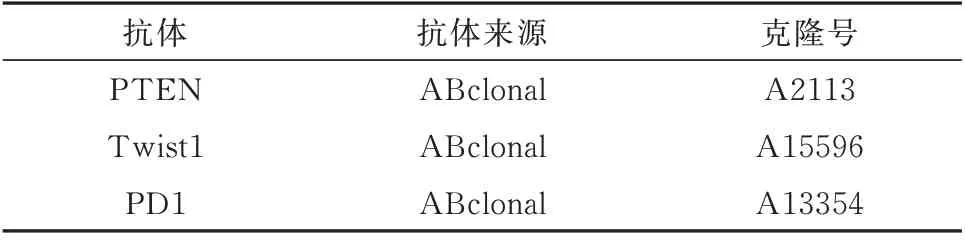
表1 免疫组化抗体来源Tab 1 Sources of immunohistochemical antibodies
1.4 统计学处理
数据统计运用SPSS 软件26.0 版本,两组间率的比较使用卡方检验,多组检验使用ANOVA 方差分析。单因素Kaplan-Meier 生存分析运用Log Rank 检验,运用Cox 风险比例回归模型进行多因素生存分析;相关性分析使用Spearman 相关性检验,运用RStudio 软件进行统计分析及绘图制作,P<0.05 为差异有统计学意义。
2 结果
2.1 TNBC 及NTNBC 患者的临床病理特征
TNBC 患者总生存期5~171 个月,随访过程中9 例患者死亡,12 例患者出现转移。相对于NTN‐BC 患者,TNBC 患者的发病年龄更轻,肿瘤直径更大,且有更大的转移倾向(P=0.012)、更高的组织学分级(P=0.048)、TNM 分期(P<0.01)(表2),以及更差的预后(P=0.014)(图1)。
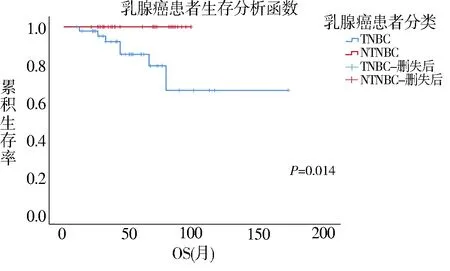
图1 TNBC 与NTNBC 患者总生存期比较Fig 1 Cumulative survival rate comparison between TN‑BC and NTNBC patients
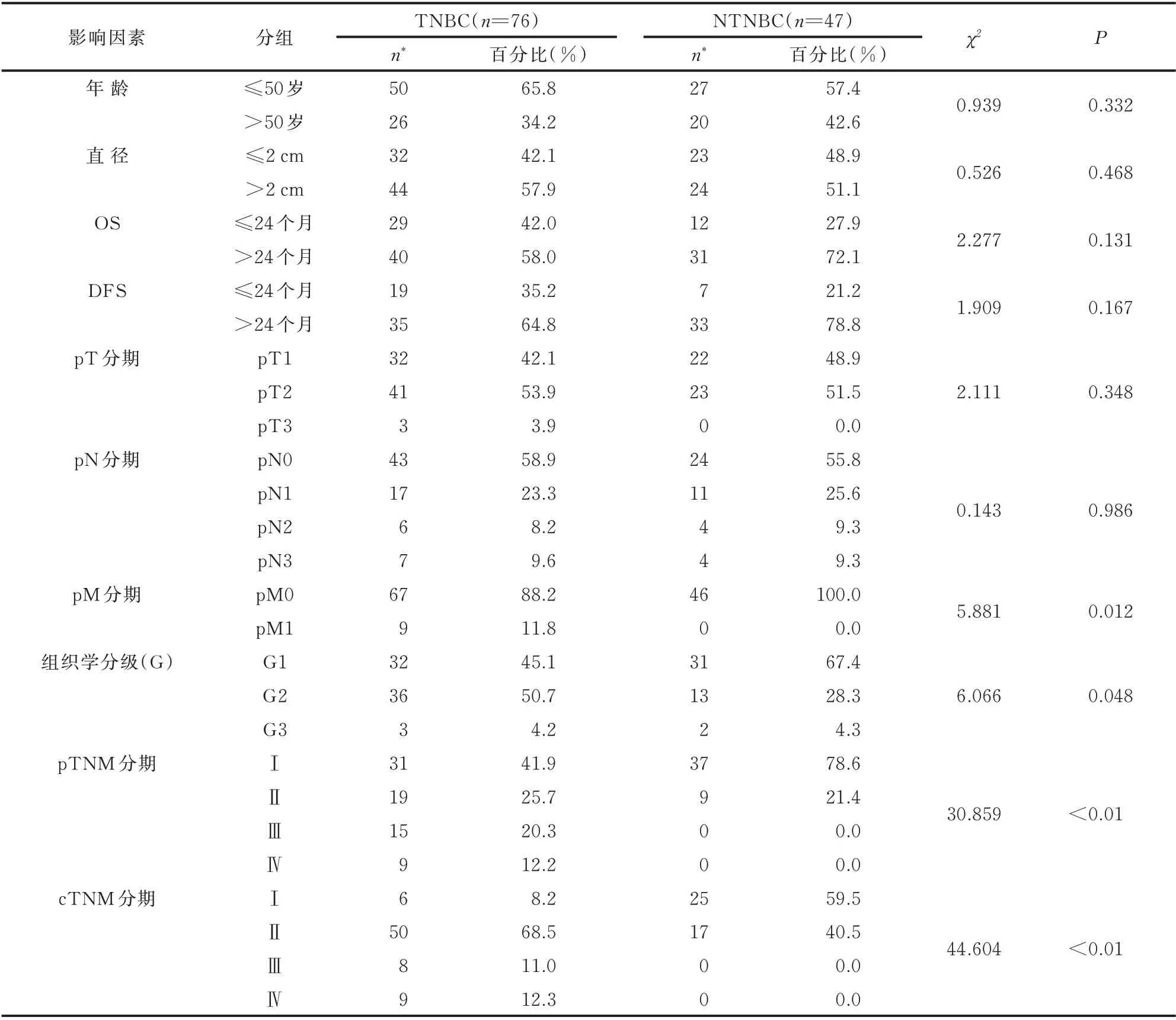
表2 TNBC 及NTNBC 病例的临床病理特征Tab 2 Clinicopathological characteristics of TNBC and NTNBC cases
2.2 TNBC 与NTNBC 组 织 中PTEN、Twist1、TILPD1 的表达
TNBC 患者PTEN 缺失表达(20.6%)与TIL‐PD1 阳性表达(85.5%)高于NTNBC,但两者差异无统计学意义(P>0.05)。另外,TNBC 组中,Twist1 表达比例较高,淋巴细胞浸润比例更高(92.9%)、程度更大,两组间差异有统计学意义(P<0.05)(图2、表3)。

表3 TNBC 与NTNBC 组织中PTEN、Twist1、PD1 的表达Tab 3 Expression levels of PTEN,Twist1 and TILPD1 in TNBC and NTNBC tissues
2.3 TNBC 组织中PTEN、Twist1 与PD1 的相关性
Spearman 相关性检验显示,TNBC 组织中PTEN 与Twist1 以及TILPD1 的表达呈负相关,Twist1 与TILPD1 的表达呈正相关,检验结果和相关系数有统计学意义(P<0.05)(表4、图3)。TILPD1 的表达与肿瘤间质TIL 浸润程度显著正相关(表4)。PTEN 与肿瘤的临床分期显著负相关(表4),与TIL 浸润程度、肿瘤转移率、组织学分级也有一定的关联性。

图3 TNBC 组织中各因素的相关性热图Fig 3 Correlation heat map of various factors in TNBC tissues
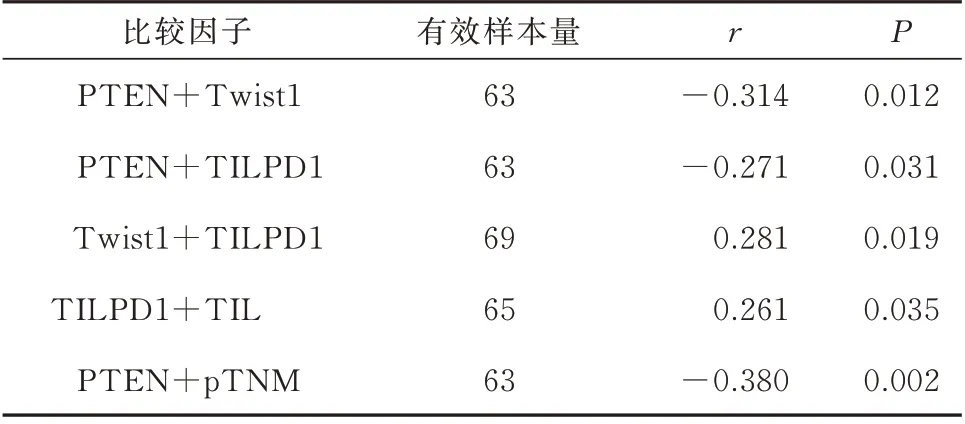
表4 TNBC 组织中各因素的相关性分析Tab 4 Correlation analysis of various factors in TNBC tissues
2.4 TNBC 患者的单因素及多因素生存分析
以总生存期(overall survival,OS)为因变量,运用Log rank 检验分析,依据PTEN 蛋白有无表达、Twist1 及TILPD1 蛋白表达程度高低将病例各分为两组,检测各临床病理因素及各因子对TNBC 患者生存时间的影响。Kaplan-Meier 分析显示,较低的TNM 分级、无淋巴结及远处转移的患者临床预后更好,而PTEN 缺失表达、TILPD1 高表达的患者预后不佳(表5)。利用多因素COX 回归分析,运用Omnibus 检验建立模型,显示PTEN 的缺失表达(图4A、B)与TILPD1 高表达,患者预后不佳(图4C、D),是影响TNBC 患者生存预后的独立危险因素(表6)。
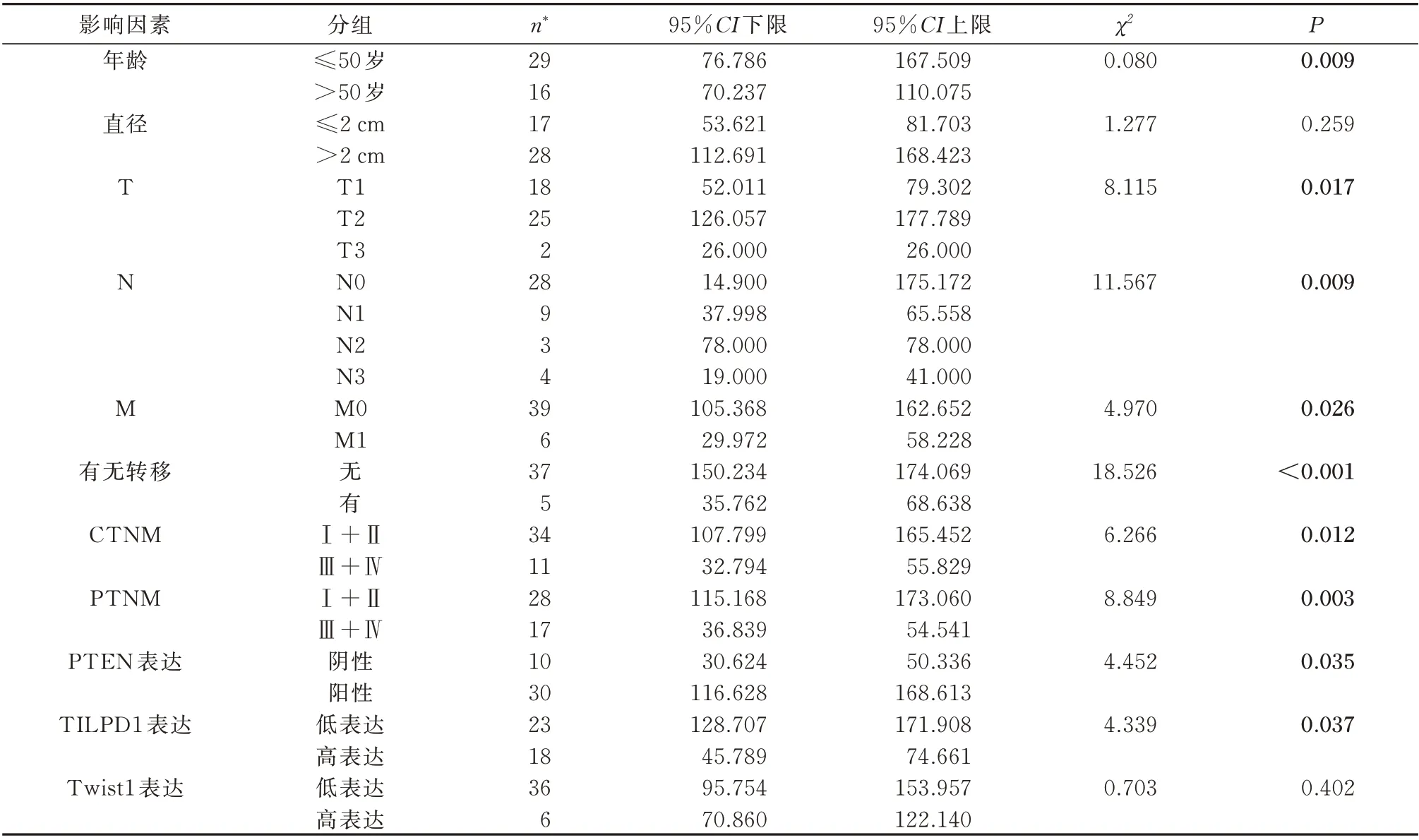
表5 Kaplan-Meier 单因素生存分析Tab 5 Univariate Kaplan-Meier survival analysis of survival for TNBC patients
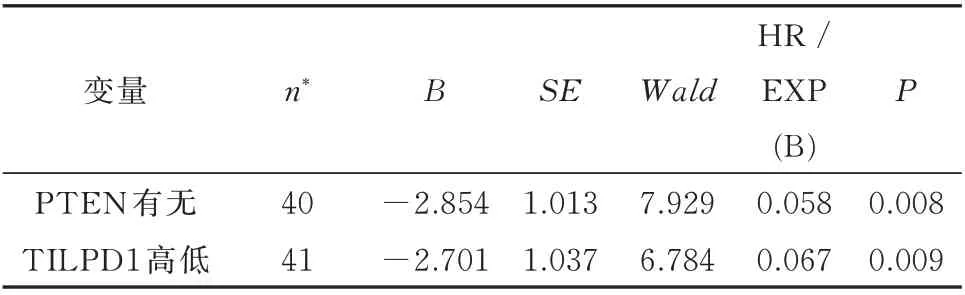
表6 COX 回归多因素生存分析Tab 6 COX multivariate analysis of factors affecting survival of TNBC patients

图4 TNBC 患者单因素及多因素分析生存曲线图Fig 4 Survival curves of TNBC patients by univariate and multivariate Kaplan-Meier survival analysis
2.5 患者的临床治疗与预后
TNBC 患者术后治疗:67 例接受了辅助化疗,其中51 例(76.1%)患者使用了TAC 联合化疗方案(多西他赛+环磷酰胺+表柔比星),4 例患者联合紫杉醇化疗,2 例患者联用铂类药物,另有联合放疗的患者4 例。随访显示,22 例患者处于病情稳定状态(stable disease,SD),11 例患者疾病进展(pro‐gressive disease,PD),仅有1 例患者完全缓解(com‐plete response,CR)。NTNBC 患者术后:共35 例患者接受了辅助化疗,均使用TAC 方案,无患者接受联合放疗。其中3 例患者疾病进展,其余患者病情稳定。
3 讨论
TNBC 是一类异质性强、侵袭性强的乳腺癌,与其他类型乳腺癌相比,TNBC 在年轻女性中发病率高,远端转移率高,疾病特异性生存率较低,并伴随着高级别的组织学类型与脑转移高风险,术后复发转移风险高[3]。此外,TNBC 有更强的免疫原性、更多的免疫活性及免疫途径基因的富集和较高的淋巴细胞浸润水平[8]。近年来,针对细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associat‐ed antigen-4,CTLA-4)、程序性死亡受体PD1 及其配体PDL1 的ICB 疗法已被批准用于治疗多种癌症,包括黑色素瘤、非小细胞肺癌和膀胱癌等,并取得 一 定 成 效[9]。而TNBC 患 者 中 从PD1/PDL1 抑制剂治疗中获益的患者仍然有限[10]。因此,探究TNBC 肿瘤免疫微环境相关机制有益于提高ICB疗法的特异性,有助于改善患者预后。
PD1 是一类I 型跨膜蛋白,主要表达于活化的T 细胞表面。PD1 分子能够通过与其配体PDL1 结合,介导其对效应T 细胞的抑制作用,从而抑制机体的抗肿瘤免疫功能[11]。T 细胞衰竭,即在肿瘤微环境的过度刺激下,T 细胞分泌细胞因子和增殖的能力受损,并伴有免疫检查点受体(如PD1、TIM3、和CTLA4 等)过度表达。TILPD1 一定程度上能够作为T 细胞耗竭标志物,表现为耗竭基因的显著丰富,耗竭相关转录因子的偏态分布,相关免疫检查点受体蛋白TIMS、CTLA4 的共表达,更具侵袭性的生物学特征,以及抗PD1/PDL1 治疗的更好疗效[4,12]。同时,Ren 等[7]研究发现,间质淋巴细胞中的PD1 表达比非肿瘤细胞中PDL1 的表达更能预测TNBC 患者的预后。PTEN是一种常见的抑癌基因,约有25%~30%的TNBC 病例会伴有PTEN 蛋白的缺失,该突变与TNBC 患者分子异质性、耐药性及化疗后不良反应密切相关,并伴有较差的抗PD1/PDL1 治 疗 效 果[13]。Twist1 是 由Twist1基 因编码的一类高度保守的碱性螺旋-环-螺旋蛋白,并能促进肿瘤细胞EMT 相关过程,增强肿瘤的侵袭性、遗传不稳定性,并参与PD1/PDL1 相关免疫机制的调节[5]。
在肿瘤免疫微环境中,功能紊乱的T 细胞往往高表达PD1 蛋白[11]。本研究发现,PTEN 的缺失与TILPD1 高表达是影响TNBC 患者生存预后的独立危险因素,提示PD1 受体阳性肿瘤浸润淋巴细胞高表达可能作为预后不佳的预测指标。与本研究一致,Meng 等[11]对PD1 降解机制的研究发现,敲除连接蛋白FBXO38 不会影响微环境中T 细胞的发育与活化,T 细胞表面PD1 表达增高,导致小鼠肿瘤进展增快。另外,有研究对218 例浸润性乳腺癌患者的回顾性分析显示,肿瘤浸润PD1 阳性T 细胞与乳腺癌患者不良预后显著相关[14]。
相关研究表明,多种机制参与PTEN基因对TNBC 的调控作用[15]。本研究结果显示,PTEN 的缺失可作为TNBC 患者的预后不良独立危险因素,能够负向调控Twist1 与PD1 蛋白的表达,并与TIL的分布有一定的联系。另外,PTEN 与肿瘤的临床分期显著负相关,与TIL 浸润程度、肿瘤转移率、组织学分级也有一定的关联性,提示PTEN 作为负向调控分子,在TNBC 组织的肿瘤免疫微环境与EMT 相关机制中发挥重要作用。
另外,与其他类型乳腺癌相比,Twist1 在TN‐BC 组织中表达上调,与TILPD1 的表达呈正相关,提示Twist1 相关EMT 调控机制在PTEN 对于TILPD1 的调节中起到一定的作用。与本研究的结果一致,Guestini 等[16]的研究也表明PTEN 的缺失表达是TNBC 患者新辅助化疗(neoadjuvant chemo‐therapy,NAC)后不良反应的独立危险因素。有学者前瞻性研究结果也显示,在接受PDL1/PD1 抑制剂治疗的患者中,转移性TNBC 患者的肿瘤PTEN沉默突变分别与较高的组织学分期及较差的无病生存期(disease free survival,DFS)及OS 密切相关[13]。Ueno 等[17]认为肿瘤组织中多种EMT 相关分子参与到肿瘤免疫微环境PD1/PDL1 蛋白表达调控之中。本研究结果一定程度上证实了PTEN及TILPD1 在TNBC 中的表达及对预后的影响,PTEN 表达对于TILPD1 及TIL 调控作用,以及相关免疫反应与EMT 标志蛋白Twist1 的相关性。
TNBC 患者中存在一定程度耐药的情况。实验组67 例接受辅助治疗的TNBC 患者中,处于SD状 态 患 者22 例,PD 状 态11 例,仅 有1 例 完 全 缓 解,化疗反应不佳的患者占比16.4%。目前,TNBC 患者的手术治疗方式以根治性手术为主,但保乳手术的可行性也逐渐引起人们的重视[18]。临床上尚无TNBC 患者特异敏感的化疗及靶向药物。部分TNBC 患者呈现雄激素受体(androgen receptor,AR)亚型,该类型对于雄激素治疗敏感。PAPR 抑制剂奥拉帕尼、PD1 抑制剂、PI3K/AKT/mTOR 抑制剂在TNBC 中的作用也有所报道[19]。约40%的中晚期患者能够从紫杉烷类药物、蒽环霉素的联合化疗中获得病理完全缓解(pathological complete re‐sponse,PCR),联合应用PD1/PDL1 单抗能显著提高TNBC 患者的PCR 率[9]。
转移性TNBC 患者对于抗PD1/PDL1 的应答率较低,仅5%。在微环境PDL1 阳性的患者中,PD1/PDL1 阻 断 剂 治 疗 的 应 答 率 增 高[10]。Meng等[11]的小鼠体内外研究显示,IL-2 能够通过促进肿瘤微环境中FBXO38 的复表达,从而介导PD1 蛋白的泛素化降解,从蛋白水平上抑制抗肿瘤免疫。IL-2 与抗PD1 联合治疗或许是新的研究方向。有学者对于70 例TNBC 患者的前瞻临床试验显示短期阿霉素和顺铂的使用能够诱导增加TNBC 患者对于PD1 阻断剂的反应,诱导更有利的肿瘤微环境,提高相关免疫基因的转录表达[20]。同时,Schmid 的IMpassion130 临床研究也显示新辅助化疗中紫杉醇与阿妥珠单抗连用可以有效改善PTEN 阴性PDL1阳性表达的转移性TNBC 患者的生存预后[21]。
本研究探讨了TNBC 中Twist1、PTEN、TIL‐PD1 蛋白的表达,并与对照组间比较,分析其与患者临床病理特征及预后的关联性。PTEN 缺失表达与TILPD1 的高表达是影响TNBC 患者生存预后的独立危险因素。肿瘤微环境中TILPD1 水平受PTEN基 因 的 调 控,并 与EMT 相 关 蛋 白Twist1 存在着复杂平衡关系,相关机制有待于进一步探索。本课题在蛋白水平上初步探讨了TNBC 组织中PTEN 蛋白通过EMT 相关通路对于肿瘤微环境中T 细胞耗竭的调控,但是相关分子调控机制,以及TILPD1 高表达的肿瘤组织与抗PD1/PDL1 联合治疗的相关性,尚有待后续实验及临床前瞻性研究进一步探讨。
作者贡献度说明:
李然负责数据分析、文章撰写,李楠负责实验设计、文章审校,冯振中负责实验设计及指导,曹锦涛负责免疫组化实验及患者随访,闵锐负责免疫组化数据分析,孙帅负责蜡块收集及免疫组化实验。
