Nocth 信号通路对糖尿病足溃疡炎症因子及转化生长因子表达的影响
2021-07-03柳国斌黄仁燕严仕梦施陈燕陈君灏
韩 强,柳国斌,黄仁燕,徐 烽,严仕梦,施陈燕,陈君灏
(上海中医药大学附属曙光医院,上海中医药大学,上海201203)
中国约有1.1 亿糖尿病患者,糖尿病前期状态者约4.9 亿[1]。糖尿病足溃疡是导致糖尿病患者截肢的重要原因[2]。我国糖尿病足溃疡的治疗花费约占糖尿病治疗整体总费用的1/3[3]。糖尿病足溃疡给患者造成了沉重的负担,是亟待解决的医学问题。
糖尿病足溃疡的病因包括周围神经病变、下肢血管病变、感染、创伤[4‐6]等。同时糖尿病患者自身的创面细胞和生长因子活性降低,全身慢性炎症状态,局部血管生成减少等现象也导致糖尿病足溃疡愈合困难[7,8]。
创面愈合的进程与炎症、细胞增殖、血管形成以及组织形成有关[9]。然而,持续的强烈炎症反应会造成细胞增殖期和重塑期的进程延迟[10]。 糖尿病足溃疡强烈的炎症反应造成各类细胞、细胞因子的协调紊乱[11]。有研究表明糖尿病溃疡会刺激促炎细胞因子白介素‐1β(IL‐1β)、白介素‐6(IL‐6)和肿瘤坏死因子‐α(TNF‐α)表达[12‐14]。糖尿病足细菌感染患者炎症因子CRP、TNF‐ɑ、IL‐6 与疾病程度相关[15]。此外,糖尿病患者细胞增殖受损,血管生成减少,生长因子下降间接造成糖尿病足溃疡愈合的炎症期向增殖期过渡困难[11,14]。有研究报道创面愈合过程中Notch 信号与炎症细胞因子表达与调控巨噬细胞活化有关[16,17]。
笔者在前期临床病例研究[18,19]中发现紫朱软膏能够有效提高糖尿病足及下肢慢性皮肤溃疡的治愈率。本研究以糖尿病足溃疡大鼠模型为平台,观察Notch 信号对炎症因子、趋化因子和生长因子的作用,以及紫朱软膏对该过程的干预。
1 材料与方法
1.1 实验动物
雄性Sprague‐Dawley(SD)大鼠(72 只),清洁级,体质量(180±10)g,由上海中医药大学实验动物中心提供。饲养环境:室温为(23±2)℃,相对湿度为(56±10)%,12 h 无光照/12 h 人工光照,自由饮食。实验程序遵循上海中医药大学实验动物中心指导原则。
1.2 主要试剂及药物
高脂饲料成分:基础饲料73%(大麦15%,小麦31%,玉米15%,麸皮15%,鱼粉6%,豆粕、油和盐共18%),猪油20%,奶粉2%,胆固醇1%,蔗糖4%。以上材料由上海中医药大学实验动物中心提供。
链脲佐菌素(STZ),Sigma 公司;1.5% STZ 液配制方法:柠檬酸(FW:210.14)2.1 g 加入双蒸水100 mL 中配成A 液。柠檬酸钠(FW:294.10)2.94 g加入双蒸水100 mL 中配成B 液。用时将A、B 液按1∶1 比例混合,pH=4.2~4.5,注射时用柠檬酸缓冲液以1.5%的浓度溶解。
外用重组牛碱性成纤维细胞生长因子(商品名:贝复济,rb‐bFGF),珠海亿胜生物制药有限公司,国药准字S10980077。
Notch 信号通路激动剂与抑制剂:激动剂Rat Jagged1 Fc chimera(Mouse myeloma cell line,NSO derived rat Jagged 1 protein,Sigma),使 用 方法:50 μg 溶解在33.6 mL PBS 液,每只每次围绕创面周边多点皮下注射0.2 mL。抑制剂LY411575(γ‐secretase inhibitors),使 用 方 法:50 mg 溶 解 在33.6 mL 溶解液,每只每次围绕创面周边多点皮下注射0.2 mL。溶解液配方:10% DMSO,40%PEG300,5% Tween‐80,45% saline。使用方法:50 mg。
紫朱软膏主药与基质辅料的比例为1∶8,其中主药(重量计):朱砂、紫草、龙血竭、黄芪、黄芪、冰片。各药物比例为7∶3∶3∶6∶5∶1。药物由武汉马应龙生产提供。
1.3 主要仪器
烫伤仪SQL‐5Q 烫伤仪,上海欣软信息科技有限公司。ELISA 试剂盒,BD 公司。PureLink RNA Mini Kit(Thermo fisher)用于提取mRNA。Super‐Script Ⅲ第一链合成系统,Life Technologies 公司。SYBR®GreenFastMix,Takara 公司。血糖仪,罗氏公司。荧光定量PCR 仪,Applied Biosystems 公司。电泳仪,BIO‐RAD 公司。转膜仪,BIO‐RAD 公司。微孔板扫描分光光度计MOX200R 型BioTek 公司。酶标仪Thermo 公司。
1.4 糖尿病模型的建立
实验模型:实验研究采用糖尿病足溃疡大鼠模型[20](D)作为实验模型,使用普通溃疡大鼠模型(N)作为对照模型。方法如下:
1.4.1 实验模型制备 普通溃疡组(N)用普通饲料饲养;糖尿病组用高脂饲料饲养8 周后,空腹24 h 后腹腔注射1.5%链脲佐菌素35 mg/kg,24 h 后尾静脉取血测量血糖>16.7 mmol/L,制成糖尿病模型。评价标准:注射链脲佐菌素24 h 后,测得血糖大于16.7 mmol/L,稳定24 h 后复测随机血糖仍大于16.7 mmol/L。结果:糖尿病造模24 h 后测血糖大于16.7 mmol/L,可观察到大鼠多尿,垫料潮湿,大鼠的活动力下降,随后体重下降。
1.4.2 糖尿病足溃疡模型制备 糖尿病大鼠造模成功2 周后,腹腔注射3%戊巴比妥钠2 mL/kg 剂量麻醉后使用烫伤仪烫伤(参数设置:接触压力9.8 N,探头温度90℃,持续时间10 s,接触面积4 cm2),烫伤深度为深Ⅱ度。24 h 后沿着交界区清除残留皮肤即造成溃疡创面,制成糖尿病足溃疡模型。评价标准:烫伤后可见皮肤苍白光亮或皮肤有水疱出血。取烫伤区域皮肤组织固定于10%甲醛溶液中,H & E 结果可见皮肤组织炎症细胞浸润,毛囊、汗腺等附件破坏。
1.4.3 普通溃疡模型 普通溃疡大鼠模型(Normal ulcer,N):普通饲料喂养8 周后,3%戊巴比妥钠麻醉后使用恒温恒压烫伤仪器(设置90 ℃,10 s ,9.8 N)造成深Ⅱ度烫伤,完成普通溃疡模型的制备,造模成功标准同上。
实验分组:72 只雄性SD 大鼠随机分为9 组。按照各模型建立方法建立各组模型,NC:普通溃疡模型对照组;NT:普通溃疡模型中药组;DC:糖尿病足溃疡模型对照组;DT:糖尿病足溃疡模型中药组;DW:糖尿病足溃疡模型西药组;DT‐A:糖尿病足溃疡模型+激动剂+中药组;DC‐A:糖尿病足溃疡模型+激动剂组;DT‐I:糖尿病足溃疡模型+抑制剂+中药组;DC‐I:糖尿病足溃疡模型+抑制剂组。其中,对照组采用生理盐水换药,西药组贝复济800 IU 每日换药,中药组紫朱软膏每日换药(药物纱布制作方法:20 g 药膏制作4 张药物纱布,每张剪成16 片,每次一片换药)。干预观察7 d 后麻醉处死取材。
1.5 检测方法
酶联免疫吸附法(ELISA):检测血清炎症因子:TNF‐α、IL‐1β、IL‐6、IL‐17A。根据制造商的说明书,使用市售的ELISA 试剂盒(R&D Systems,Minneapolis,MN,USA)测定伤口中炎性细胞因子的浓度。从标准曲线计算蛋白质浓度。将这些值标准化为由Pierce BCA 测定法测定的总蛋白质含量。
RNA 分离和real‐time PCR:检测创面组织炎性细 胞 因 子(TNF‐α、TGF‐α、TGF‐β、IL‐1β、IL‐6、IL‐17)和趋化因子IP‐10、IL‐8、单核细胞趋化蛋白1(MCP‐1)。根据制造商的说明书,使用PureLink RNA Mini Kit(Thermo fisher)从创面组织中分离总RNA。 使 用Life Technologies 的SuperScript ⅢIII‐Strand Synthesis System 合成第一链cDNA。使用SYBR Green 作为实时PCR 进行指标,采用ABI StepOne Plus 实时PCR 系统。PCR 在95℃下进行40 个循环15 s,在60℃下进行1 min。在反应过程中读取荧光,允许连续监测PCR 产物的量。使用Gap‐dh mRNA 作为内部对照标准化数据。见表1。

表1 引物序列信息Tab 1 Primer sequence information
1.6 统计学处理
采用SPSS18.0 软件进行统计分析。实验数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one‐way ANOVA),两组间比较采用两独立样本t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 ELISA 检测结果
2.1.1 各组血清IL‐1β ELISA 检测结果比较
NC 组与DC 组比较,DC 组的IL‐1β 含量较高,差异具有统计学意义(P<0.01),说明实验模型组大鼠IL‐1β 的表达高于普通对照组模型。DC 组与DC‐I 组比较,DC‐I 组的IL‐1β 含量较高,差异具有统计学意义(P<0.01),说明Notch 信号抑制剂LY‐411575 可提高IL‐1β 含量。DC 组与DC‐A 组比较,DC‐A 组的IL‐1β 含量较低,具有统计学差异(P<0.001)。 Notch 信号激动剂Jagged1 可降低实验模型组大鼠IL‐1β 的表达。DC 组与DT 组比较,DT 组的IL‐1β 含量较低,差异具有统计学意义(P<0.01),说明紫朱软膏能降低实验模型组大鼠血清IL‐1β 的 含 量。DT 组 与DT‐I 组 比 较,DT 组 的IL‐1β 含量较低,具有统计学差异(P<0.01),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低IL‐1β 有 影 响,明 显 减 弱 紫 朱 软 膏 对IL‐1β 降 低 作用。见表2。
2.1.2 各组血清IL‐6 ELISA 检测结果比较
NC 组与DC 组比较,DC 组的IL‐6 含量较高,差异具有统计学意义(P<0.01),说明实验模型组大鼠IL‐6 的表达高于普通对照组模型;DC 组与DC‐I组比较,DC‐I 组的IL‐6 含量较低,差异具有统计学意义(P<0.01),说明Notch 信号抑制剂LY‐411575可 降 低IL‐6 含 量。DC 组 与DT 组 比 较,DT 组 的IL‐6 含量较低,差异具有统计学意义(P<0.01),说明紫朱软膏能降低实验模型组大鼠血清IL‐6 的含量。DT 组与DT‐I 组比较,DT 组的IL‐6 含量较低,差异具有统计学意义(P<0.01),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低IL‐6 有影响,明显减弱紫朱软膏对IL‐6 的降低作用。见表2。
2.1.3 各组血清IL‐17A ELISA 检测结果比较
NC 组 与DC 组 比 较,DC 组 的IL‐17A 含 量 较高,差异具有统计学意义(P<0.01),说明实验模型组大鼠IL‐17A 的表达高于普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组的IL‐17A 含量较低,差异具有统计学意义(P<0.01),说明Notch 信号抑制剂LY‐411575 可 大 幅 度 降 低IL‐17A 含 量。DC 组 与DT 组比较,DT 组的IL‐17A 含量较低,差异具有统计学意义(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清IL‐17A 的含量。DT 组与DT‐I组比较,DT 组的IL‐17A 含量较低,差异具有统计学 意 义(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 对紫朱软膏降低IL‐17A 有影响,明显减弱紫朱软膏对IL‐17A 的降低作用。见表2。
2.1.4 各组血清TNF‐α ELISA 检测结果比较
NC 组 与DC 组 比 较,DC 组 的TNF‐α 含 量 较高,差异有统计学意义(P<0.01),说明实验模型组大鼠TNF‐α 的表达高于普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组的TNF‐α 含量较低,差异有统计 学 意 义(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 可 大 幅 度 降 低TNF‐α 含 量。DC 组 与DT 组比较,DT 组的TNF‐α 含量较低,差异有统计学意义(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血 清TNF‐α 的 含量。DT 组与DT‐I 组比较,DT 组的TNF‐α 含量较低,差异有统计学意义(P<0.01),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低TNF‐α 有影响,明显减弱紫朱软膏对TNF‐α 的降低作用。见表2。
表2 ELISA 指标结果总表(n=8,±s)Tab 2 Results of ELISA indicators(n=8,±s)

表2 ELISA 指标结果总表(n=8,±s)Tab 2 Results of ELISA indicators(n=8,±s)
组别NC 组NT 组DC 组DT 组DW 组DT‐A 组DC‐A 组DT‐I 组DC‐I 组F P IL‐1β 71.95±4.20 59.27±1.18 243.28±6.36 104.54±8.43 326.18±4.20 127.32±4.43 151.26±2.24 258.18±0.41 258.95±2.22 1476.757<0.001 IL‐6 11.39±0.65 9.02±0.77 43.18±0.63 20.24±1.82 60.36±1.62 25.33±1.38 31.34±1.26 49.36±1.86 13.85±1.13 580.815<0.001 IL‐17A 34.03±0.76 29.88±0.80 172.23±6.31 44.39±5.16 159.59±4.30 63.61±1.61 75.74±2.55 121.46±3.32 41.76±1.61 767.809<0.001 TNF‐α 43.90±0.53 124.98±2.62 144.54±3.54 46.45±5.55 179.11±4.59 72.37±8.61 81.99±3.45 147.64±2.25 50.25±3.02 422.654<0.001
2.2 实时聚合酶链反应(Real‐time PCR)检测结果
2.2.1 肿 瘤 坏 死 因 子‐α(TNF‐α)PCR 检 测 结 果NC 组 与DC 组 比 较,DC 组 的TNF‐α 含 量 较 高,具有统计学差异(P<0.01),说明实验模型组大鼠创面TNF‐α 的 表 达 高 于 普 通 对 照 组 模 型;DC 组 与DC‐I 组比较,DC‐I 组的TNF‐α 含量较低,具有统计学 差 异(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 可 降低TNF‐α 含量。DC 组与DT 组比较,DT 组的TNF‐α 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清TNF‐α 的含量。DT 组与DT‐A 组比较,DT‐A组的TNF‐α 含量较高,具有统计学差异(P<0.01),说明Notch 激动剂Jagged1 对紫朱软膏降低TNF‐α有负向影响,减弱紫朱软膏对TNF‐α 降低作用。DT 组与DT‐I 组比较,两组无统计学差异(P=0.146)。见表3。
2.2.2 白细胞介素‐1β(IL‐1β)PCR 检测结果 NC组与DC 组比较,DC 组的IL‐1β 含量较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面IL‐1β的表达高于对普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组的IL‐1β 含量较低,具有统计学差异(P<0.01),说明Notch 信号抑制剂LY‐411575 可降低IL‐1β 含量。DC 组与DT 组比较,DT 组的IL‐1β 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清IL‐1β 的含量。DT 组与DT‐I 组比较,DT‐I 组的IL‐1β 含量较低,具有统计学差异(P<0.05),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低IL‐1β 有影响,增强紫朱软膏对IL‐1β 的降低作用。见表3。
2.2.3 白细胞介素‐6(IL‐6)PCR 检测结果 NC 组与DC 组比较,DC 组的IL‐6 含量较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面IL‐6 的表达高于普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组 的IL‐6 含 量 较 低,具 有 统 计 学 差 异(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 可 降 低IL‐6 含量。DC 组与DT 组比较,DT 组的IL‐6 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清IL‐6 的含量。DT 组与DT‐I 组比较,DT‐I 组的IL‐6 含量较低,具有统计学 差 异(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 对紫朱软膏降低IL‐6 有影响,明显增强紫朱软膏对IL‐6 的降低作用。见表3。
2.2.4 白细胞介素‐17(IL‐17)PCR 检测结果 NC组与DC 组比较,DC 组的IL‐17 含量较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面IL‐17的表达高于普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组 的IL‐17 含 量 较 低,具 有 统 计 学 差 异(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 可 降 低IL‐17 含量。DC 组与DT 组比较,DT 组的IL‐17 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清IL‐17 的含量。DT 组与DT‐I 组比较,DT‐I 组的IL‐17 含量较低,具有统计学差异(P<0.01),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低IL‐17 有影响,明显增强紫朱软膏对IL‐17 的降低作用。见表3。
2.2.5 趋化因子IP‐10(IP‐10)PCR 检测结果 NC组与DC 组比较,DC 组的IP‐10 含较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面IP‐10 的表达高于普通对照组模型;DC 组与DC‐I 组比较,DC‐I 组 的IP‐10 含 量 较 低,具 有 统 计 学 差 异(P<0.01),说明Notch 信号抑制剂LY‐411575 可降低实验模型组大鼠IP‐10 含量。DC 组与DT 组比较,DT组的IP‐10 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能降低实验模型组大鼠血清IP‐10 的含量。 DT 组与DT‐I 组比较,DT 组的IP‐10 含量明显升高,具有统计学差异(P=0.037),说明Notch信号抑制剂LY‐411575 对紫朱软膏降低IP‐10 有正向影响,增强了紫朱软膏对IP‐10 的降低作用。见表3。
2.2.6 白细胞介素‐8(IL‐8)PCR 检测结果 NC 组与DC 组比较,DC 组的IL‐8 含量较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面IL‐8 的表达高于普通对照组模型。DC 组与DC‐I 组比较,DC‐I 组 的IL‐8 含 量 较 低,具 有 统 计 学 差 异(P<0.01),说 明Notch 信 号 抑 制 剂LY‐411575 可 降 低IL‐8 含量。DC 组与DT 组比较,DT 组的IL‐8 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能明显降低实验模型组大鼠血清IL‐8 的含量。DT 组与DT‐I 组比较,DT‐I 组的IL‐8 含量较低,具有统计学 差 异(P<0.05),说 明Notch 信 号 抑 制 剂LY‐411575 对紫朱软膏降低IL‐8 有正向影响,明显增强紫朱软膏对IL‐8 的降低作用。见表3。
2.2.7 单核细胞趋化蛋白1(MCP‐1)PCR 检测结果 NC 组与DC 组比较,DC 组的MCP‐1 含较高,具有统计学差异(P<0.01),说明实验模型组大鼠创面MCP‐1 的表达高于于对照组模型;DC 组与DC‐I组比较,DC‐I 组的MCP‐1 含量较低,具有统计学差异(P<0.01),说明Notch 信号抑制剂LY‐411575 可降低实验模型组大鼠MCP‐1 含量。DC 组与DT 组比较,DT 组的MCP‐1 含量较低,具有统计学差异(P<0.01),说明紫朱软膏能降低实验模型组大鼠血清MCP‐1 的含量。DT 组与DT‐I 组比较,两组无有统计学差异(P=0.058),说明Notch 信号抑制剂LY‐411575 对紫朱软膏降低MCP‐1 有无明显影响。见表3。
2.2.8 转 化 生 长 因 子α(TGF‐α)PCR 检 测 结 果NC 组与DC 组比较,两组无统计学差异(P=0.410)。DC 组与DC‐A 组比较,DC 组的TGF‐α 含量较高,具有统计学差异(P<0.01),说明Notch 信号激动剂Jagged1 可降低实验模型组大鼠TGF‐α 的表达;DC 组与DC‐I 组比较,DC 组的TGF‐α 含量较低,具有统计学差异(P<0.01),说明Notch 信号抑制剂LY‐411575 可增高实验模型组大鼠TGF‐α 含量。 DC 组 与DT 组 比 较,DT 组 的TGF‐α 含 量 较高,具有统计学差异(P<0.01),说明紫朱软膏能明显增高实验模型组大鼠血清TGF‐α 的含量。 DT组与DT‐A 组比较,DT 组的TGF‐α 含量较高,具有统计学差异(P<0.01),说明Notch 激动剂Jagged1能减弱紫朱软膏对TGF‐α 的升高作用。DT 组与DT‐I 组比较,DT 组的TGF‐α 含量较低,具有统计学 差 异(P=0.006),说 明Notch 信 号 抑 制 剂LY‐411575 对紫朱软膏升高TGF‐α 有正向影响,增强了紫朱软膏对TGF‐α 的升高作用。见表3。
2.2.9 转 化 生 长 因 子‐β(TGF‐β)PCR 检 测 结 果NC 组与DC 组比较,DC 组的TGF‐β 含 量 低,具有统计学差异(P<0.01),说明实验模型组大鼠创面TGF‐β 的表达低于普通对照组模型;DC 组与DC‐A组比较,DC 组的TGF‐β 含量较高,具有统计学差异(P=0.035),说明Notch 信号激动剂Jagged1 可降低实验模型组大鼠TGF‐β 的表达;DC 组与DC‐I 组比较,DC 组的TGF‐β 含量较低,具有统计学差异(P=0.049),说 明Notch 信 号 抑 制 剂LY‐411575 可 增 高实 验 模 型 组 大 鼠TGF‐β 含 量。DC 组 与DT 组 比较,DT 组的TGF‐β 含量较高,具有统计学差异(P=0.001),说明紫朱软膏能增高实验模型组大鼠血清TGF‐β 的含量。DT 组与DT‐A 组比较,DT 组的TGF‐β 含量较高,具有统计学差异(P=0.024),说明Notch 激动剂Jagged1 减弱了紫朱软膏升高TGF‐β 的 作 用。DT 组 与DT‐I 组 比 较,DT 组 的TGF‐β 含量较低,具有统计学差异(P=0.015),说明Notch 信号抑制剂LY‐411575 对紫朱软膏升高TGF‐β 有正向影响,增强了紫朱软膏对TGF‐β 的升高作用。见表3。
表3 各组炎症及趋化因子Real⁃time PCR 结果总表(n=8,±s)Tab 3 Real⁃time PCR results of inflammatory factors and chemokines in each group(n=8,±s)
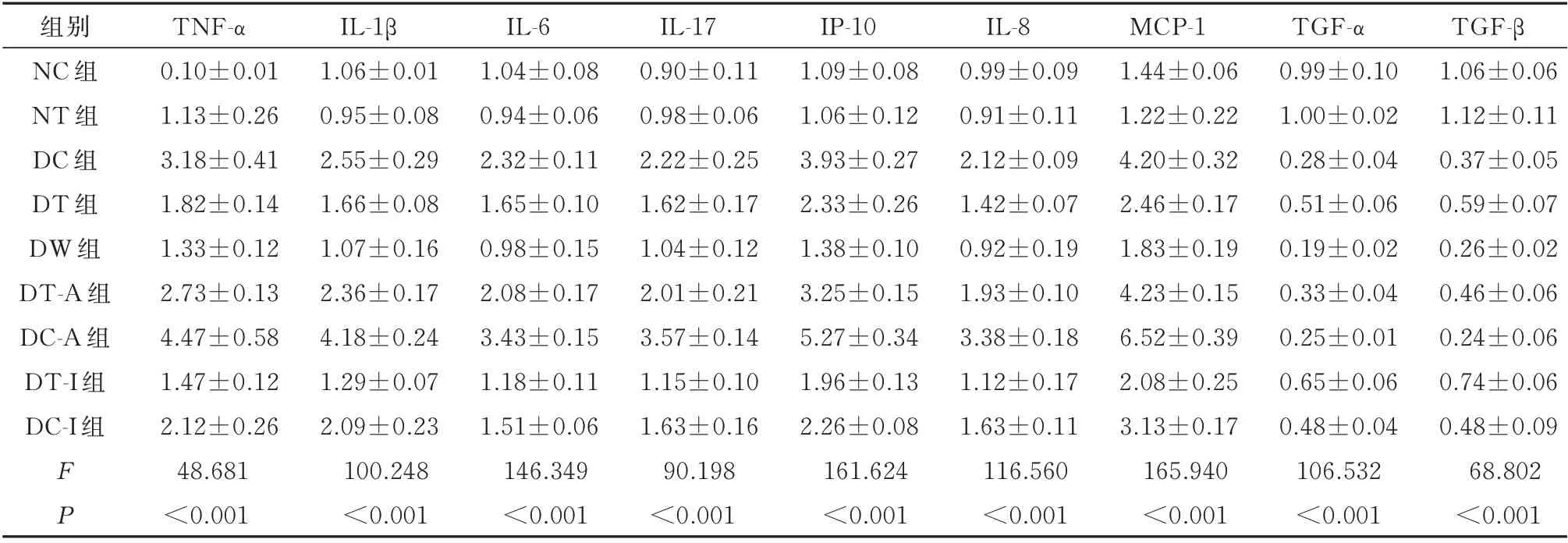
表3 各组炎症及趋化因子Real⁃time PCR 结果总表(n=8,±s)Tab 3 Real⁃time PCR results of inflammatory factors and chemokines in each group(n=8,±s)
组别NC 组NT 组DC 组DT 组DW 组DT‐A 组DC‐A 组DT‐I 组DC‐I 组FP TNF‐α 0.10±0.01 1.13±0.26 3.18±0.41 1.82±0.14 1.33±0.12 2.73±0.13 4.47±0.58 1.47±0.12 2.12±0.26 48.681<0.001 IL‐1β 1.06±0.01 0.95±0.08 2.55±0.29 1.66±0.08 1.07±0.16 2.36±0.17 4.18±0.24 1.29±0.07 2.09±0.23 100.248<0.001 IL‐6 1.04±0.08 0.94±0.06 2.32±0.11 1.65±0.10 0.98±0.15 2.08±0.17 3.43±0.15 1.18±0.11 1.51±0.06 146.349<0.001 IL‐17 0.90±0.11 0.98±0.06 2.22±0.25 1.62±0.17 1.04±0.12 2.01±0.21 3.57±0.14 1.15±0.10 1.63±0.16 90.198<0.001 IP‐10 1.09±0.08 1.06±0.12 3.93±0.27 2.33±0.26 1.38±0.10 3.25±0.15 5.27±0.34 1.96±0.13 2.26±0.08 161.624<0.001 IL‐8 0.99±0.09 0.91±0.11 2.12±0.09 1.42±0.07 0.92±0.19 1.93±0.10 3.38±0.18 1.12±0.17 1.63±0.11 116.560<0.001 MCP‐1 1.44±0.06 1.22±0.22 4.20±0.32 2.46±0.17 1.83±0.19 4.23±0.15 6.52±0.39 2.08±0.25 3.13±0.17 165.940<0.001 TGF‐α 0.99±0.10 1.00±0.02 0.28±0.04 0.51±0.06 0.19±0.02 0.33±0.04 0.25±0.01 0.65±0.06 0.48±0.04 106.532<0.001 TGF‐β 1.06±0.06 1.12±0.11 0.37±0.05 0.59±0.07 0.26±0.02 0.46±0.06 0.24±0.06 0.74±0.06 0.48±0.09 68.802<0.001
3 讨论
糖尿病足溃疡的发展转归在炎症期最为关键。糖尿病足溃疡的发生发展与炎症异常密切相关。促炎和抗炎调节异常会导致愈合延迟,糖尿病足溃疡炎症失调可破坏组织内环境的稳态,导致创面组织的稳态失衡和愈合延期,有研究显示甚至在糖尿病足溃疡发生前炎症水平已经上调[2]。Weigelt等[21]报道了糖尿病足溃疡患者血清CRP、巨噬细胞炎症蛋白‐1β、纤维蛋白原、IL‐6、干扰素‐γ、诱导蛋白‐10 等炎症标志物的水平升高的机制。Tuttolo‐mondo 等[22]研究发现,糖尿病足溃疡患者较糖尿病无足溃疡患者其血浆IL‐6 水平和抵抗素水平较高。炎症标志物可评估糖尿病患者足部并发症(如溃疡发生率)的风险和指示糖尿病足溃疡严重程度的指标[2]。近年来,越来越多的研究提示炎症反应及各类细胞因子的调控失衡在糖尿病足溃疡的愈合中具有重要的作用。创面愈合包括炎症期、增殖期和修复期三个阶段[23]。创面炎症反应异常[24]、血管生成减少[25]和成纤维细胞增殖不足[26]都可导致创面愈合受阻。促炎介质的充分表达可刺激产生细胞因子以募集中性粒细胞和巨噬细胞清除创面细菌和其他污染物[27]。然而,炎症因子的持续表达又可导致愈合进程的延迟,导致溃疡转为慢性[28]。炎症因子的最佳释放才能促进伤口愈合。
糖尿病足溃疡发病涉及多种复杂机制。Notch信号是一种参与细胞间通讯与免疫炎症反应的重要信号通路。Notch 信号通路在组织愈合过程中炎症反应、血管增殖、上皮化生、瘢痕调控起重要作用。李博文等[29]研究发现,抑制糖尿病足溃疡大鼠Notch 信号表达可下调IL‐2、IL‐6、TNF‐α 表达,从而降低创面炎症反应,中药药膏能够通过该途径改善溃疡愈合。有研究[16]报道Notch 信号基因敲除与DAPT 抑制可降低炎症细胞因子(TNF‐α 和IL‐1β)的产生。阻断巨噬细胞Notch 信号通路发现可抑制炎症反应和胶原沉积,有效减轻瘢痕形成,促进创面愈合[17]。此外,Notch 信号通路还能刺激血管细胞增殖,加快缺血区的血管新生、组织成熟[30],参与血管重构的进程[31],促进角膜缘干细胞分化和增殖[32]。
本研究结果表明,糖尿病足溃疡大鼠模型的血清炎症因子IL‐1β、IL‐6、TNF‐α、IL‐17 水平明显高于普通溃疡模型,表明大鼠血清炎症处于高水平状态;Notch 信 号 抑 制 剂LY‐411575 能 降 低IL‐6、TNF‐α、IL‐17A 含量,说明抑制Notch 信号能够明显降低部分炎症因子的表达。紫朱软膏能够降低实验组糖尿病足溃疡大鼠血清IL‐1β、IL‐6、TNF‐α、IL‐17 水 平;抑 制 剂LY‐411575 与 紫 朱 软 膏 在 降 低IL‐6、TNF‐α、IL‐17A 方 面 存 在 互 相 拮 抗 的 现 象。糖尿病足溃疡大鼠模型创面组织的炎症因子IL‐1β、IL‐6、TNF‐α、IL‐17 和趋化因子IP‐10、IL‐8、MCP‐1水平明显高于普通溃疡模型,而生长因子TGF‐β 水平低于普通溃疡模型。 Notch 信号抑制剂LY‐411575 明显降低糖尿病足溃疡大鼠炎症因子IL‐1β、IL‐6、TNF‐α、IL‐17 和趋化因子IP‐10、IL‐8、MCP‐1 含量,增加生长因子TGF‐α、TGF‐β 表达,而激动剂Jagged1 则降低TGF‐α、TGF‐β 表达。这表明了抑制Notch 信号通路能够降低炎症因子IL‐6、TNF‐α、IL‐17A、IL‐8 和增加生长因子TGF‐α、TGF‐β 表达,激活Notch 则降低生长因子TGF‐α、TGF‐β 的表达,说明Notch 信号通路对糖尿病足溃疡具有促炎表达和促部分细胞增殖双重作用。中药组能够降低实验糖尿病足溃疡大鼠创面IL‐1β、IL‐6、TNF‐α、IL‐17 和趋化因子IP‐10、IL‐8、MCP‐1水平,提高生长因子TGF‐α、TGF‐β 表达,说明紫朱软膏能够降低糖尿病足溃疡大鼠炎症因子和炎症趋化水平,提高生长因子表达,减轻创面炎症反应强度,其作用途径可能与抑制Nocth 信号通路表达有关。
中药具有包括促进创面愈合[33],调节免疫力[34],以及抗炎[35]的作用,中药复方制剂能够显著促进糖尿病溃疡愈合[36‐38]。紫朱软膏是柳国斌教授临床总结治疗糖尿病足溃疡的经验方,经过上海市科委的药物现代化项目完成了药学研究工作。本方由紫草、朱砂、阿胶、龙血竭、冰片、黄芪6 味中药组成。其中,紫草凉血活血,朱砂解毒祛腐,两君药得清热解毒祛腐之效;黄芪味甘性微温,补气生肌,阿胶、血竭同为甘平之品,有补血生肌敛疮功效,其中阿胶补血滋阴,血竭为治疗溃疡不敛要药,共为臣药;冰片为佐药,味辛,通透肌腠镇静止痛可助药效。纵观全方具有清热解毒、祛腐生肌、补气益血的功效。药物单独使用都具有促进伤口愈合的作用[39‐41]。 本研究中紫朱软膏能够降低实验组糖尿病足 溃 疡 大 鼠 血 清IL‐1β、IL‐6、TNF‐α、IL‐17 水 平。抑制剂LY‐411575 与紫朱软膏在降低IL‐6、TNF‐α、IL‐17A 方面存在互相拮抗的现象。说明紫朱软膏能降低糖尿病足溃疡模型的炎症因子水平,从而降低炎症反应强度,提高生长因子表达促进创面愈合,其作用途径可能与抑制Nocth 信号通路表达有关。
