基于药代动力学研究厚朴-苦杏仁配伍在大鼠体内的相互作用
2021-07-03王星晨勾楠郑东梅盖守昌张莹刘星星刘雪英王庆伟陕西中医药大学药学院陕西咸阳706安康市中医医院陕西安康7000空军军医大学第二附属医院药剂科西安70038空军军医大学药学系药物化学与药物分析学教研室西安7003西安培华学院西安70
王星晨,勾楠,郑东梅,3,盖守昌,张莹,刘星星,刘雪英*,王庆伟,3*(.陕西中医药大学药学院,陕西 咸阳 706;.安康市中医医院,陕西 安康 7000;3.空军军医大学第二附属医院药剂科,西安 70038;.空军军医大学药学系药物化学与药物分析学教研室,西安 7003;.西安培华学院,西安 70)
《伤寒论》中记载“喘家作桂枝汤,加厚朴杏子佳”,方中厚朴降气,苦杏仁下气,相须为用,共治肺气上逆。 《中华医方精选辞典》中显示厚朴、苦杏仁常配伍使用[1-3],其中含有厚朴的方剂815首,组方用药涉及293种,化痰止咳平喘药累计用药385次,与杏仁配伍频次有33次[4]。《中医临床常用对药配伍》中有提到杏仁苦温多脂、润肺利气、外达肌腠;厚朴辛苦温,辛散苦泄、降气除螨、温通肌腠,两药合用降气定喘[5]。两味药也是中药复方制剂定喘止咳糖浆的主要组分,临床上于常用来治疗咳嗽、哮喘等肺部疾病。多篇文献报道[6-8]在使用组方中采用厚朴-杏仁(1∶1)时改善了慢性阻塞性肺疾病的呼吸困难等症状。何剑荣[9]运用厚朴-杏仁(1∶1)的桂枝厚朴杏子汤加味治疗喉源性咳嗽效果甚佳。李焕敏等[10]基于网络药理学研究了厚朴-杏仁治疗哮喘的机制,但其协同治疗的作用机制尚不明确。厚朴中的厚朴酚与和厚朴酚有抗菌、抗病毒、抗炎镇痛等药理作用,苦杏仁中苦杏仁苷有降气、镇咳平喘、增强机体免疫和润肠通便的功效[11],本实验拟采用HPLC-MS/MS法,研究厚朴-苦杏仁配伍前后主要成分厚朴酚、和厚朴酚与苦杏仁苷在大鼠体内的药代动力学变化过程,从药代动力学角度探讨两者相须配伍规律,为临床用药提供实验依据。
1 材料
1.1 实验动物
SD大鼠,雌雄各半,体质量(200±20)g [空军军医大学动物实验中心,动物许可证号:SCXK(军)2014-007,动物合格证号:医动字第08-005号]。
1.2 试药
厚朴、苦杏仁药材,购于西安天晟中药饮片公司,经陕西中医药大学白吉庆副教授鉴定,厚朴为木兰科植物厚朴Magnolia officinalisRehd et Wils.的干燥干皮,苦杏仁为蔷薇科植物山杏Prunus armeniacaL.var.ansuMaxim.的干燥成熟种子。依据2020年版《中国药典》一部[12],测得厚朴药材中厚朴酚的含量为1.74%,和厚朴酚含量为0.84%,苦杏仁中苦杏仁苷含量为4.523%,均符合药典要求。厚朴、苦杏仁饮片打粉,称量厚朴,苦杏仁药材约1 kg,用8倍量的75%乙醇加热回流提取3次,每次1 h,旋蒸,浓缩,得厚朴浸膏0.275 kg,每克浸膏相当于原药材得3.673 g;得苦杏仁浸膏0.250 kg,每克浸膏相当于原药材4 g。
苦杏仁苷(批号:HA147454198)、厚朴酚(批号:HM041231198)、和厚朴酚(批号:HM041230198)(宝鸡辰光生物科技有限公司,含量:98%);卡马西平[内标(IS),批号:100142-201706,中国食品药品检定研究所,含量:99.7%];甲醇和乙腈均色谱级(美国TEDIA公司);甲酸色谱级(广东光华科技股份有限公司);超纯水由优普UPT系列超纯水机制得。
1.3 仪器
Agilent 6460三重四级杆质谱仪、Agilent 1260液相色谱仪(美国安捷伦);真空离心浓缩仪(北京吉艾姆公司);高速离心机(Thermo Fisher 公司);涡旋振荡器(德国IKA公司);万分之一分析天平(上海梅特勒-托利多公司)。
2 方法与结果
2.1 HPLC-MS/MS测定方法的建立
色谱柱:Inertsil ODS-3(4.6 mm×150 mm,5µm);保护柱:C18(50 mm×4.6 mm,江苏汉邦);流动相:乙腈-水(含 0.1%甲酸)(88∶12,V/V);流速:0.5 mL·min-1;洗脱时间:7 min;进样量:5 μL;柱温:25℃;离子源:电喷雾离子化源(ESI);MS/MS:多反应监测(MRM),各成分及卡马西平的保留时间tR,m/z,去簇电压(DP)及碰撞能量(CE)如表1所示。待测物和IS的结构式见图1。

图1 待测物和内标的分子结构式Fig 1 Molecular structure formula of the analyte and the internal standard
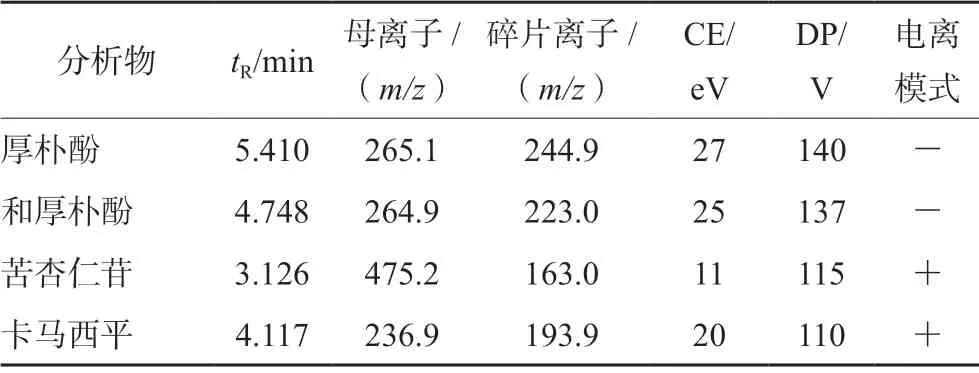
表1 分析物及内标的 MRM 检测参数Tab 1 MRM detection parameter of the analyte and the internal standard
2.2 对照品溶液制备
精密称量厚朴酚、和厚朴酚、苦杏仁苷和IS对照品各10.0 mg,用甲醇溶解并定容于10 mL棕色量瓶中,得质量浓度为1.0 mg·mL-1的各对照品储备液。分别精密吸取各对照品储备液,用甲醇稀释,配制厚朴酚质量浓度为100.0、500.0、1000.0、5000.0、10 000.0、20 000.0 ng·mL-1,和厚朴酚质量浓度为50.0、100.0、500.0、1000.0、5000.0、10 000.0 ng·mL-1,苦杏仁苷质量浓度为100.0、500.0、1000.0、5000.0、10 000.0、20 000.0 ng·mL-1的系列对照品溶液。IS溶液用甲醇稀释到 100.0 ng·mL-1,所有溶液于-20℃冰箱保存。
2.3 大鼠血浆样品的处理
取大鼠血浆100 µL,加入IS溶液10 µL,涡旋振荡10 min,加入乙腈1000 µL沉淀血浆蛋白,再涡旋振荡10 min后,20 000×g离心15 min,移取上清液800 µL,于37℃下真空离心浓缩仪吹干,80 µL流动相复溶,涡旋振荡10 min,20 000×g离心15 min,吸取上清液5 µL进行分析。
2.4 方法学考察
2.4.1 标准曲线的建立 取“2.2”项下系列对照品溶液10 µL于离心管中,真空离心浓缩后,分别加入到100 µL空白血浆,按“2.3”项下方法操作。利用液质联用中的Masshunter定量软件计算,求各成分的直线回归方程。厚朴酚线性范围:10.0~2000.0 ng·mL-1,线性方程为Y=0.0003X-0.0018,R2=0.9996;和厚朴酚线性范围:5.0~1000.0 ng·mL-1,线性方程为Y=0.0026X-0.1136,R2=0.9969;苦杏仁苷线性范围:10.0~2000.0 ng·mL-1,线性方程为Y=0.0003X+0.221,R2=0.9966。每批测试样品建立随行标准曲线,R2>0.99时该方法方可以使用。
2.4.2 检测限和定量限 分别取含不同质量浓度厚朴酚、和厚朴酚、苦杏仁苷的血浆样品,逐步稀释,按“2.3”项下方法进行处理,HPLC-MS/MS分析,测定信号与噪音信号的比值,信噪比S/N≥3时的量为检测限(LOD),信噪比S/N≥10时的量为定量限(LOQ)。结果厚朴酚、和厚朴酚与苦杏仁苷的定量限分别为10.0、5.0、10.0 ng·mL-1,检测限分别是5.0、2.5、5.0 ng·mL-1,RSD均<15%(n=6)。
2.4.3 专属性考察 取空白大鼠血浆100 μL,作为空白样品;空白血浆100 μL中分别加入IS、厚朴酚、和厚朴酚和苦杏仁苷作为对照品;取给药2 min后的大鼠血浆100 μL,加入IS作为样品。以上血浆样品按照 “2.3”项下方法处理并测定,色谱图如图2所示。

图2 厚朴-苦杏仁配伍的LC-MS色谱图Fig 2 Liquid chromatography/tandem mass spectrometry chromatogram of Magnolia Officinalis Cortex and Armeniacae Semen Amarum
2.4.4 精密度和准确度 制备定量下限、低、中、高质量浓度的血浆样品溶液(厚朴酚:10.0、20.0、1000.0、1500.0 ng·mL-1;和厚朴酚:5.0、10.0、500.0、750.0 ng·mL-1;苦杏仁苷:10.0、20.0、1000.0、1500.0 ng·mL-1), 按“2.3”项下方法处理,平行6份。同时建立随行标准曲线,连续进样3 d,计算精密度(RSD)和准确度(RE)。结果显示RSD均小于7.3%,RE均在-13.33%~8.03%。说明该方法的精密度和准确度符合生物样品分析的要求,结果见表2。

表2 精密度与准确度Tab 2 Precision and accuracy
2.4.5 稳定性 制备低、中、高质量浓度的血浆样品溶液(厚朴酚:20.0、1000.0、1500.0 ng·mL-1;和厚朴酚:10.0、500.0、750.0 ng·mL-1;苦杏仁苷:20.0、1000.0、1500.0 ng·mL-1),每个浓度6份,按“2.3”项下处理后的血浆样品于4℃冰箱中24 h,-20℃冻存30 d,室温中12 h,冻融循环3次,在以上几个条件下考察稳定性,结果样品的稳定性范围是85.89%~104.64%。
2.4.6 回收率 配制对照品(厚朴酚:20.0、1000.0、1500.0 ng·mL-1;和厚朴酚:10.0、500.0、750.0 ng·mL-1);苦杏仁苷:20.0、1000.0、1500.0 ng·mL-1,按“2.3”项下步骤处理进样。另取空白血浆100 μL,加入上述各质量浓度对照品和IS溶液(100.0 ng·mL-1)各10 μL,按“2.3”项下步骤操作,于真空离心浓缩仪吹干,复溶,进样测定,结果提取回收率在86.45%~102.45%,RSD为1.1%~4.3%,符合要求。
2.4.7 基质效应 取大鼠空白血浆100 μL,按照“2.3”项下方法制备含厚朴酚20、1000、1500 ng·mL-1,和厚朴酚10、500、750 ng·mL-1,苦杏仁苷20、1000、1500 ng·mL-1的血浆样品,每浓度配制6份,测得方法回收率在85.96%~99.32%,RSD为1.1%~6.6%。
2.5 药代动力学研究
2.5.1 灌胃液制备 根据临床成人常用剂量和2020年版《中国药典》[12]厚朴的用量为3~10 g,苦杏仁的用量为5~10 g,最终选取厚朴-苦杏仁配伍用量为10 g∶10 g,换算成大鼠灌胃给药剂量为0.9 g·kg-1,则厚朴组浸膏、苦杏仁组浸膏为0.225 g·kg-1,0.2451 g·kg-1,均用0.5%羧甲基纤维素钠溶解制成混悬液,配伍组同比例混合(给药量分别为厚朴酚15.67 mg·kg-1,和厚朴酚7.57 mg·kg-1,苦杏仁苷29.01 mg·kg-1)。
2.5.2 给药及取样 18只SD大鼠,体质量(200±20)g,雌雄各半,随机分为厚朴组、苦杏仁组、厚朴-苦杏仁配伍组,每组6只,实验前禁食不禁水12 h。于给药后2、5、10、15、30、60、120、240、360、480、720、1440 min大 鼠眼眶取血,肝素抗凝,20 000×g离心15 min,血浆冻存于-20℃。检测前放至室温融化。
2.5.3 统计分析 采用DAS 3.0软件(北京博之音科技有限公司)计算药代动力学参数,结果见表3。使用Graphpad软件绘制浓度-时间曲线,结果见图3,数据采用SPSS 19.0进行统计分析,对AUC(0~t)、Cmax进行单侧Student 检验,由于tmax分布不符合正态分布,因此对tmax进行Wilcoxon秩合检验。P<0.05为差异有统计学意义。三者的浓度-时间曲线跟所报道的基本一致[13],与单味苦杏仁组相比,配伍后的苦杏仁苷的Cmax、AUC(0~t)以及AUC(0~∞)明显增加(P<0.05),CLz/F显著下降,苦杏仁苷的t1/2和Vdz/F均有所增加。两药合用之后,苦杏仁苷血药浓度大大增加,消除过程减缓。与单味厚朴组相比,配伍后厚朴酚与和厚朴酚的Cmax、AUC(0~t)明显升高,配伍之后促进了厚朴有效成分富集在血液中,厚朴酚CLz/F、Vdz/F显著降低,和厚朴酚CLz/F下降,配伍给药后在大鼠体内厚朴酚与和厚朴酚的清除率减少。
表3 大鼠灌服厚朴、苦杏仁和厚朴-苦杏仁浸膏后厚朴酚、和厚朴酚与苦杏仁苷的药代动力学参数(±s,n=6)Tab 3 Pharmacokinetic parameter of magnolol,honokiol and amygdalin after administration of Magnolia Officinalis Cortex and Armeniacae Semen Amarum and compatibility extracts in rats (±s,n=6)

表3 大鼠灌服厚朴、苦杏仁和厚朴-苦杏仁浸膏后厚朴酚、和厚朴酚与苦杏仁苷的药代动力学参数(±s,n=6)Tab 3 Pharmacokinetic parameter of magnolol,honokiol and amygdalin after administration of Magnolia Officinalis Cortex and Armeniacae Semen Amarum and compatibility extracts in rats (±s,n=6)
注:与单味给药组比较,*P<0.05,**P<0.01。Note:vs single dose group,*P<0.05,**P<0.01.
Cmax/(ng·mL-1)厚朴酚 厚朴 77.49±25.76 92.49±31.79 542.4±105.1 21.7±9.3 0.2±0.1 141.2±32.1 184.4±85.3厚朴-苦杏仁 237.7±129.5* 313.2±200.6* 615.4±290.6 29.2±17.4 0.1±0.0** 52.0±28.5**1025.7±600.7**和厚朴酚 厚朴 33.26±13.63 52.91±27.45 809.7±435.1 25.0±7.7 0.2±0.1 207.0±201.1 91.9±38.6厚朴-苦杏仁 64.65±20.18* 94.52±37.10 968.6±322.6 26.7±8.2 0.1±0.0 114.6±19.4 235.6±81.4**苦杏仁苷 苦杏仁 91.89±23.51 100.6±23.62 219.9±57.4 24.2±9.2 0.3±0.1 92.5±15.9 379.7±67.6厚朴-苦杏仁 261.0±183.7* 333.7±187.3* 727.1±573.4 20±19.7 0.1±0.1** 121.2±103.4 1016.1±462.7*有效成分 组别 AUC(0~t)/(mg·min·mL-1)(mg·min·mL-1) t1/2/min tmax/min CLz/F/L/(min·kg)AUC(0~∞)/Vdz/F/(L·kg-1)

图3 厚朴酚、和厚朴酚与苦杏仁苷单味与配伍给药前后浓度-时间曲线Fig 3 Plasma concentration-time curves of magnolol,honokiol and amygdalin before and after the combination administration
3 讨论
本实验建立了同时测定SD大鼠血浆中厚朴酚、和厚朴酚与苦杏仁苷的HPLC-MS/MS法。前期研究中发现苦杏仁苷适用于480.3→ 347.1([M+Na]+)和475.2 →163.0([M+NH4]+)两个条件,但后者的响应值比前者好。实验前期选用了甲醇和乙腈作为有机相,对比发现,在使用乙腈作为有机相时,厚朴酚与和厚朴酚的保留时间相对较短,峰形良好,在水相中加入0.1% 的甲酸,分离效果提高,故选用乙腈-水(含 0.1%甲酸)(88∶12,V/V)为流动性,等度洗脱。预实验选取了甲醇和乙腈两种蛋白沉淀剂,因乙腈作为流动相,可以有效减少溶剂化效应,且沉淀率高最终选择乙腈作为沉淀剂。其方法学验证符合生物样品定量分析指导原则[14]和2020年版《中国药典》[15]。
前期研究者通过研究单味与配伍给药前后在大鼠体内的药代动力学参数变化,证明了配伍药物之间相互作用的物质基础[16-17]。厚朴酚与和厚朴酚为同分异构体,和厚朴酚结构两苯环的夹角大于厚朴酚的两苯环夹角,化学结构差异决定了两者在动物体内的药代动力学性质不同[18]。有研究表明厚朴酚与和厚朴酚的溶解性差和生物利用度不高主要原因是胃肠道吸收差[19-20],和厚朴酚在肠液碱性环境中不稳定,其化学结构可能在胃肠道内发生了转化。厚朴酚与和厚朴酚自身具有抵制被肝微粒体代谢的能力[21]。而苦杏仁苷的代谢主要由肠道菌群代谢[22],芍药苷和苦杏仁苷通过抑制细胞色素P450亚型的CYP2C9和CYP2E1的活性,导致其他药物的代谢速度减慢,血浆中药物浓度增加,作用时间延长[23];也有学者通过体外实验证明5、10、25、50 μmol·L-1厚朴酚和与厚朴酚在孵育30 min后对细胞色素P450亚型CYP2C、CYP2D6、CYP2E1、CYP2B6均有明显的抑制作用[24]。本研究发现在厚朴与苦杏仁配伍后,厚朴酚,和厚朴酚与苦杏仁苷发生了药动学相互作用,厚朴酚、和厚朴酚与苦杏仁苷有可能抑制了CYP2E1或CYP450的其他亚型,减缓了这3种有效成分的代谢,使有效成分在血液中的含量增大,延长了药物的体内滞留时间,从而提高了厚朴酚、和厚朴酚与苦杏仁苷的生物利用度。增强了厚朴和苦杏仁的药物作用,同时也印证了厚朴和苦杏仁相须为用,相辅相成,协同增效。后续我们将通过大鼠组织分布实验进行更深入的探讨。
