异叶青兰总黄酮的含量测定及体外抗氧化活性研究
2021-07-03马雪洁程路峰杨淑梅何雯新疆医科大学药学院乌鲁木齐8300成都市第五人民医院成都630
马雪洁,程路峰,杨淑梅*,何雯(.新疆医科大学药学院,乌鲁木齐 8300;.成都市第五人民医院,成都 630)
异叶青兰(Dracocephalum heterophyllumBenth)别名白花夏枯草、甜蜜罐、龙头草、白花栀子花,为唇形科青兰属多年生草本植物,在我国主要分布于新疆、内蒙古、西藏、青海、宁夏、甘肃等地。研究发现异叶青兰含有挥发油类、黄酮类、有机酸类、生物碱类、多糖类、萜类、木质素类等化学成分[1-3]。主要用于高血压、支气管炎、肺热、肝火头痛、淋巴结炎、口腔溃疡等[4-7]。近年来有研究表明,异叶青兰的提取物具有抗高血压、心血管保护、抗缺氧、抗病毒等药理作用[8-9],但对其抗氧化作用研究较少,因此本实验通过回流提取、纯化制备异叶青兰中总黄酮,采用硝酸铝比色法进行含量测定,通过检测异叶青兰总黄酮清除DPPH、ABTS自由基能力和总抗氧化能力,评价其体外抗氧化活性,以期为该药材的开发应用提供参考依据。
1 材料
1.1 试药
异叶青兰采自新疆阿克陶县,经中国科学院新疆理化技术研究所沈观冕研究员鉴定为青兰属植物异叶青兰全草。
亚硝酸钠、硝酸铝(分析纯,天津永晟精细化工有限公司);无水乙醇(分析纯,天津市致远化学试剂有限公司);芦丁对照品(批号:SR8250,含量≥98%)、维生素C对照品(批号:SV2180,纯度>98%)(中国食品药品检定研究院);ABTS自由基清除能力检测试剂盒(货号:BC1315)、总抗氧化能力检测试剂盒(货号:BC4770)(北京索莱宝科技有限公司);1,1-二苯基-2-三硝基苯肼(DPPH,东京化成工业株式会社,纯度>97%)。
1.2 仪器
N-1100型旋转蒸发器(上海泉杰仪器有限公司);YB202N电子天平(上海怡台电子科技有限公司);XMTD-7000型电热恒温水浴锅(北京市永光明医疗仪器有限公司);岛津UV-2550型紫外分光光度计(日本岛津公司);Multiskan GO型全自动酶标仪(Thermo美国);KQ3200D型超声波清洗仪(昆山市超声仪器有限公司)。
2 方法与结果
2.1 异叶青兰总黄酮的提取与纯化
根据课题组前期研究确定的提取工艺,取异叶青兰全草1 kg,粉碎,加入70%乙醇(料液比=1∶40,g/mL),50℃加热回流提取3次,每次提取2 h,收集3次提取液,旋转蒸发浓缩。用适量蒸馏水稀释上述浓缩后的液体,以70%乙醇作为洗脱剂,AB-8大孔吸附树脂层析柱洗脱纯化,收集纯化后的液体,旋蒸浓缩后冷冻干燥,粉碎备用,异叶青黄酮得率为3.6%。
2.2 溶液的制备
2.2.1 芦丁对照品溶液的制备 精密称量芦丁对照品10 mg用70%乙醇充分溶解,并定容至50 mL,摇匀备用,即得质量浓度为0.2 mg·mL-1的芦丁对照品溶液。
2.2.2 供试品溶液的制备 精密称取异叶青兰总黄酮粉末0.1 g,加入70%乙醇,超声溶解,并定容至50 mL,摇匀备用,即得质量浓度为2 mg·mL-1的异叶青兰总黄酮溶液。
2.2.3 显色溶液的制备
① 5% NaNO2溶液的制备:精密称量亚硝酸钠2.5 g,加入蒸馏水,充分溶解并定容至50 mL,摇匀备用。
② 10% Al(NO3)3溶液的制备:精密称量硝酸铝5.0 g,加入蒸馏水,充分溶解并定容至50 mL,摇匀备用。
③ 4% NaOH溶液的制备:精密称量氢氧化钠4.0 g,加入蒸馏水,充分溶解并定容至100 mL,摇匀备用。
④ 0.04 mg·mL-1的DPPH溶液的制备:精密称取DPPH粉末4.0 mg,用95%乙醇溶解定容至100 mL,摇匀备用。
2.3 显色方法及最大吸收波长选择
参考文献[10]方法,精密量取芦丁对照品溶液和供试品溶液各1 mL置于25 mL量瓶,分别加入5% NaNO2溶液1 mL,摇匀,静置6 min,分别加入10% Al(NO3)3溶液1 mL,摇匀,静置6 min,加入4% NaOH溶液10 mL摇匀,并用70%乙醇定容至25 mL,静置30 min。以70%乙醇为空白溶液,于400~800 nm波长处扫描各溶液,确定最大吸收波长为510 nm。
2.4 方法学考察
2.4.1 线性关系考察 精密吸取“2.2.1”项下芦丁对照品溶液0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL量瓶中,按“2.3”项下显色方法依次加入显色溶液,以显色后的空白对照溶液调零,于λ=510 nm处测定吸光度值,以芦丁对照品溶液质量浓度(mg·mL-1)为横坐标,吸光度为纵坐标进行线性回归并绘制标准曲线,得回归方程为:Y=12.08X-0.0103,R2=0.9997。结果表明,芦丁对照品质量浓度在0.008~0.048 mg·mL-1内与吸光度具有良好的线性关系。
2.4.2 精密度试验 精密量取“2.2.1”项下芦丁对照品2 mL,按“2.3”项下显色方法依次加入显色溶液,于λ=510 nm波长处,连续重复6次测定芦丁对照品吸光度,根据结果计算RSD为0.12%(n=6),表明仪器精密度良好。
2.4.3 重复性试验 精密称量异叶青兰总黄酮样品50.0 mg,共6份,按“2.2.2”项下方法制备供试品溶液,精密量取0.5 mL,按“2.3”项下方法显色,于λ=510 nm波长处测定6份供试品溶液的吸光度,根据结果计算RSD为1.9%(n=6),表明方法重复性良好。
2.4.4 稳定性试验 精密量取0.5 mL供试品溶液,按“2.3”项下方法室温放置显色,以显色后的空白对照溶液调零,分别在0、15、30、45、60 min时测定供试品溶液吸光度,根据结果计算RSD为1.6%(n=6),表明供试品在60 min内稳定。
2.5 含量测定
精密称量异叶青兰总黄酮粉末50.0 mg,按“2.2.2”项下方法制备异叶青兰总黄酮溶液,精密量取0.5 mL,按“2.3”项下显色方法进行显色,于λ=510 nm波长处测定吸光度值。并将吸光度代入线性回归方程,按下式计算异叶青兰总黄酮含量。总黄酮含量(%)=(C×V1×V3)/(V2×W)×100%,结果异叶青兰总黄酮的平均含量为48.6%。其中C为总黄酮浓度,V1为异叶青兰总黄酮供试品母液体积,V2为从供试品母液中量取的体积,V3为测定时溶液的总体积,W为称取总黄酮样品的质量。
2.6 异叶青兰总黄酮体外抗氧化活性测定
2.6.1 DPPH自由基清除能力测定 参考文献[11]的方法,并稍作调整。精密吸取1 mL不同质量浓度的异叶青兰总黄酮于试管中,分别加入2 mL DPPH溶液,将其混合摇匀,室温避光反应30 min,于517 nm波长处测得样品吸光度值A样品。吸取75%乙醇1 mL,再加入95%乙醇2 mL,混匀后,517 nm处测得吸光度值A对照。吸取1 mL75%乙醇于试管内,再加入2 mL DPPH溶液,测得其吸光度值A空白。同法精密移取1 mL不同质量浓度维生素C作为样品溶液,用1 mL的蒸馏水替代样品溶液,分别加入2 mL DPPH或95%乙醇作为空白或对照,测得吸光度。按下式分别计算异叶青兰总黄酮和维生素C对DPPH自由基的清除率。DPPH自由基的清除率(%)=[A空白-(A样品-A对照)]/A对照×100%。结果当异叶青兰总黄酮的质量浓度为0.01~0.6 mg·mL-1时,随着质量浓度的增大,异叶青兰总黄酮清除DPPH自由基的能力逐渐增强,且有较为显著的量效关系。当质量浓度达到0.6 mg·mL-1时,其清除率高达82.94%。而当质量浓度大于0.6 mg·mL-1时,其对DPPH自由基的清除率增长幅度逐渐变小。与维生素C相比,异叶青兰总黄酮对DPPH自由基的清除能力稍弱。通过SPSS 21.0 软件分析,异叶青兰总黄酮和维生素 C 清除DPPH自由基的IC50值分别为0.063 mg·mL-1和0.012 mg·mL-1(见图1)。
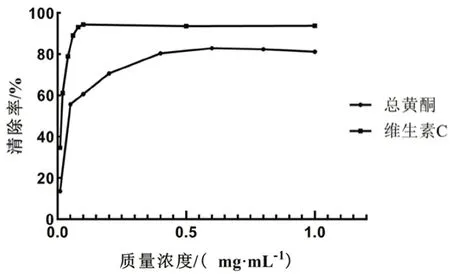
图1 异叶青兰总黄酮对DPPH自由基清除率曲线Fig 1 Scavenging rate curve of the total flavonoids of Dracocephalum heterophyllum Benth on DPPH free radicals
2.6.2 ABTS自由基清除能力测定 参考文献[12]按照试剂盒说明配制ABTS工作液并按步骤进行操作,酶标仪预热30 min以上,调节波长至405 nm测定。按下式分别计算异叶青兰总黄酮和维生素C的ABTS自由基清除能力。ABTS自由基清除率(%)=[A空白-(A样品-A对照)]/A空白×100%。结果当质量浓度为0.01~0.4 mg·mL-1时,随着质量浓度的增大,异叶青兰总黄酮对ABTS自由基的清除能力逐渐增强,有明显的量效关系。且质量浓度为0.4 mg·mL-1时,其清除率可高98.48%。而当质量浓度大于0.4 mg·mL-1时,其对ABTS 自由基的清除率的增长趋势逐渐变缓。当维生素C 的质量浓度在0.01~1 mg·mL-1时,随着质量浓度的增大,其清除自由基能力也增大,且当质量浓度为0.1 mg·mL-1时,清除率高达98.42%。而当质量浓度大于0.1 mg·mL-1时,其对ABTS 自由基的清除率的增长趋势逐渐变缓。当质量浓度达到0.4 mg·mL-1时,其清除ABTS自由基的能力与维生素C 相当。通过SPSS 21.0 软件分析,异叶青兰总黄酮和维生素C清除ABTS自由基的IC50值分别为0.079 mg·mL-1和0.028 mg·mL-1(见图2)。
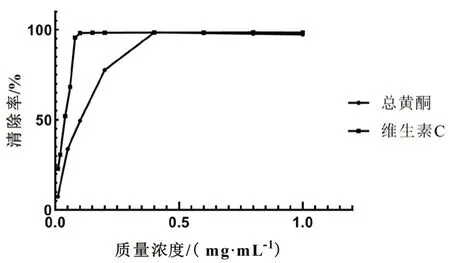
图2 异叶青兰总黄酮对ABTS 自由基清除率曲线Fig 2 Scavenging rate curve of the total flavonoids of Dracocephalum heterophyllum Benth on ABTS free radicals
2.6.3 总抗氧化能力测定 按照试剂盒说明进行操作,制备40 μmol·mL-1FeSO4标准溶液,并将其用蒸馏水稀释至不同浓度梯度,提前30 min预热酶标仪,调节波长至593 nm测定测定吸光度,以Fe2+终浓度为横坐标,对应的吸光度为纵坐标,绘制标准曲线,并按下式分别计算异叶青兰总黄酮和维生素C 总抗氧化能力。总抗氧化能力(μmol·mL-1)=X×V反总/V样=34X,其中V反总指反应总体积,V样为反应中样本体积。以Fe2+终浓度为横坐标,以△A为纵坐标(其中△A指样品的抗氧化能力以达到同样吸光度变化值),X指样品扣除空白后的吸光度代入回归方程得到的Fe2+当量(μmol·L-1)。结果在本实验研究浓度范围内,随着异叶青兰总黄酮质量浓度的增大,其总抗氧化能力也增大,当质量浓度达到1 mg·mL-1时,其总抗氧化能力值为5.81 μmol·mL-1。随着质量浓度的增大,维生素C总抗氧化能力逐渐增强,当质量浓度达到1 mg·mL-1时,其总抗氧化能力值为10.79 μmol·mL-1,是相同浓度异叶青兰总黄酮总抗氧化能力的1.86倍,故维生素C的总抗氧化能力强于异叶青兰总黄酮(见图3)。
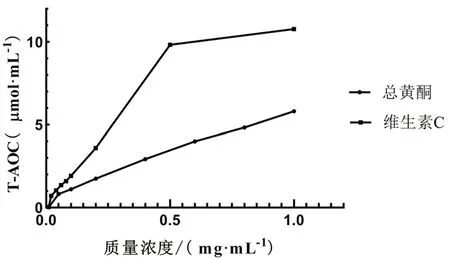
图3 异叶青兰总黄酮总抗氧化能力Fig 3 Total antioxidant capacity of total flavonoid of Dracocephalum heterophyllum Benth
3 讨论
本实验采用70%乙醇加热回流提取、纯化得到异叶青兰总黄酮提取物。通过硝酸铝比色法测定异叶青兰总黄酮含量,测得异叶青兰总黄酮平均含量为48.6%,所建立的方法操作简便。近年来,大量研究表明,许多疾病的发生都与自由基以及人体氧化应激状态有关[13]。自由基是一种由机体氧化反应而产生的具有较强的氧化性的有害化合物,它能损害人体的组织和细胞,并引起多种慢性疾病的发生[14]。DPPH是一种性质稳定且其醇溶液显深紫色的自由基,该自由基在517 nm处存在吸收峰[15]。ABTS自由基清除能力检测法可用于亲水性和亲脂性物质抗氧化能力测定。经氧化后的ABTS可生成稳定的ABTS+自由基,该阳离子呈蓝绿色,在405 nm或734 nm波长处有最大吸收峰[16]。本实验通过检测异叶青兰总黄酮清除DPPH、ABTS自由基的能力以及总抗氧化能力,发现异叶青兰总黄酮质量浓度与其清除自由基以及抗氧化能力之间存在一定的量效关系,提示可以对该药材在抗氧化方面的应用做更深入的研究。
