独角莲抗肿瘤活性成分初步研究
2021-07-03宁停波李涛姜宇珺梁红宝姚景春张贵民山东新时代药业有限公司山东临沂73400鲁南制药集团股份有限公司中药制药共性技术国家重点实验室山东临沂76006
宁停波,李涛,姜宇珺,梁红宝,姚景春,张贵民*(.山东新时代药业有限公司,山东 临沂73400;.鲁南制药集团股份有限公司中药制药共性技术国家重点实验室,山东 临沂 76006)
独角莲为天南星科犁头尖属植物独角莲(Typhonium giganteumEngl.)的干燥地下块茎,现主产于河南、甘肃等地区[1],在中国有着悠久的药用历史,具有逐寒、祛风痰、止痛止痉、解毒散结之功效,临床上常用来治疗惊风癫痫、破伤风等症,民间也用于治疗恶疮、毒蛇咬伤[2]。近年对独角莲的研究主要集中在其抗恶性肿瘤活性方面,且药理学实验也证实独角莲具有显著的抑制肿瘤生长作用[3-6],但其相关的活性成分却一直没有确定[7]。之前该植物化学成分研究主要集中于脂溶性部位,分离得到的化合物主要有脑苷类、有机酸、氨基酸等成分[8-10]。基于独角莲的水提物具有较好活性[11],而且该部位化学成分的研究报道很少,所以本文采用活性追踪法利用模式动物对独角莲的水提物进行抗肿瘤活性的初步研究。
1 材料
Bruker-600 MHz核磁共振波谱仪(瑞士Bruker公司);6500Serises Q-TOF质谱仪(美国Aglient公司);半制备型高效液相色谱仪输液泵(NP7010)、检测器(NU3001)(汉邦科技)和色谱柱(50 mm×200 mm,北京创新通恒科技有限公司);001×7阳离子交换树脂和201×4阴离子交换树脂(天津南开化工厂);薄层硅胶色谱(青岛海洋化工厂);步琪R3旋转蒸发仪(瑞士Buchi公司);切片机(上海南掘中药机械制造有限公司,QYJ-200);烘干机(上海康健中药机械制造有限公司,FYJ-8);粉碎机(上海市药材药材有限公司,FY320);离心机(上海戴宝机械设备有限公司,GQ142);L-精氨酸对照品(深圳市斯坦德化工科技有限公司,纯度≥98%);其他试剂均为分析纯;ICR小鼠4~6周,雌雄各半,体质量18~22 g [北京维通利华实验动物技术有限公司,动物生产许可证:SCXK(京)2016-0011];S180小鼠腹水瘤细胞(中国科学院上海生命科学研究院细胞资源中心);独角莲购自黑龙江省七台河,经鲁南制药集团中药制药共性技术国家重点实验室李守信高级工程师鉴定为独角莲Typhonium giganteumEngl.的块茎,植物标本存放于鲁南制药集团中药制药共性技术国家重点实验室。
2 提取与分离
取鲜独角莲块茎(50.0 kg)切片、烘干、粉碎,过40目筛,加入10倍量水加热至微沸提取3次,每次提取2 h,合并提取液,加入95%乙醇调节醇浓度至30%,醇沉过夜,离心取上清液,减压浓缩得总浸膏2.2 kg。将总浸膏溶解于纯化水中,上样预处理好的001×7阳离子交换树脂柱(15 kg,13 mm×1400 mm),吸附过夜,收集上样流出液,蒸干得组分Fr.1(1.8 kg);用纯化水冲洗树脂柱至无色,再用0.5%的氨水洗脱树脂至无色,收集洗脱液,减压浓缩至干膏,即得独角莲水提液的活性部位Fr.2(103.1 g)。Fr.2用纯化水溶解,上样预处理好的201×4阴离子交换树脂柱(15 kg,13 mm×1400 mm),吸附过夜,收集上样流出液,蒸干得组分Fr.3(63.7 g);用纯化水冲洗树脂柱至无色,再用0.1%的盐酸洗脱树脂至无色,收集洗脱液,减压浓缩得干膏Fr.4(18.3 g)。Fr.4经半制备高效液相色谱分离,甲醇-水(5∶95)为流动相,检测波长220 nm,纯化得化合物1(198.3 mg,流速1 mL·min-1,tR=3.715 min)。
3 结构鉴定
化合物1:白色结晶,mp 244℃;1H NMR(600 MHz,D2O)δ:1.59(1H,m,H-2),1.80(1H,d,H-5),3.27(1H,t,H-6);13C NMR(150 MHz,D2O)δ:157.67(C-1),40.39(C-2),23.78(C-3),28.48(C-4),54.22(C-5),179.38(C-6);ESI-MS:m/z175.1 [M+H]-。以上数据与文献报道一致[12],在相同TLC、HPLC条件下,化合物1与L-精氨酸对照品的Rf值、显色情况以及出峰时间完全一致,故鉴定化合物1为L-精氨酸。
4 对小鼠S180实体瘤抑制活性
4.1 对小鼠S180实体瘤的体内抑瘤活性检测
体外培养S180细胞,调节细胞浓度为1×107个·mL-1,取0.2 mL接种于备用小鼠的腹腔,形成腹水,按以下方法传代:脱颈处死荷瘤小鼠,放入盛有75%乙醇的烧杯中浸泡5~10 min,将消毒后的小鼠放入超净工作台中,暴露腹部,无菌条件下,抽取小鼠腹水,1000 r·min-1离心5 min,生理盐水清洗5遍,去除蛋白等杂质,用生理盐水调节细胞浓度为1×107个·mL-1,0.2 mL接种于备用小鼠的腹腔,待生成腹水后重复传代步骤。取2~3代状态良好的乳白色腹水离心后,生理盐水调节细胞浓度为5×106个·mL-1,每只0.2 mL接种于实验小鼠腋下。
将上述已造模的小鼠按体质量随机分为21组,每组10只,分别为:模型组和不同剂量给药组;给药组组分Fr.1、Fr.2按表1所列剂量给药,组分Fr.3、Fr.4按表2所列剂量给药,化合物1、L-精氨酸按表3所列剂量给药。按实验设计剂量灌胃给药,模型组给予等体积纯化水,1次·d-1,连续10 d。分组后连续给药,待模型组肿瘤直径长至1.2~1.5 cm停药,麻醉放血,剖检小鼠,称取小鼠肿瘤质量。抑瘤率=(模型组瘤质量-用药组瘤质量)/模型组瘤质量×100%。应用SPSS 17.0软件进行统计学分析,组间比较采用单因素方差分析,实验数据以(±s)表示,以P<0.05为差异有统计学意义。
4.2 独角莲水提液活性部位的抑瘤活性
由表1可知,组分Fr.2中、高剂量均能显著抑制小鼠S180实体瘤的生长,抑瘤率分别为48.15%和53.70%,而组分Fr.1(001树脂上样流出液)不具有抑瘤活性或活性很低。
表1 组分Fr.1和Fr.2对小鼠S180实体瘤的抑瘤作用(±s)Tab 1 Anti-tumor effect of Fr.1 and Fr.2 on sarcoma-180 ascite tumor-bearing mice (±s)
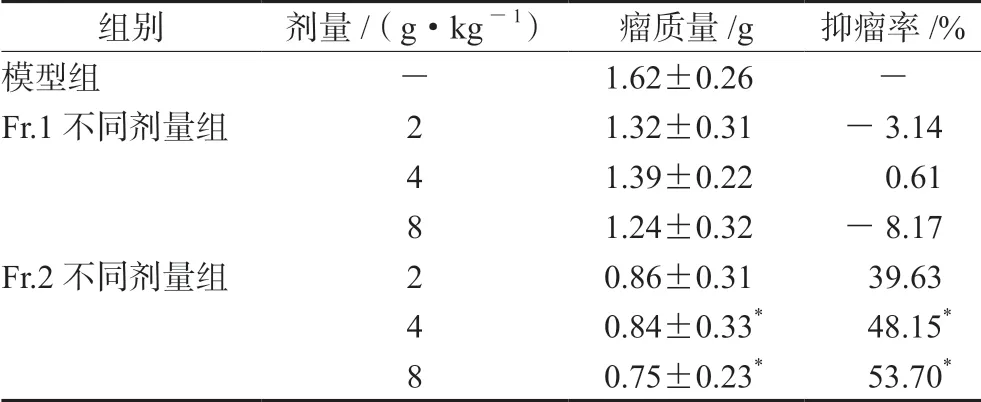
表1 组分Fr.1和Fr.2对小鼠S180实体瘤的抑瘤作用(±s)Tab 1 Anti-tumor effect of Fr.1 and Fr.2 on sarcoma-180 ascite tumor-bearing mice (±s)
注(Note):与模型组比较,*P<0.05(Compared with the model group,*P<0.05)。
组别剂量/(g·kg-1)瘤质量/g抑瘤率/%模型组-1.62±0.26-Fr.1不同剂量组21.32±0.31-3.14 4 1.39±0.22 0.61 8 1.24±0.32-8.17 Fr.2不同剂量组20.86±0.31 39.63 4 0.84±0.33* 48.15*8 0.75±0.23* 53.70*
由表2可知,组分Fr.2继续用201×4阴离子交换树脂柱处理所得组分Fr.4,在低、中、高剂量抑瘤率分别为45.28%、50.31%和55.35%,而组分Fr.3(201×4树脂上样流出液)不具有抑瘤活性或活性很低(抑瘤率≤23.47%)。
表2 组分Fr.3和Fr.4对小鼠S180实体瘤的抑瘤作用(±s)Tab 2 Anti-tumor effect of Fr.3 and Fr.4 on sarcoma-180 ascite tumor-bearing mice (±s)
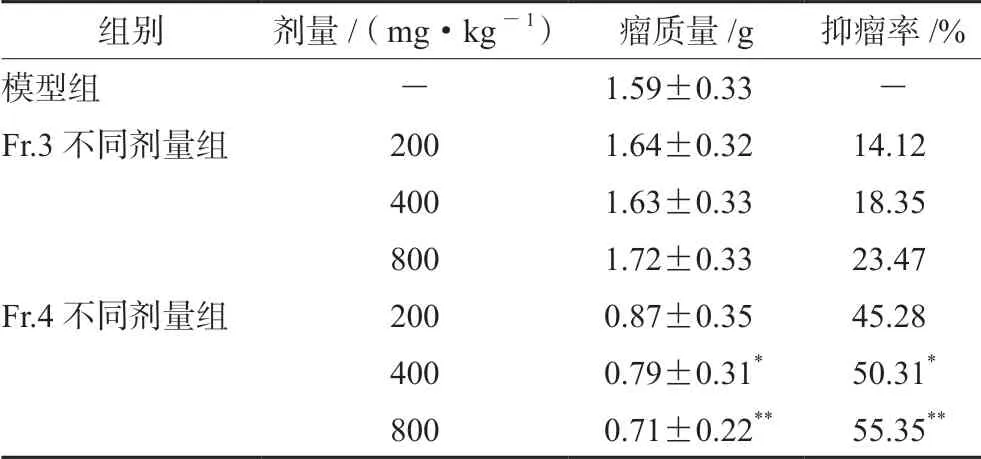
表2 组分Fr.3和Fr.4对小鼠S180实体瘤的抑瘤作用(±s)Tab 2 Anti-tumor effect of Fr.3 and Fr.4 on sarcoma-180 ascite tumor-bearing mice (±s)
注(Note):与模型组比较,*P<0.05(Compared with the model group,*P<0.05)。
组别剂量/(mg·kg-1)瘤质量/g抑瘤率/%模型组-1.59±0.33-Fr.3不同剂量组2001.64±0.3214.12 4001.63±0.3318.35 8001.72±0.3323.47 Fr.4不同剂量组2000.87±0.3545.28 4000.79±0.31*50.31*8000.71±0.22**55.35**
由以上数据可以可知,独角莲提取物经过抑瘤活性追踪和离子交换树脂分离纯化后,得到的组分Fr.4仍具有显著的抑瘤活性。
4.3 L-精氨酸的抑瘤活性
独角莲化合物1与同等剂量的L-精氨酸对照品对小鼠S180实体瘤的生长抑制结果显示,中、高剂量L-精氨酸能够显著抑制小鼠S180实体瘤的生长,抑瘤率分别为48.17%、55.48%。表明L-精氨酸在一定剂量范围内对小鼠S180实体瘤具有剂量依赖性,且与同等剂量的独角莲化合物1组分效果相当(见表3)。
表3 化合物1和L-精氨酸对小鼠S180实体瘤的抑瘤作用(±s)Tab 3 Anti-tumor effect of compound 1 and L-arginine on sarcoma-180 ascite tumor-bearing mice (±s)
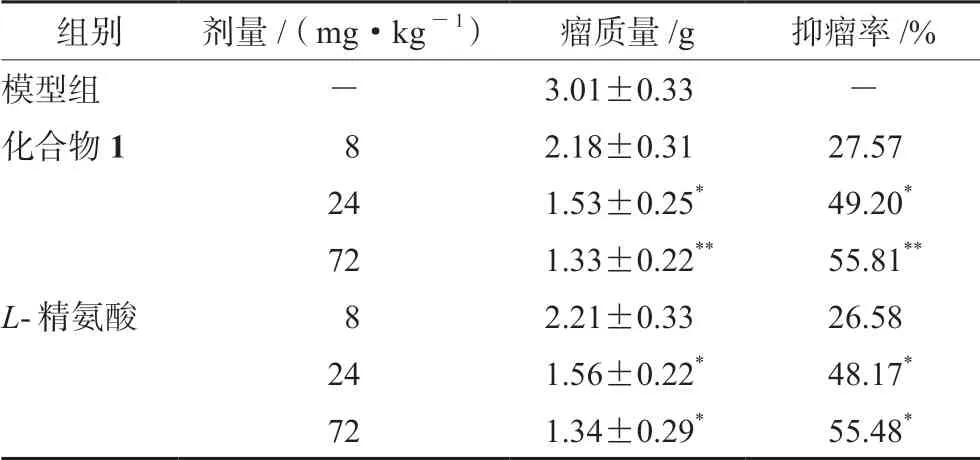
表3 化合物1和L-精氨酸对小鼠S180实体瘤的抑瘤作用(±s)Tab 3 Anti-tumor effect of compound 1 and L-arginine on sarcoma-180 ascite tumor-bearing mice (±s)
注(Note):与模型组比较,*P<0.05,**P<0.01(Compared with the model control group,*P<0.05,**P<0.01)。
组别剂量/(mg·kg-1)瘤质量/g抑瘤率/%模型组-3.01±0.33-化合物1 82.18±0.3127.57 241.53±0.25*49.20*721.33±0.22**55.81**L-精氨酸 82.21±0.3326.58 241.56±0.22*48.17*721.34±0.29*55.48*
5 讨论
大量的药理学实验证实独角莲水煎液具有显著的抗肿瘤活性,但到目前为止其有效成分仍不明确。为了对独角莲的抗肿瘤活性成分进行研究,本课题组摸索过提取其他成分,诸如皂苷和多糖类成分,但经荷瘤小鼠S180抗肿瘤实验筛选发现其活性很低甚至没有。本实验室经过对独角莲提取物抑瘤活性研究初步确定了Fr.1和Fr.2给药剂量范围2~8 g·kg-1、Fr.3和Fr.4给药剂量范围200~800 mg·kg-1、化合物1和精氨酸给药剂量范围8~24 mg·kg-1。本文在上述工作的基础上,选择抗肿瘤活性显著的大极性水提液进行研究,最终经HPLC纯化得单体化合物1,经鉴定其为L-精氨酸,用同等剂量的L-精氨酸对照品作为对照,发现抑瘤活性与化合物1基本一致。该实验初步证明独角莲抗肿瘤活性的有效成分之一是L-精氨酸。
张剑等[13-14]均报道L-精氨酸具有一定的抗肿瘤活性;Grossie等[15]认为,小剂量和过高剂量L-精氨酸均能促进肿瘤生长,只有合适剂量才能抑制肿瘤;也有报道认为L-精氨酸对肿瘤生长无影响,但可促进化疗药物发挥疗效[16]。鉴于此,L-精氨酸的抗肿瘤活性作用机制,还有待进一步研究和探讨。
本实验采用体内实验活性追踪法对独角莲抗肿瘤有效成分进行了追踪,最终找到了具有抗肿瘤作用的活性成分之一——L-精氨酸,但由于L-精氨酸抗肿瘤机制不明,不排除是多种成分协同作用产生活性的可能性。本文为独角莲抗肿瘤活性研究提供一定的参考,如需明确抗肿瘤机制,还需要进一步研究。
