壮药矮陀陀含药血清通过激活Bax/Caspase-3诱导H22凋亡
2021-07-03陶林吴霜文建文韦立志广西医科大学第二附属医院药物临床试验机构办公室南宁530007广西中医药大学第一附属医院药学部南宁530007广西医科大学第二附属医院药学部南宁530007
陶林,吴霜,文建文,韦立志(.广西医科大学第二附属医院 药物临床试验机构办公室,南宁 530007;.广西中医药大学第一附属医院药学部,南宁 530007;3.广西医科大学第二附属医院药学部,南宁 530007)
肝癌新发病例全球每年约有78万,其死亡率仅次于肺癌,排名第二[1]。我国肝癌的5年生存率仅为10.1%,一经确诊已为晚期[2]。肝癌患者主要以放疗、化疗为最主要的有效治疗手段。顺铂因抗瘤谱广、疗效显著已经成为治疗多种恶性肿瘤的临床一线用药,其抗肿瘤作用与DNA损伤和DNA合成抑制相关,主要通过激活细胞凋亡,最终导致肿瘤细胞死亡。近年来中医药在肿瘤治疗方面取得了较好的成果[3]。壮药矮陀陀原植物(Munronia henryi)又称小地黄连、小独根、千年矮、思茅地黄连等,其味甘微苦,性凉,具有清热解毒、活血止痛的功效。广西民间常用其全草臼烂水煎内服治疗腹痛、风湿痛等[4],还可用于治疗跌打瘀痛、感冒发热、咽喉炎、痈肿疔疮[5]。刘越滇等[6]发现矮陀陀乙醇提取物具有镇痛、抗炎活性。Lin 等[7]发现矮陀陀提取物具有抑菌活性,其中mulavanin D和2α,3α,15β-trihydroxy-20(S)-tigloyl-pregnane对红色毛廯菌的MIC(最低抑菌浓度)分别为 25、50 μg·mL-1。此外,矮陀陀具有抗病毒活性,能抑制烟草花叶病毒(TMV)的复制。Yan等[8]发现矮陀陀中分离所得柠檬苦素衍生物具有抗肿瘤活性,能显著抑制HL-60、H22、A-549、MCF-7、SW480 等5种癌细胞株增殖。Qi等[9]的研究表明矮陀陀提取物具有较强的抗肿瘤活性,能够抑制肺癌细胞A549的增殖(抑制率32.8%),并诱导肿瘤细胞凋亡。矮陀陀在体内是否具有抗肿瘤活性尚未见报道,本研究拟探究矮陀陀含药血清对小鼠肝癌H22细胞株的增殖影响及机制,阐明矮陀陀的抗肿瘤活性及可能机制,为其临床应用提供实验依据。
1 材料
1.1 细胞与动物
小鼠肝癌细胞株H22购于中国医学科院肿瘤医院(广西医科大学药理教研室传代保存)。SPF级雄性SD大鼠25只,体质量180~220 g,购于广西医科大学动物实验中心SPF动物房,动物许可证号:SCXK桂2014-0002。
1.2 试药
壮药矮陀陀,采自广西靖西县,由广西中医药大学第一附属医院中药鉴定室文建文主管药师鉴定为楝科植物地黄连属云南地黄连Munronia delavayiFranch.干燥全株,注射用顺铂(江苏豪森药业股份有限公司,规格:20 mg,批号:150701),DMEM培养液(Sigma公司),FBS(胎牛血清,杭州四季青生物公司),胰蛋白酶消化液(Hyclone公司),青霉素链霉素混合液(Solarbio公司),MTT(四甲基偶氮唑蓝)检测试剂盒(科昊生物公司),反转录试剂盒(TAKARA公司),caspase-3(细胞凋亡蛋白酶)检测定量试剂盒(abcamab公司),TRIzol裂解液(Invitrogen公司),Annexin V-FITC/PI 细胞凋亡检测试剂盒(翊圣生物公司)。PCR引物设计由擎科生物公司设计,见表1及表2。

表1 荧光定量PCR引物序列Tab 1 Quantitative real-time PCR primer sequence

表2 PCR反应体系Tab 2 Reaction system of PCR
1.3 仪器
CO2细胞培养箱(Heal Force公司),流式细胞仪(Beckman公司),低温高速离心机(Eppendorf公司),倒置显微镜(Nikon公司),荧光显微镜(Olympus公司),定量PCR仪(Applied Biosystems公司),酶联免疫检测仪、Gel Image System凝胶成像分析系统(Bio-rad公司)。
2 方法
2.1 矮陀陀含药血清制备
将4 kg药材切成直径0.5 cm左右的细条后用水提取(加入8倍量的纯净水先冷浸1 h,再文火加热回流2 h,提取2次,过滤,合并滤液);提取液滤液用旋转蒸发仪进行旋蒸浓缩为8 mg·mL-1的生药液冷藏备用。使用时再配制成相应的浓度。
取SPF级雄性SD大鼠25只,体质量180~220 g,随机分成5组,每组5只,分别为空白对照组、阳性对照组、低剂量给药组、中剂量给药组和高剂量给药组。空白对照组灌胃给予生理盐水,阳性对照组灌胃给予顺铂(1 mg·kg-1),低、中、高剂量组分别按20、40、80 mg·kg-1灌胃给予由生理盐水配制的生药液;每日给药2次,每次1 mg·mL-1,连续给药5 d。末次给药前禁食不禁水12 h,末次给药后1 h,以0.003 g·mL-1水合氯醛麻醉大鼠,腹主动脉取血。血液室温放置4 h后,待血块凝结,3000 r·min-1离心20 min,吸取上部血清得到含药血清。同组动物血清合并,经56℃灭活30 min,于无菌环境中用0.22 μm微孔滤膜过滤除菌,分装,置冰箱-80℃保存备用。
2.2 H22细胞培养
H22细胞以1×105个/孔的浓度接种于96孔板中,10%FBS的DMEM作为培养基,37℃、5%CO2培养箱中培养24 h,每日换液一次,待细胞长至80%时采用胰蛋白酶消化液进行消化传代,取对数生长期细胞进行实验。
2.3 MTT法检测细胞增殖情况
将对数生长期的H22细胞以1×104个/孔接种于96孔板中,37℃、5%CO2培养过夜。待其贴壁后,弃去上层培养基,分别加入含15%不同含药血清的培养基(根据前期文献调研及预实验确定),在37℃、5%CO2培养箱中培养24 h。加入20 μL 5 mg·mL-1的MTT孵育4 h,弃去全部液体,每孔加入200 μL DMSO,摇床震荡10 min 后,酶标仪在492 nm处测定吸光度值,每孔设定5个复孔,细胞抑制率=(OD空白对照组-OD实验组)/OD空白对照组×100%。
2.4 Annexin V-FITC/PI流式细胞术检测细胞凋亡情况
将对数生长期的H22细胞以1×105个/孔接种于6孔板中,按“2.3”项下方法加药培养24 h。0.25%胰酶室温消化细胞3 min,1000 r·min-1离心3 min,弃去上清液。细胞用磷酸盐缓冲液(PBS)清洗2遍后,用500 μL Binding Buffer重悬,依次加入1 μL Annexin V-FITC和5 μL PI(碘化丙啶)混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡。
2.5 RT-PCR检测Bcl-2、Bax、Caspase-3表达情况
将对数生长期的H22细胞以1×105个/孔接种于6孔板中,按“2.3”项下方法加药培养24 h。0.25%胰酶室温消化,1000 r·min-1离心3 min,弃去上清液,细胞用PBS清洗2遍,收集细胞按照TAKARA试剂盒说明书提取mRNA,PCR条件:94℃预变性 2 min,“94℃变性 30 s,60℃退火 30 s,72℃延伸 30 s”×35 个循环,72℃终延伸 2 min。以β-actin为内参与空白对照组进行相对定量,计算方法采用2-△△ct计算相对定量结果。
2.6 蛋白提取以及Western Blot检测Bcl-2、Bax、Caspase-3蛋白表达
将对数生长期的H22细胞以1×105个/孔接种于6孔板中,按“2.3”项下方法加药培养24 h。加入100×蛋白酶抑制剂0.8 μL和80 μL RIPA反复吹打裂解,冰上裂解15 min后12 000 r·min-1、4℃离心10 min。取上清液,加入五分之一体积的5×蛋白上样缓冲液,沸水加热5 min变性,-20℃保存。BCA试剂盒定量后,将蛋白样品经聚丙烯酰胺凝胶 100 V 电泳约 1 h,电转液中湿性电转(80 V)2 h,电转至 PVDF(聚偏氟乙烯)膜,4%脱脂奶粉 37℃封闭2 h,摇床摇匀,加入抗体Caspase3(1∶1000 稀释)、Bax 抗体(1∶1000 稀释)、Bcl-2(1∶1000 稀释)、β-actin(1∶2000稀释),4℃摇床过夜。1% TBST洗膜,加入相应二抗,室温孵育2 h,1% TBST洗膜后加入适宜剂量的 ECL 显色液在暗室凝胶成像仪下曝光成像,并用 Image J 软件进行图像分析。
2.7 Caspase-3 的免疫荧光染色
将对数生长期的H22细胞以2×104个/孔接种于放有盖玻片的24孔板中,按“2.3”项下方法加药培养24 h。玻片用PBS清洗2次,每次2 min。室温下用4%多聚甲醛孵育10 min固定细胞。磷酸盐吐温缓冲液(PBST)清洗细胞2次,每次2 min;PBS-5% Tween 20浸润10 min;PBST清洗细胞2次,每次2 min;5% FBS室温封闭1 h;人源Caspase-3抗体按1∶100比例稀释用5% FBS稀释后,取20 μL加入细胞室温孵育2 h;PBST清洗细胞2次,每次2 min;加入按1∶100比例用5% FBS稀释的山羊抗人的异硫氰酸荧光素(FITC)标记IgG二抗,室温孵育1 h;PBST清洗细胞2次,每次2 min;细胞用5 μg·mL-14',6-二脒基-2-苯基吲哚(DAPI)室温孵育1 h复染;最后用甘油封闭后,激光共聚焦显微镜进行观察拍照;用Image J软件测量荧光强度,GraphPad Prism 6软件进行统计学分析。
2.8 统计方法
采用SPSS 19.0统计软件进行数据处理,实验数据以均数±标准差表示,两组间比较采用样本t检验,多组间比较采用方差分析,P<0.05为差异具有统计学意义。
3 结果
3.1 矮陀陀抑制H22的增殖
结果如表3所示,与空白对照组比较,矮陀陀含药血清对H22细胞的增殖有明显的抑制作用(P<0.05),并且随着矮陀陀给药剂量的增加,抑制率显著增加。

表3 含顺铂、不同剂量矮陀陀的血清对H22增殖的影响(n=5)Tab 3 Effect of serum containing cisplatin,different doses of Munronia henryi on H22 proliferation (n=5)
3.2 矮陀陀含药血清可促进H22细胞的凋亡
矮陀陀含药血清和顺铂含药血清均能诱导H22细胞凋亡(见图1)。随着矮陀陀给药剂量的增加,凋亡细胞的数量显著增加,见表4。
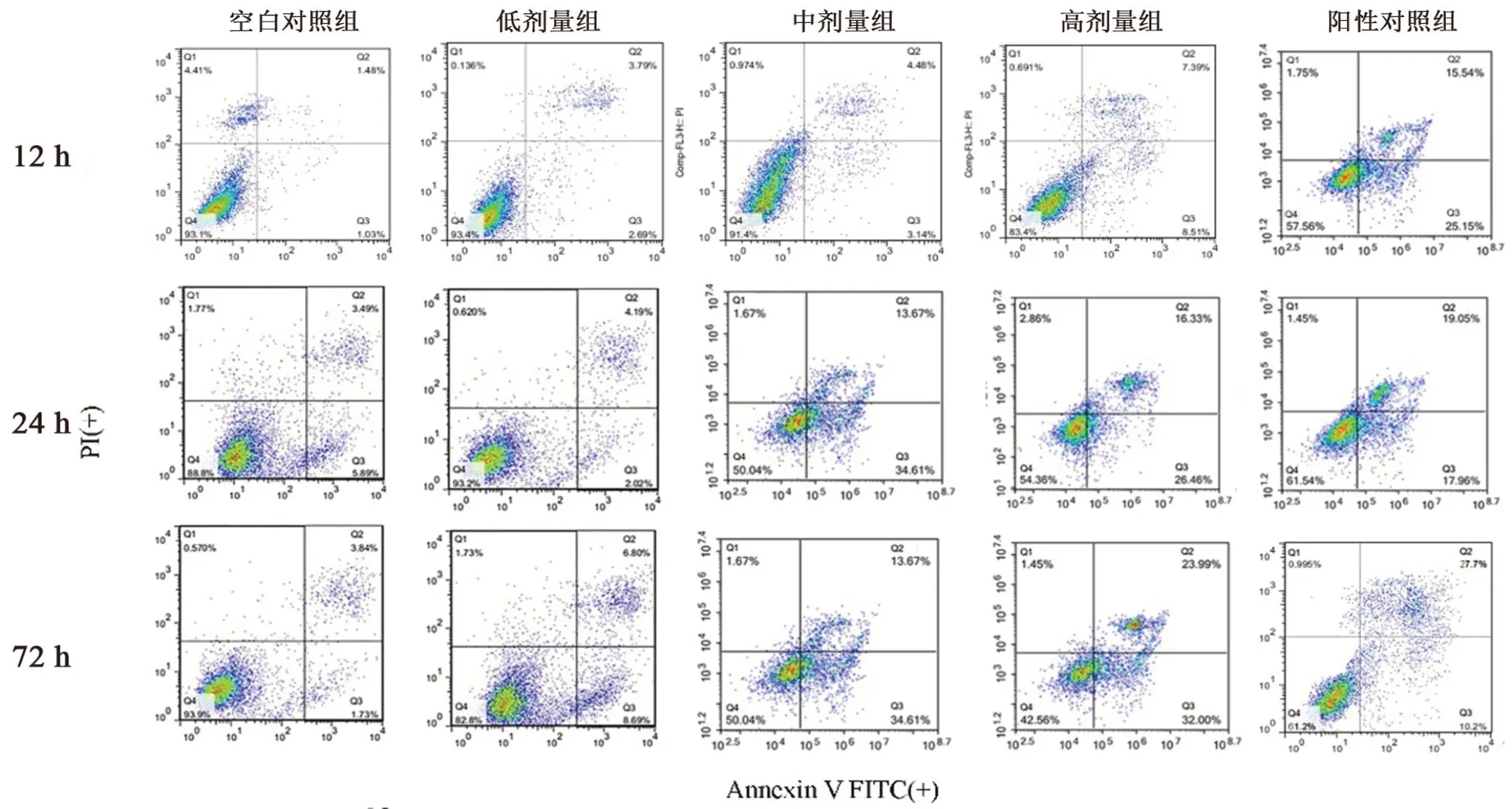
图1 Annexin V-FITC/PI流式细胞术检测含顺铂、不同剂量矮陀陀的血清分别在不同时间对H22凋亡的影响Fig 1 Annexin V-FITC/PI flow cytometry for determing the effect of serum containing cisplatin,different doses of Munronia henryi on H22 apoptosis at different time
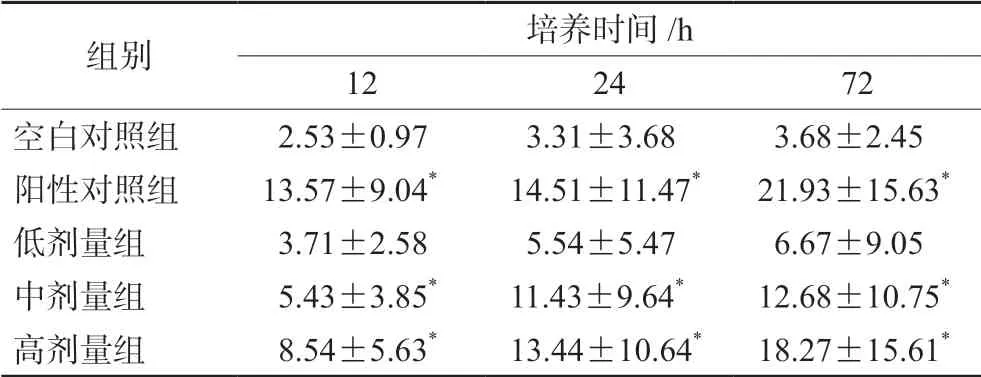
表4 含顺铂、不同剂量矮陀陀的血清对H22凋亡的影响(n=3)Tab 4 Effect of serum containing cisplatin,different doses of Munronia henryi on H22 apoptosis (n=3)
3.3 矮陀陀含药血清对Bax、Caspase-3和 Bcl-2的mRNA表达水平的影响
与空白对照组相比,顺铂能显著增加H22细胞中Bax和Caspase-3的mRNA水平,并且显著降低Bcl-2的mRNA水平。不同剂量的矮陀陀含药血清具有类似的作用,且表现出一定的剂量依赖性,随着矮陀陀给药剂量的增加,Bcl-2的mRNA水平逐渐降低,Bax和Caspase-3的mRNA水平逐渐增加,结果见表5。

表5 含顺铂、不同剂量矮陀陀血清对H22细胞Bcl-2,Bax,Caspase-3 mRNA相对表达量的影响(n=3)Tab 5 Effect of serum containing cisplatin,different doses of Munronia henryi on relative expression levels of Bcl-2,Bax and Caspase-3 mRNA in H22 cells (n=3)
3.4 矮陀陀含药血清对Bax、Caspase-3和Bcl-2蛋白的表达的影响
与空白对照组相比,矮陀陀含药血清和顺铂含药血清都能显著增加H22细胞中Bax和Caspase-3的蛋白表达,并且显著抑制Bcl-2的蛋白表达。随着矮陀陀浓度的增加Bax/Bcl-2比值逐渐增加,在高剂量时差异具有统计学意义(P<0.005),表明矮陀陀可能通过增加Bax/Bcl-2促进肿瘤细胞的凋亡。结果如图2所示。

图2 Western Blot检测含顺铂、不同剂量矮陀陀的血清处理后H22细胞中Bcl2、Bax和Caspase-3表达情况Fig 2 Western Blot in detecting the expression of Bcl2,Bax and Caspase-3 in H22 cells treated with serum containing containing cisplatin and different doses of Munronia henryi
3.5 免疫荧光检测矮陀陀可增加Caspase-3蛋白的表达
如图3A所示,相对于空白对照组,阳性对照组和矮陀陀高剂量组Caspase-3荧光强度显著增加(P<0.01),这一结果与Western Blot中的阳性对照组和矮陀陀高剂量组Caspase-3表达量显著增加一致,如图3B所示,随着矮陀陀剂量的增加Caspase-3荧光强度也逐渐增加,呈剂量依赖性。
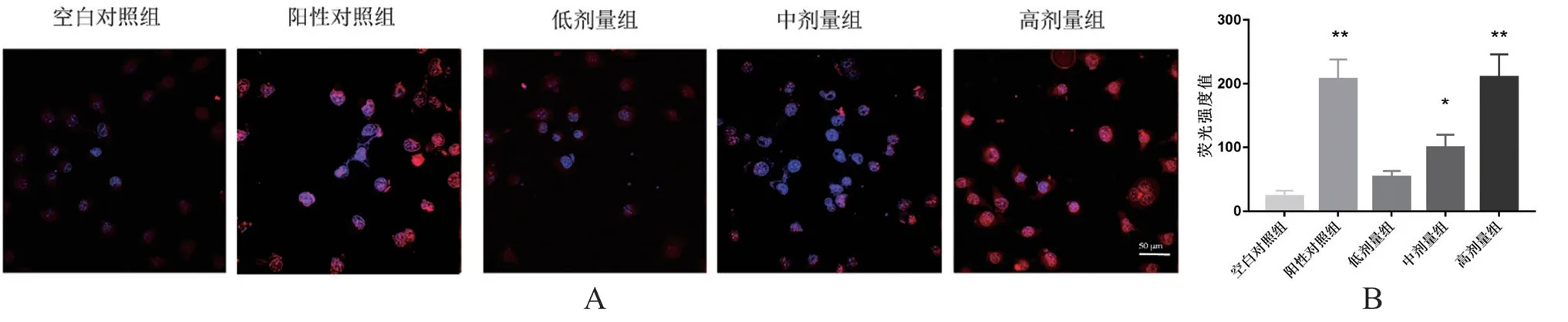
图3 免疫荧光检测含顺铂、不同剂量矮陀陀的血清处理后H22细胞中Caspase-3的表达情况(标尺=50 μm)Fig 3 Immunofluorescence was used to detect the expression of Caspase-3 in H22 cells treated with serum containing cisplatin and different doses of Munronia henryi(scale=50 μm)
4 讨论
本实验涉及的矮陀陀供试液为其水提粗提物。含药血清为实验动物经灌胃给药一定时间后采集到的动物血清,适宜于研究成分复杂的中草药药理药效。采集含药血清进行实验使中药药效的研究不再局限于整体的功能研究,而是根据体内有效药物的主要存在部位,结合细胞学和分子生物学手段,从基因、基因产物、药物受体和酶活性等方面阐述药物作用机制[10]。采用血清药理学的研究方法,在药物体外活性研究时能在一定程度上排除粗提物其他因素的干扰,使结果更为可靠[11]。含中药的血清可直接用于体外研究,所反映的实验结果更为客观具体,为中国传统医药的研究拓宽了思路,提供了新的方法。然而,该方法起步较晚,仍然存在一些不足,首先在含药血清的制备过程中,给药剂量、采血时间和动物模型都没有严格的规定,标准不统一,无法进行标准化制订,为解决这一问题,在实验开启前需要查阅文献并结合预实验,才能最大程度地提高实验结果的客观性。其次当药物进入体内血液循环,经过代谢可能转化为其他代谢产物,导致最终进入血液的不是药物原形成分,为解决这一问题,可与药物分析、药代动力学、药物化学等专业结合,联合采用质谱、液相、核磁等分析手段,进一步完善和发展血清药理学。
本研究结果证明,矮陀陀可抑制肝癌细胞株H22增殖并促进其凋亡(P<0.05)。线粒体中凋亡分子Apaf-1释放与细胞色素C相互作用激活Caspase-3信号转导[12],激活后的Caspase-3、PARP1、Bcl-2和Bax可直接激活上述一种或几种凋亡通路,诱导细胞凋亡[13]。本研究中矮陀陀处理后Caspase-3的显著升高是其导致H22凋亡的主要原因。Bax/Bcl-2比值对于细胞是否进入凋亡状态有决定意义,Bcl-2分布在细胞质中调控线粒体膜的通透性,通过降低线粒体膜电位、抑制细胞色素C释放以及Caspase-3激活从而对凋亡产生负调控[14];Bax作用正好相反,当期构象发生改变时,进入线粒体并破坏线粒体膜,释放细胞色素C,激活Cyt C/Caspase-9信号通路,对细胞凋亡起正调控[15]。Bcl-2和Bax之间形成异源二聚体,Bax/Bcl-2比值增加可促进细胞凋亡,降低则抑制细胞凋亡,故矮陀陀含药血清促进H22凋亡可能与激活Bax和Caspase-3表达,以及增加Bax/Bcl-2比值有关。有大量研究指出多种肿瘤的发生发展与Bax、Bcl-2密不可分,如Albamonte等[16]检测了215例卵巢癌患者中Bax和Bcl-2表达情况,Bax阳性率为30%,Bcl-2阳性率为47%,Bax阳性者的预后优于Bax阴性者;Bcl-2阳性者预后不如Bcl-2阴性者。崔运浩等[17]研究也证明黄芪多糖能明显增加人胃癌细胞中Bax/Bcl-2比值,从而诱导胃癌细胞凋亡。
综上所述,矮陀陀能抑制H22细胞增殖,并且通过激活Bax和Caspase-3表达,以及增加Bax/Bcl-2比值诱导肿瘤细胞凋亡。
