MS-222麻醉对西伯利亚鲟稚鱼耗氧率与幼鱼血液生化指标的影响
2021-07-03孙雪娜冯广朋王海华刘鉴毅庄平
孙雪娜,冯广朋*,王海华,刘鉴毅,庄平
(1. 中国水产科学研究院东海水产研究所,上海 200090;2. 江西省水产科学研究所,江西 南昌 330039)
麻醉被广泛应用于鱼类的养殖生产与科学研究,目的在于缓解鱼类应激反应,降低鱼类活动能力,减少鱼体损伤,提高成活率,使相关操作顺利开展[1-2]。因此,选择麻醉方法时,应从安全范围内最大限度地减少生理损伤、行为障碍和恢复时间等方面进行综合考虑[3]。理想的麻醉剂应对鱼的行为或生理影响程度低、见效快,并对环境产生的负面影响最小[4]。MS-222又称鱼安定,其化学名为间氨基苯甲酸乙酯甲磺酸盐(C10H15NO5S),具有麻醉见效快、复苏时间短及安全性能高等优点[5-6],已在养殖生产中得到广泛应用。目前已开展了MS-222对中华鲟(Acipensersinensis)、施氏鲟(Acipenserschrenckii)、美洲鲥(Alosasapidissima)、斑马鱼(Daniorerio)和虹鳟(Oncorhynchusmykiss)等鱼类的麻醉效应研究[7-10],研究内容主要集中在麻醉分期、时间及行为等麻醉效果方面,而对于鱼体生理生化具体影响的研究相对较少。
西伯利亚鲟(Acipenserbaerii)具有生长速度快、适应性强、肉质好和鱼籽酱品质高等优点,为常见优良养殖品种之一[11]。西伯利亚鲟苗种的运输在养殖行业中十分常见,适当麻醉苗种能够缓解因捕捞和计数等环节而产生的应激反应,降低耗氧率,避免在长途运输过程中造成鱼体缺氧和损伤。在养殖过程与科学研究的相关操作中,往往也需要对其进行适当麻醉,以便降低代谢率,增加操作时间,提高成活率。麻醉会对鱼类生理活动产生一定影响,因此麻醉剂浓度的选择十分关键,通过血液生化指标的测定可较好地评价鱼类的健康状况和对环境的反应情况,以筛选适宜的麻醉剂浓度[12]。本研究通过探究不同质量浓度MS-222对西伯利亚鲟稚鱼耗氧率与幼鱼血液生化指标的影响,分析MS-222麻醉对不同规格西伯利亚鲟的影响程度及其生理指标的变化规律,并通过以上相关指标的变化特征阐明西伯利亚鲟适宜的MS-222麻醉浓度,为苗种运输、养殖与研究中更科学地使用MS-222麻醉提供基础数据与理论参考。
1 材料与方法
1.1 实验材料
西伯利亚鲟受精卵共2 000粒,取自杭州千岛湖鲟龙科技开发有限公司,经实验室孵化培育后,选取36 尾体质量较一致的西伯利亚鲟稚鱼用于耗氧率实验,体质量为(1.18±0.49) g。稚鱼经培育养殖后,选取36尾规格较一致的西伯利亚鲟幼鱼用于血液生化指标实验,体质量为(49.4±10.1) g。实验鱼用圆形玻璃钢桶循环水养殖,保持水深0.45 m,温度(16.0±1.0)℃,溶解氧 (6.8 ± 0.6) mg/L,pH(7.4±0.2)。实验鱼每日投喂配合饲料2次,实验前停食1 d。
1.2 麻醉剂与实验装置
化学麻醉剂MS-222购自杭州动物药品厂(纯度99%)。为减少麻醉时产生的应激反应,使用时与碳酸氢钠(NaHCO3)按1∶1(w/w)混合溶于水。耗氧率实验装置为自制密封静止水式呼吸测定仪,选用2.5 L的锥形瓶作为实验瓶。血液生化指标实验装置采用长宽高为1.0 m×0.6 m×0.6 m的蓝色塑料箱,利用增氧机使水体的溶氧维持在6.5 mg/L以上。
1.3 实验设计
耗氧率实验:设置MS-222质量浓度梯度为10、20、30、40和50 mg/L,每个浓度设置3个平行样品,每个锥形瓶放入2尾西伯利亚鲟稚鱼。设置1个对照组(无麻醉剂,有鱼)和1个空白组(无麻醉剂,无鱼,用于测定初始溶氧浓度)。水温为(16.0±0.5)℃。为避免光线直射,实验于阴暗处进行,首先将2.5 L的实验瓶装满水,然后将实验鱼快速放入实验瓶后用液蜡与保鲜膜封口密闭,置于恒温水槽中,实验持续2 h(时间固定为13∶00~15∶00)。2 h后取水样测定实验瓶中水的溶氧浓度,将实验瓶颠倒摇晃3~5次,以保证实验瓶水体溶氧均匀,再用虹吸法将导管插入实验瓶底部取水样,溶氧量测定采用Winkler氏碘量法。最后取出实验鱼,用滤纸吸干鱼体表面水分,在电子天平上称量体重(精确到0.01 g)。耗氧率的计算公式为:
耗氧率Roc=(C1-C2)×V/(W×T)
式(1)
式中,C1、C2分别为实验结束时空白对照瓶(呼吸室无鱼的锥形瓶)和代谢瓶中的溶解氧浓度(mg/L);V为实验瓶水体的体积(L);W为受试鱼的体重(g);T为实验时间(h)。
血液生化指标实验:设置MS-222质量浓度梯度为80、100、120、140和160 mg/L,另设1个对照组,配好相应浓度麻醉剂于蓝色塑料箱中。每组塑料箱中随机放入5尾西伯利亚鲟幼鱼,各组鱼规格无显著差异。麻醉时均采取单尾实验法,即每尾鱼仅供实验1次。每次实验时待鱼进入完全麻醉期后开始计时,完全麻醉期的判断标准为实验鱼对外部的刺激失去条件反射能力,沉底不动,鱼体呈直线状,鳃动频率较低。将西伯利亚鲟幼鱼维持麻醉状态10 min后再采血样。使用2 mL一次性无菌注射器在鱼体臀鳍下方血管抽血,血液注入2.5 mL离心管中后4 ℃冷藏,静置4 h分层后,10 000 r/min离心10 min至完全分层,用移液器取上层澄清透明的血清放入离心管中,使用迈瑞MINDRAY-BS200全自动生化分析仪进行各项生化指标测定。西伯利亚鲟的抽血取样与生化指标测定均在当天内完成。
1.4 数据统计分析
利用统计软件Excel 2010和SPSS 23.0 进行数据统计分析。利用单因素方差分析检验显著性,在方差检验显著的基础上,利用Duncan’s法进行多重比较。P<0.05代表差异显著,实验数据值用mean±SD表示。
2 结果
2.1 耗氧率变化
MS-222对西伯利亚鲟稚鱼耗氧率的影响如图1所示。对照组西伯利亚鲟稚鱼的耗氧率为(0.77±0.07) mg/(g·h)。经不同质量浓度MS-222麻醉后,稚鱼的耗氧率均显著下降(P<0.05),并随着MS-222质量浓度的升高,耗氧率逐渐下降。50 mg/L时耗氧率最低,为(0.36±0.16) mg/(g·h)。MS-222浓度为10~50 mg/L时,耗氧率随浓度升高之间的变化差异不显著(P>0.05)。
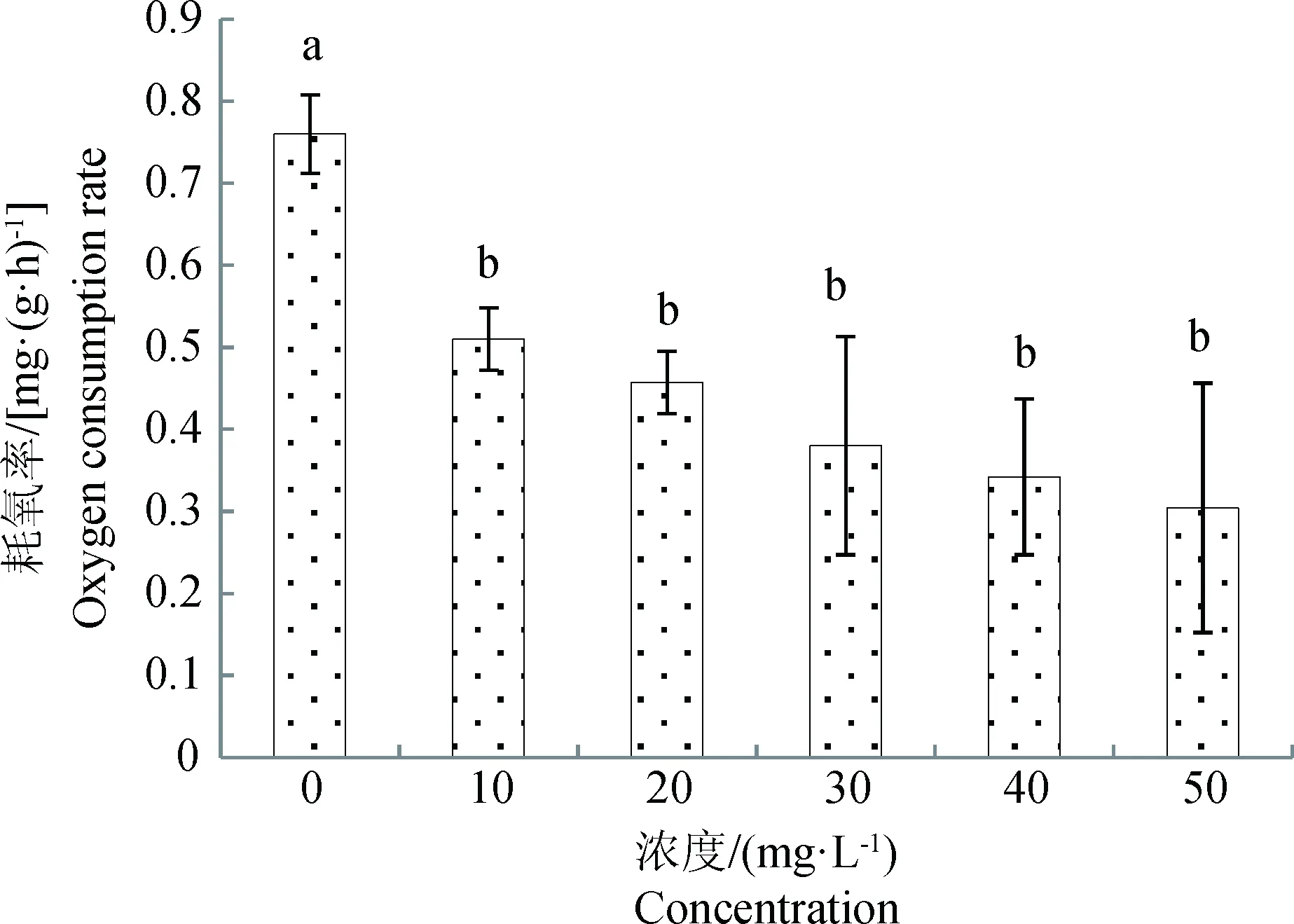
图1 不同浓度MS-222对西伯利亚鲟耗氧率的影响图中相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),下同。Fig.1 Effect of MS-222 with different concentrations on oxygen consumption rate of Acipenser baeriiThe same lowercase letter mean with no significant difference (P>0.05), while different lowercase letters mean with significant difference (P<0.05). The same below.
2.2 血清镁、磷含量变化
西伯利亚鲟幼鱼血清镁与磷的水平变化见表1。对照组血清磷含量为(11.45 ± 0.76) mmol/L,MS-222浓度为80~120 mg/L时,血清磷与对照组无显著性差异(P>0.05)。随MS-222浓度升高,血清磷总体呈上升趋势,于MS-222浓度为160 mg/L时达到最高。MS-222浓度为140 mg/L与160 mg/L时的磷含量均显著高于其余各组(P<0.05)。对照组西伯利亚鲟血清镁水平为(0.96 ± 0.02) mmol/L,麻醉后镁含量升高。140 mg/L组的血清镁含量最高,显著高于对照组和80 mg/L组,但与其余各组间的差异不显著(P>0.05)。

表1 不同浓度MS-222麻醉时西伯利亚鲟血清镁、磷的含量变化Tab.1 Content changes of serum magnesium and phosphorus in Siberian sturgeon under different concentrations of MS-222 anesthesia
2.3 白蛋白含量变化
对照组西伯利亚鲟幼鱼血液白蛋白(ALB)含量为(6.0±1.3) g/L。麻醉后西伯利亚鲟幼鱼血液中ALB的含量降低,各麻醉组ALB值范围为5.0~5.7 g/L(图2)。ALB含量在各实验组间均无显著性差异(P>0.05)。

图2 不同浓度MS-222麻醉时西伯利亚鲟血液白蛋白浓度的变化Fig.2 Content changes of blood ALB in Siberian sturgeon under different concentrations of MS-222 anesthesia
2.4 血脂组成变化
不同浓度MS-222麻醉后血脂测定结果表明,高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)的含量随麻醉浓度的升高均呈先升高后降低的趋势,HDLC和LDLC含量在100 mg/L麻醉组达到最高(表2)。各实验组之间的HDLC与LDLC含量均无显著性差异(P>0.05)。

表2 不同浓度MS-222麻醉时西伯利亚鲟高密度脂蛋白和低密度脂蛋白浓度的变化Tab.2 Content changes of HDLC and LDLC in Siberian sturgeon under different concentrations of MS-222 anesthesia
2.5 总胆红素含量变化
对照组总胆红素(TBIL)含量为(1.2±0.2) μmol/L,各麻醉组TBIL浓度总体上呈现先上升后下降的趋势。
140 mg/L组TBIL浓度为(3.0±1.0) μmol/L,显著高于其他各实验组(P<0.05)。除140 mg/L组外,其他各实验组间均无显著差异(P>0.05)(图3)。

图3 不同浓度MS-222麻醉时西伯利亚鲟血液总胆红素含量的变化Fig.3 Content changes of TBIL in Siberian sturgeon under different concentrations of MS-222 anesthesia
3 讨论
3.1 MS-222麻醉后西伯利亚鲟稚鱼耗氧率的变化特点
鱼类活动都需要利用水体溶氧进行有氧代谢,因此鱼体耗氧率的大小及其变化能够反映鱼体代谢水平的高低及变化规律[13]。麻醉剂首先抑制脑皮质,再作用于基底神经节与小脑,最后作用于脊髓,依次进入感觉丧失期、兴奋期和麻醉期,当剂量过大或者接触时间过长会导致麻醉剂深及髓质,使呼吸与血管舒缩中枢麻痹,最终导致死亡[14]。研究发现中华鲟(Acipensersinensis)幼鱼[14]经不同浓度的MS-222麻醉,以及西伯利亚鲟稚鱼[15]经不同浓度的丁香酚麻醉后,耗氧率均呈先升高后降低的趋势,其原因是低浓度的麻醉剂对鱼体产生胁迫作用,活动能力增强,呼吸频率加快,而后在麻醉剂持续作用下进入麻醉的各个时期,随麻醉程度加深,耗氧率降低。与以上研究不尽相同的是,本研究发现西伯利亚鲟稚鱼经不同浓度MS-222麻醉后,耗氧率显著降低,未发现耗氧率升高的现象。其原因可能是本研究所设置的MS-222浓度较高,因麻醉产生胁迫作用导致呼吸频率加快,耗氧率升高的现象不明显,而高浓度的MS-222使西伯利亚鲟稚鱼深度麻醉,代谢率降低,因此其耗氧率呈下降趋势。
在活鱼运输实践中通过麻醉剂的使用可降低鱼体的耗氧量,增加运输的距离和运输量,控制鱼体的过度活动,有效防止鱼类因激烈活动而造成伤害,从而提高成活率[16]。如庄平等[14]的研究表明16 mg/L MS-222或12 mg/L丁香酚可使体质量为(1.47±0.30) g的中华鲟幼鱼进入深度镇静期,呼吸频率降低,满足活鱼运输的要求。本研究发现,使用MS-222对于降低西伯利亚鲟稚鱼的耗氧率具有显著作用,可以在运输实践中灵活运用,但在质量浓度为10~50 mg/L范围内对耗氧率的影响不显著,因此最适浓度还需通过运输实验进一步确定。
3.2 MS-222麻醉后西伯利亚鲟幼鱼血液生化指标的变化特点
生物体内血液生理指标与鱼体的新陈代谢、营养状况以及疾病有密切关系[17]。血清中 K+、Ca2+、Mg2+和P3+等无机离子在维持鱼类血浆渗透压、酸碱平衡以及保持内环境稳定等方面起着重要作用,当受到外界环境的胁迫之后血液无机离子含量会发生变化[18]。例如胡鑫等[19]发现经CO2麻醉处理后,鲢(Hypophthalmichthysmolitrix)血清中K+水平升高4倍,冯广朋等[15]发现丁香酚麻醉西伯利亚鲟幼鱼后,其血清镁和磷水平升高。本研究结果与之相似,并且发现140 mg/L以上高浓度麻醉组中检测到幼鱼血清中镁和磷含量较高,推测麻醉剂会对鱼体渗透压产生一定影响,高浓度的MS-222使西伯利亚鲟幼鱼血液渗透压升高,不利于维持鱼体内环境的稳定。研究表明,肾脏与镁和磷的代谢有关,当肾脏受损时,鱼体镁和磷代谢水平会出现异常[20-21]。在本研究中,推测随着MS-222浓度的增加,麻醉剂对鱼体肾脏的损害加剧,导致肾脏功能紊乱,镁、磷代谢异常,血清镁和磷滞留,水平升高。因此,MS-222浓度超过140 mg/L时会导致西伯利亚鲟体内渗透压失衡,甚至影响肾脏功能,在使用时应注意浓度不宜过高。
血液中ALB的生理功能主要包括保持胶体渗透压以及对血清钙离子、未结合胆红素、游离脂肪酸及激素等进行运输等[22-23]。本研究发现,西伯利亚鲟幼鱼经MS-222麻醉后,ALB值降低,原因可能是ALB作为营养物质的载体,在应对麻醉胁迫时,消耗量增多,从而为机体提供能量,修补受损组织,并参与维持血浆胶体渗透压平衡,但在稳态调节下,ALB总体水平保持稳定,无显著性差异。这与朱挺兵等[24]发现电麻醉对圆口铜鱼(Coreiusguichenoti)幼鱼血液中ALB影响不显著的结果一致,而冯广朋等[15]研究发现西伯利亚鲟幼鱼被丁香酚麻醉后其血液中ALB浓度先下降而后上升且差异显著。这体现出不同麻醉方式对不同鱼种的影响机制可能存在一定差异,ALB在不同麻醉方式中发挥的生理功能还需进一步探索。
血液中的脂类是机体肝脏细胞代谢所需的原料,主要包括胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白[25]。HDLC和LDLC作为血脂代谢的基础物质,是反映脂类在动物体内的分解、转运及肝脏脂肪代谢的重要指标[26]。冯广朋等[15]研究发现,丁香酚麻醉后西伯利亚鲟幼鱼血液中的HDLC和LDLC水平显著低于麻醉前,降低的原因可能是在麻醉状态下,血脂参与到新陈代谢中,被运输与分解。与该结果不同的是,本研究发现HDLC和LDLC水平随麻醉剂浓度的增加差异不明显,推测MS-222对西伯利亚鲟幼鱼体内脂类代谢影响较小。
TBIL主要由衰老红细胞血红蛋白的辅基血红素降解产生和肝细胞中非血红蛋白的血红素蛋白质的辅基血红素分解产生[27]。血液中TBIL的清除主要依靠肝细胞不断摄取、结合、转化及排泄来完成[28]。冯广朋等[22]对西伯利亚鲟幼鱼进行电麻醉后发现血液中TBIL水平升高,与MS-222对俄罗斯鲟(Acipensergueldenstaedti)[29]和红鳍东方鲀(Takifugurubripes)[30]幼鱼血液指标影响结果相似。本研究发现西伯利亚鲟幼鱼血液TBIL水平在麻醉后呈先升高后降低的趋势,推测麻醉胁迫使鱼类的新陈代谢加快,红细胞衰老加快,导致代谢产物增加,高浓度的深度麻醉状态,抑制代谢耗能的同时抑制了神经中枢,血红素分解减慢,总胆红素水平降低。章龙珍等[31]认为TBIL含量在一定程度上可以反映鱼体肝脏受损的情况。王荻等[32]研究表明,常温下,饲料中添加中药复方玉屏风散剂,会增加肝肾负担,使施氏鲟血清中TBIL显著升高;郑跃平等[33]报道,在肝胆病变的中华鲟幼鱼血液中TBIL的含量高于健康鱼。在本研究中,推测高浓度的MS-222加大了西伯利亚鲟幼鱼肝脏负担,甚至可能造成损伤。
根据MS-222麻醉后西伯利亚鲟幼鱼血液生化指标的变化特点,揭示高浓度的MS-222不利于鱼体维持内环境稳定,甚至可能对肝脏造成一定损伤。80~120 mg/L MS-222对西伯利亚鲟幼鱼血液生化的影响相对较小,在生产实践和科学研究中,可在该范围内合理运用。本研究为MS-222在西伯利亚鲟苗种运输、养殖生产和实验操作中的应用提供了参考依据。
