急性肾损伤模型大鼠血清及尿白蛋白的变化及其相关机制的研究*
2021-07-02王木兰查晨亮左沙沙冯育林杜力军
王木兰,龚 琴,,查晨亮,许 嵩,左沙沙,蒋 亚,冯育林,,杜力军,4,李 俊,**
(1.江西中医药大学药学院 南昌 330006;2.江西中医药大学创新药物与高效节能降耗制药设备国家重点实验室南昌 330006;3.江西中医药大学附属医院 南昌 330006;4.清华大学生命科学学院 北京 100084)
急性肾损伤(acute kidney injury,AKI)可见于多种疾病的进程中[1-6],为临床所常见。在药物研究中急性肾损伤模型血清及尿TP和ALB是观察肾小球滤过及其肾小管吸收功能的重要指标,同时也是评判药物对损伤肾脏相关作用的重要指标。但是从蛋白合成到排泄角度对于这种血清蛋白变化的机制及其与肾损伤之间的关系尚未见有深入研究。
本课题组曾对多种急性肾损伤动物模型肾脏炎症坏死因子及其特点、以及其AKI的机制进行了探讨[7,8]。研究过程中我们发现各模型动物均在出现尿蛋白明显升高的同时,血清ALB却明显降低。己知血清蛋白的生成分泌主要在肝脏,因此AKI这种血清蛋白含量的下降是否与肝脏有关,同时在由于肾损伤影响滤过率进而导致蛋白丢失的病理基础上是否还与其它机制有关,另外常见AKI模型中这种形成血清蛋白下降的机制是否相同等等,对此进行研究,将有助于解释不同原因所致AKI中的血清蛋白变化,以及更准确的评价相关中药。为此,本文就顺铂、RIR和庆大霉素所致的3种AKI模型,对其肝脏ALB生成及影响肾脏相关蛋白滤过的因子进行研究,以期为急性肾损伤中药研究中提供相关作用靶点及其实验依据。
1 材料与方法
1.1 实验动物
SPF级SD雄性大鼠48只,体重180-200 g(用于顺铂和庆大霉素实验);SPF级SD雄性大鼠40只,体重260-280 g,(用于肾动静脉结扎实验,)上述实验动物均购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:【SCXK(湘)2016-0002】。依据应用实验动物的3R原则给予人道的关怀。饲养及无菌手术实验在江西本草天工科技有限责任公司屏障环境实验室完成,使用许可证号:【SYXK(赣)2018-0002】,饲养条件:室温21℃-25℃,相对湿度50%-65%,光暗循环12 h/12 h,自由饮食饮水。本实验研究方案获得江西中医药大学实验动物伦理委员会批准,审查号为:JXLLSC-2018-33,且实验过程严格遵守实验动物福利与伦理委员会相关指南。
1.2 药物与试剂
顺铂(Cisplatin),规格5 mg·mL-1,江苏豪森药业集团有限公司生产,批号:170503,临用前用生理盐水配成1.5 mg·mL-1溶液备用。硫酸庆大霉素(Gentamicin)注射剂,河南润弘制药股份有限公司,批号:1610202,规格40 mg·mL-1。TP、ALB生化试剂盒,购自日本纯药工业株式会社,批号:TR368/DF774。G250染色液(检测匀浆中TP),碧云天,批号:102518190429。ALB试剂盒,南京建成生物工程研究所,批号:20191205。肌酐(Cre),批号:19051012,北京利德曼生化股份有限公司;尿素氮(BUN),批号:AR771/AR772;丙氨酸氨基转移酶(ALT),批号:AR794、TH622;天门冬氨酸氨基转移酶(AST),批号:ER372/ER373,均购自日本纯药工业株式会社。Realtime PCR Super mix,北京全式金生物技术有限公司,批号:N10822。TRIzol,ambion公司,批号:229010。RIPA Lysis Buffer(Strong),CWBIO,批 号:01408/20425;5×蛋白上样缓冲液,Solarbio,批号:20191129。糖原PAS染色试剂盒,LEAGENE,批号:1022A19。
1.3 实验仪器
7100型全自动生化分析仪(日立公司)。TDZ4型台式低速离心机(长沙湘智离心机仪器有限公司)。7500型荧光定量PCR仪(AB公司)。ChemiDoc XRS+凝胶成像分析系统(美国BIO-Rad公司)。5810R型冷冻离心机(Eppendorf公司)。MDF-392型超低温冰箱(日本SONY)。Olympus CKX41光学显微镜(日本Olympus公司)。
1.4 实验方法
1.4.1 分组和造模
三种模型实验均分为对照组、模型组。顺铂模型采用尾静脉注射顺铂5 mg·kg-1,对照组尾静脉注射等体积生理盐水[11]。结扎肾动静脉模型[10],将大鼠麻醉固定,以手术剪剪开腹部皮肤,并打开腹腔,分离右肾肾门,用手术线进行结扎后,分离右肾与肾包膜,切除右肾。用手术线将肾门动静脉打活结结扎,40 min后松开活结以使肾脏血液复灌,取血流复灌通畅,肾脏颜色由暗渐红者为手术成功。缝合腹壁及皮肤,以碘酒消毒手术创口,腹腔注射青霉素以防感染,手术完成后送入笼内观察饲养。对照组为假手术组,其不切除肾和结扎肾动静脉其余程序同模型组大鼠。庆大霉素所致大鼠急性肾损伤实验[9],大鼠腹腔注射硫酸庆大霉素剂量140 mg·kg-1,连续注射7天,对照组腹腔注射等体积生理盐水。实验结束时,大鼠眶上静脉窦取血,室温静置1 h,3500 r/min,离心10 min,取血清,-20℃保存,以备测血清生化。顺铂及庆大霉素模型取左肾脏、肝脏保存至-80℃冰箱冻存,用于表达mRNA及其他指标检测,取右肾10%福尔马林固定,以备观察组织形态学变化;RIR模型肝脏、左肾从中间纵切,一半保存至-80℃冰箱冻存,用于表达mRNA及其他指标检测,另一半10%福尔马林固定,以备观察组织形态学变化。
1.4.2 生化检测指标
①血清相关指标检测:顺铂、结扎肾动静造模5天后,庆大霉素造模7天后,动物异氟烷麻醉,眼眶静脉采血,分离血清,全自动生化分析仪检测血清中BUN,Cre,ALT,AST,TP,ALB。②尿TP,ALB检测:采血前1晚禁食不禁水,并将动物放入代谢笼中,收集过夜尿,量尿量,全自动生化仪检测尿总蛋白(UTP)和尿微量白蛋白(UmALB),最后乘以尿量,得到尿TP和ALB的量。
1.4.3 肝脏组织中TP、ALB检测
①称取约50 mg组织,加入1 mL RIPA裂解,研磨至无组织块,定量取800μL裂解液,加200μL5×蛋白上样缓冲液,混匀,沸水中煮30 min,冷却后,冷冻离心机12000 r/min,离心15 min,取上清,制备蛋白样品。10%聚丙烯酰胺凝胶电泳分离蛋白后,直接进行考马斯亮蓝染色,经过洗脱后,拍照分析,得出各样品的总蛋白灰度值,并除以加入的液体量和所秤肝脏的重量[12]。②称取100 mg组织,用9倍体积的生理盐水制备匀浆,3500 r/min,离心10 min,取上清,按照试剂盒说明书检测匀浆中TP、ALB的含量。
1.4.4 肾组织形态学检查
肾组织经4%甲醛固定后,常规切片,脱蜡后,过碘酸溶液10 min,蒸馏水漂洗4次,Schiff溶液保湿盒中避光30 min,漂洗,苏木精染色3 min,自来水冲洗3 min,盐酸酒精分化5 s,自来水冲洗15 min,逐级脱水,中性树胶封片,显微镜下观察并拍片。
1.4.5 mRNA表达
按照试剂盒操作说明及其相关文献[13]制备mRNA,并进行Real time PCRmRNA表达分析。所用引物均由南京金斯瑞生物公司合成。引物序列参考NCBI GenBank设计,以β-actin作内参。引物序列如下:大鼠,β-ɑctin,sense(正向):5'-CTCTGTGTGGATTGGTGGCT-3',antisense(反向):5'-GCTCAGTAACAGTCCGCCT-3';Cebp-α(CAAT enhancer-binding proteinα),sense:5'-TACCGAGTAGGGGGAGCAAA-3',anti-sense:5'-AAGCAAGGGGCTAAGAACCC-3';Hnf(hepatic nuclear factor),sense:5'-GAGCTGCCAACCAAAAAGGG-3,antisense:5'-CCAGTTGTAGACACGCACCT-3';Nfy(nuclear factor Y),sense:5'-GATCGTTCAGACAGGAGCCA-3',anti-sense:5'-TGGCATTCACATACAACGGC-3;Alb(albumin),sense:5'-GTGAGCGAGAAGGTCACCAA-3',anti-sense:5'-TTTCACCAGCTCAGCGAGAG-3'。
1.4.6 蛋白表达
按照试剂盒操作说明及其相关文献[14]制备蛋白样品,采用Western blot法检测肝脏ALB,肾脏ALB、Nephrin、Podocin蛋白表达水平。所用产品如下:一抗:内参β-actin(TA-09),批号:19C0508,北京中杉金桥;ALB,兔抗多克隆抗体,16475-1-AP,Proteintech,美国;Nephrin,兔抗单克隆抗体,ab216341,Abcam,英国;Podocin,兔抗多克隆抗体,TA351459,ORIGENE,美国。IL-6,ab9324,鼠抗单克隆抗体,Abacm,英国。TNFα,SC-52746,小鼠抗单克隆抗体,SANTA CRUZ BioTECHNOLOGY。二抗:山羊抗小鼠IgG-HRP(ZB2305),批号:140193;山羊抗兔IgGHRP(ZB2301),批号:141987,均购于北京中杉金桥。
1.5 数据分析
所得数据以xˉ±s表示。以SPSS22.0软件或GraphPad8.0软件对数据进行处理。采用单因素方差分析(ANOVA),具有显著性差异后,再进行两两t检验。以P<0.05为统计学意义。
2 实验结果
2.1 血清及尿相关生化指标的变化
与正常组比较,3种急性肾损伤模型血清TP均有下降趋势(P=0.125,0.181,0.105),尿TP显著升高;血清ALB较正常组均有显著降低,尿ALB显著升高,模型组大鼠血清BUN和Cre均明显高于对照组,表明3种模型大鼠均出现不同程度的肾脏损伤(图1)。

图1 三种急性肾损伤大鼠肾功能相关指标及其蛋白的变化
2.2 肾小球及肾小管组织形态学变化
图2可见,正常对照组可见肾小球及肾小管基底膜完整,清晰可见。顺铂模型组可见蛋白管型,肾小管基底膜损伤,管壁细胞坏死。RIR模型组肾小管扩张,基底膜损伤。庆大霉素模型组肾小管可见蛋白管型,肾小管管壁细胞坏死,基底膜损伤。
2.3 肝组织中TP和ALB的变化
已知蛋白主要合成脏器是肝脏,为了观察这种血清中TP和ALB的降低是否与肝脏的合成减少有关,本研究检测了匀浆中TP及ALB量,并采用凝胶电泳及考马斯亮蓝染色(简称考染)且对全部条带灰度扫描积分方法检测肝组织中总蛋白变化。考染结果显示,与正常组比较,顺铂模型总蛋白显著下降;RIR模型显著升高;庆大霉素有升高趋势(P=0.076)(图3A、B)。顺铂组肝脏总蛋白无明显变化,但是ALB表达明显下降;庆大霉素组肝脏总蛋白及ALB表达均明显增加;RIR组无论肝总蛋白还是ALB表达均无明显变化(图3C、D),提示了3种模型对肝脏蛋白及ALB合成的特点及其复杂性。同时各组血清AST,ALT无明显变化(图3E、F),顺铂组ALT有一定升高,但无统计学意义,表明各组大鼠肝功能无明显差异,由此提示这种肝脏ALB的变化与肝细胞损伤无明显关系。

图3 肝脏组织中TP和ALB的变化.
2.4 肝脏中ALB基因转录启动区增强子mRNA表达的变化
为了进一步观察ALB表达变化的机制,我们对肝脏ALB基因转录启动区主要增强子mRNA的表达进行了检测。结果表明,与正常组比,顺铂模型中Alb、Cebp-αmRNA水平显著下调,Hnf显著上调;RIR模型中Alb、NfymRNA水平显著上调,Hnf显著下调;庆大霉素模型AlbmRNA显著升高,Cebp-αmRNA显著降低,HnfmRNA有升高趋势,无显著性差异,提示3种模型的ALB基因转录启动区的增强子都不同程度的出现了变化(图4)。
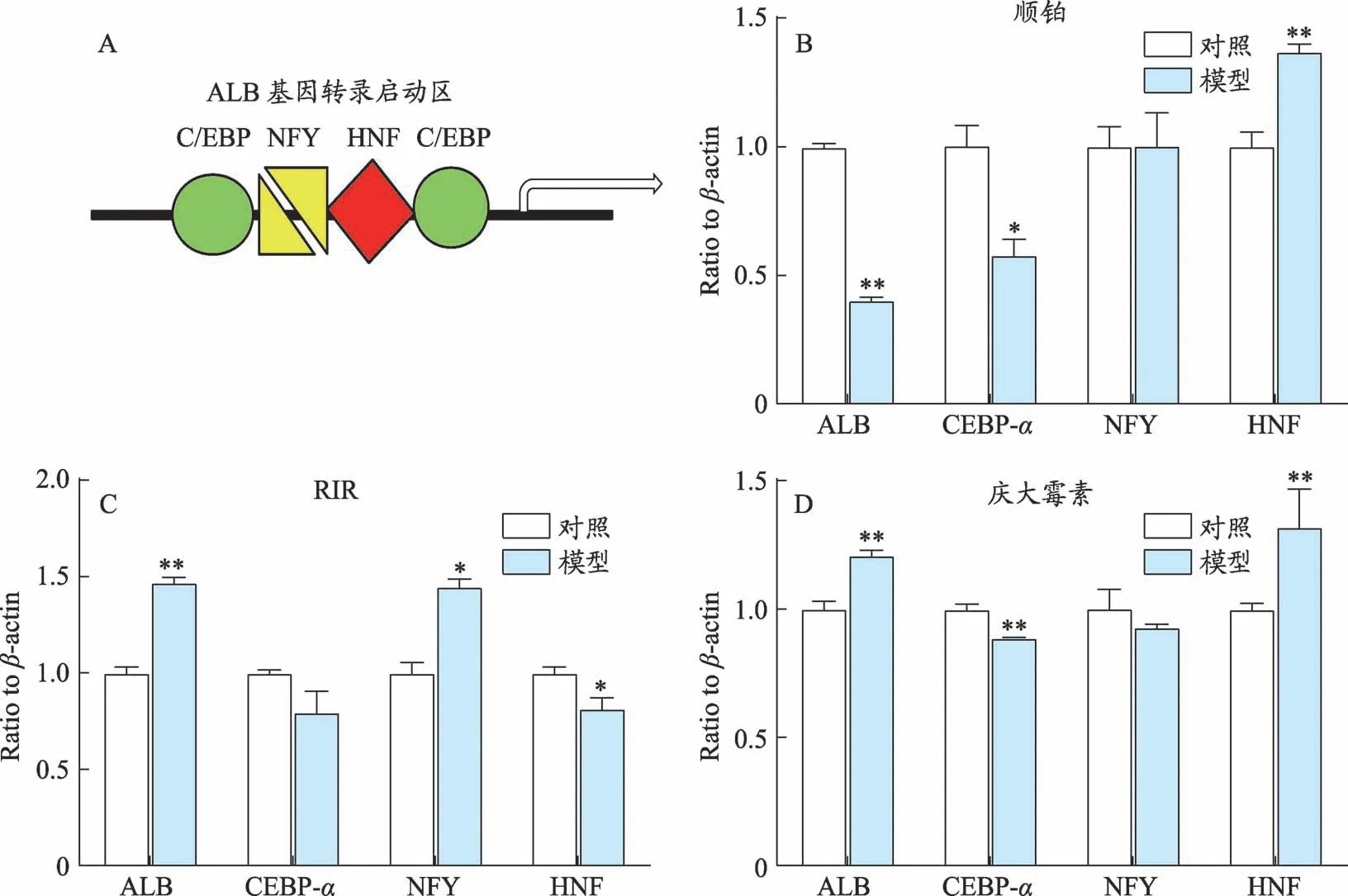
图4 三种急性肾损伤模型肝脏ALB基因转录启动区增强子mRNA表达变化
2.5 肾脏组织中Nephrin、Podocin、ALB及其相关炎性坏死因子蛋白表达的变化
为了观察肾小球基底膜损伤及其与尿蛋白相关性,我们对肾脏足细胞的2个重要蛋白Nephrin和Podocin,肾组织ALB蛋白及其相关炎性因子进行了表达。结果表明3种模型组大鼠肾组织ALB及Nephrin蛋白表达均有显著上调;顺铂及RIR组的Podocin表达明显下降,庆大霉素组无明显变化。同时各组炎性相关因子TNFα和IL-6均明显上调,提示肾组织中存在着炎性及其肾小球足细胞损伤的潜在病变(图5)。

图5 三种急性肾损伤模型肾组织中Nephrin、Podocin、ALB及其相关炎性坏死因子蛋白表达的变化
3 讨论
我们在前期对白头翁皂苷B4(B4)抗急性肾损伤作用的研究中发现,急性肾损伤及其损伤过程中ALB岀现明显变化,且不同的造模方法对血清ALB、尿ALB及蛋白尿也不完全一致,为了更好的认识不同造模方法对ALB生成及其排泄以及其在药物评价模型中的意义,我们进行了顺铂[15]、庆大霉素[16]、急性肾缺血再灌[10]等急性肾损伤模型ALB表达及其排泄以及可能的机制的研究。鉴于蛋白尿是肾功能损伤的重要病理指标,对此进行深入研究,对于相关新药研究具有重要的意义。本文的工作对评价B4治疗急性肾损伤作用及其对于ALB蛋白尿的作用奠定了病理生理基础。
通常除肝病外,多数疾病白蛋白合成一般不会受到明显影响[17]。但是我们发现,3种急性肾损伤均表现出血清ALB显著下降,尿TP、ALB显著升高。这种血清ALB下降降低了血浆渗透压,是导致组织水肿的主要原因。同时这种血清ALB下降与肾损伤有关,但是对于ALB生成有无影响,对此进行考察将有助于全面深入认识相关病理变化。己知ALB生成主要在肝脏,为此我们主要对肝脏相关ALB表达,以及ALB基因转录进行了观察。肝脏组织考染结果表明顺铂模型TP显著下降,而另两种模型TP升高,匀浆结果中,顺铂模型TP结果与考染结果不一致,RIR和庆大霉素TP变化趋势一致,3种模型组织匀浆中ALB变化不明显。进一步对肝脏组织中ALB的mRNA和蛋白表达水平进行检测,发现顺铂模型大鼠肝脏ALB的mRNA和蛋白水平均下调,表明顺铂模型肝脏ALB合成减少,提示这其中存在着顺铂对mRNA生成到蛋白翻译修饰的损伤过程。因此,在ALB的合成上,顺铂模型与另两种模型存在一定的差异性。对于肝功测试结果表明,3种造模方法对于ALB影响的同时,对于肝脏功能并没有明显影响,表明这种对ALB表达的影响是专属性的,与肝脏功能无关。值得注意的是,肾损伤同时RIR组和庆大霉素组肝脏AlbmRNA均明显升高,提示Alb基因转录均明显启动,但是其蛋白表达则不完全一致,庆大霉素组Alb基因与蛋白表达均明显上调,表现出较好的一致性,但是这种蛋白的升高并没有改变血清ALB下降的结果,提示尿蛋白的逸漏远远超过了肝脏的ALB合成分泌。RIR组ALB蛋白表达则升高不明显,其原因有待于进一步探讨。
ALB基因转录启动区存在多个增强子序列,它们的存在与增强ALB基因表达相关[18,19]。为了更深入探讨3种造模方法对肝脏ALB表达的影响,我们对这些增强子相关基因表达的变化进行了观察。结果表明三种模型组大鼠肝脏ALB表达变化不一。其中顺铂模型ALB mRNA明显降低,有报道[15]顺铂的肾毒性机制主要与损伤DNA有关,本研究亦表明这种抑制ALB表达的原因与其抑制ALB基因转录启动区的增强子CEBP-α表达、从而抑制ALB基因表达相关;另一方面尽管增强子Hnf有显著升高,但ALB最终是表达下调,提示顺铂可能阻碍了HNF蛋白与增强子序列结合,具体尚有待于进一步深入研究。RIR和庆大霉素组大鼠肝脏ALBmRNA表达均明显升高,但是对增强子作用不完全一致:RIR组主要表现为NFY表达升高,庆大霉素组则主要为HNF表达升高。由此可见3种模型组对于Alb基因启动区增强子作用的不一致性,表现出其作用的复杂性,这些均有待于进一步研究。总之,顺铂对血清ALB降低影响较重,不但通过肾损伤加速ALB排泄,同时还通过抑制肝脏ALB生成加重降低血清ALB。RIR和庆大霉素虽然能在一定程度上促进肝脏合成ALB,但是由于其肾损伤促进ALB排泄,而使血清ALB下低。因此在顺铂模型的药物研究中,不仅要观察肾损伤变化,还要观察肝脏ALB生成变化。RIR和庆大霉素模型的药物研究中,则重在防治肾损伤方面。
Nephrin和Podocin是构成肾小球过滤膜最后一道屏障的足细胞裂隙膜上重要的蛋白[20,21]。本实验结果显示,3种模型大鼠肾Nephrin表达明显升高,顺铂组与RIR组Podocin表达明显降低,提示存在肾小球足细胞胞损伤。近年来的研究表明大量ALB局部聚集(例如肾脏)可通过激活NFκB引发炎症造成损伤[22-24],炎性因子可以刺激Nephrin表达上调[25],本研究也显示在Nephrin异常升高的同时,IL-6和TNFα表达也明显升高,表明其与肾损伤有关。在肾ALB表达结果中,3种模型ALB表达均明显升高。有报道AKI时肾皮质ALB mRNA表达明显升高[26],提示这种升高为损伤应激所致。我们的结果所显示的ALB蛋白表达一方面预示着肾损伤的潜在机制,另一方面也与尿蛋白升高有潜在关系,这一复杂机制有待探讨。
本工作首次系统观察了3种常用的急性肾损伤造模方法及其造模过程中的相关ALB生成及其排泄的变化特点,以及相关成因。并首次从ALB基因转录区相关增强子水平对其作用于ALB进行了较为深入的探讨。其中顺铂抑制肝脏ALB合成,同时损伤肾小球基底膜,形成蛋白尿是其主要特点。而急性肾缺血再灌损伤和庆大霉素所致急性肾损伤则是促进肝脏ALB合成的同时,肾小球损伤,形成蛋白尿。三种模型肾损伤过程中Nephrin的高表达提示其损伤靶点的可能性及其潜在药物的作用靶点。由于ALB不仅具有维持血浆渗透压、营养机体等生理功能,而且又是蛋白尿的主要组成蛋白,同时肾脏过高的ALB还可以引起肾脏炎性因子表达,进而加重肾损伤。因此,在急性肾损伤时,监测血和尿ALB具有重要的病理意义,同时也是药物研究中的重要指标。同时提示我们在新药研究中需要针对具体造模方法区别对待。
