兔VX2骨肿瘤微环境中IL-4和CD34表达关系
2021-07-01李哲宏吕家兴甘新天白磊鹏曹海营
李哲宏,吕家兴,甘新天,白磊鹏,曹海营,金 宇*
(1.承德医学院研究生院,河北承德 067000; 2.承德医学院附属医院创伤骨科)
白细胞介素4(interleukin 4,IL-4)主要是由激活的Th2细胞、肥大细胞和噬碱性粒细胞分泌的细胞因子构成,对多种细胞的生长、分化和功能产生广泛的作用[1]。IL-4具有抑制细胞免疫、增强体液免疫、促进特异性以及非特异性免疫的杀伤功能,该细胞因子及其受体已被证实在调节免疫系统以促进肿瘤生长方面发挥重要作用[2,3]。CD34分子是高度糖基化的I型跨膜糖蛋白,选择性地表达于人类及其他哺乳动物造血干祖细胞表面,并随细胞的成熟逐渐减少至消失[4]。目前,越来越多的研究表明,CD34与肿瘤的增殖密切相关,CD34是新生血管内皮细胞最敏感的标记物,检测CD34的表达可反映肿瘤组织微血管密度情况,从而定量地反映肿瘤微血管增生情况,其表达水平一定程度上反映肿瘤细胞的增殖水平[5]。VX2细胞是由Shope病毒感染形成的兔乳头状瘤,经过72次移植传代,建立的稳定肿瘤细胞系。VX2细胞是上皮组织恶性肿瘤,可接种于多个部位建立原位肿瘤动物模型,具有生长迅速、肿瘤局部侵袭快,远期转移早等特点[6]。在兔VX2骨肿瘤模型建模早期,VX2细胞可以破坏骨组织微环境,使肿瘤发生局部浸润与远处转移[7,8]。因此,本实验采用VX2肿瘤建立兔胫骨骨肿瘤模型,利用Elisa法检测术前及植瘤后7d、14d胫骨骨髓内CD34和IL-4变化与表达水平的关系,探究在肿瘤增殖移过程中,兔VX2骨肿瘤模型髓内的免疫功能及肿瘤增殖水平的变化。
1 材料和方法
1.1 实验动物与细胞
日本大耳白兔(简称家兔)30只,3个月龄,体重2.0~2.5 kg,雄性,购自北京市昌扬西山养殖场[动物许可证号:SCXK(京)2016-0007],饲养于承德医学院附属医院动物房。本研究经承德医学院附属医院动物伦理委员会审核批准(审批号:LL047)。VX2肿瘤细胞株(购自重庆蒙博生物科技有限公司),于本实验室液氮保存。
1.2 实验试剂与仪器
兔子IL-4酶联免疫分析试剂盒、兔子CD34酶联免疫分析试剂盒(购自河北瑞帕特生物科技有限公司)、由承德医学院附属医院金宇团队自主设计的通道内置式骨肿瘤穿刺装置(专利号:ZL201416055578.0)。
1.3 肿瘤组织的制备
从液氮中取出冻存的VX2瘤株进行复苏,调整细胞浓度至5×107/ml,将制备好的0.5ml肿瘤细胞悬液接种于一只家兔左大腿肌肉处,制成传代荷瘤兔。2~3周后,待瘤体增大至约2cm×2cm×3cm时,经耳缘静脉注射3%戊巴比妥钠(1ml/kg)麻醉。严格无菌条件下,外科手术分离皮下组织、完整剥离肿瘤。将肿瘤完整取出后移至无菌工作台上,置于37℃的PBS中清洗3遍,去除肿瘤中血迹、坏死组织和纤维组织,使用眼科剪将肿瘤剪成1mm×1mm×1mm大小的组织块备用。
1.4 骨肿瘤模型的制作
30只日本大耳白兔按随机数法分成实验组、对照组,每组各15只。两组家兔均术前6h禁食水,经左耳缘静脉注射3%戊巴比妥钠(1ml/kg)麻醉。左后肢备皮仰卧位固定于操作台上,遵守外科无菌操作原则。选取膝关节内侧皮肤作一1cm长切口,逐层切开皮下组织和筋膜,暴露髌韧带,纵行钝性分离髌韧带,显露胫骨平台,在胫骨平台面用1mm克氏针钻孔,抽取1ml骨髓留存。实验组家兔用顶棒将体积为1mm3的VX2肿瘤组织块沿套管推入胫骨髓腔内,拔出套管,骨蜡封堵骨孔,无水乙醇擦拭骨孔周围,两侧髌韧带缝合重建后,逐层缝合切口,模型制作完成,术后每只实验兔连续3d予青霉素80万单位/d,肌肉注射,每日1次,以预防感染。对照组家兔在胫骨平台使用1mm克氏针钻孔,抽取1ml骨髓流程,骨蜡封堵,但不植入VX2肿瘤组织。
1.5 标本的采集
建模后第7天,对每只家兔均使用通道内置式骨肿瘤封闭活检装置进行活检,将穿刺针放入型号适合的通道套管内,在左侧胫近端穿入,取病理部位,注射器抽取1ml骨髓留存后,将通道套管留在穿刺部位,由通道尾侧安装尾帽,并将通道旋入固定于骨孔,从而达到封闭穿刺入路的目的植入内置穿刺通道。建模第14天,打开封闭通道再次取样后,耳缘静脉栓塞处死全部家兔,取胫骨组织行组织病理学检查。
1.6 组织HE染色
胫骨骨质、骨髓组织,行固定、包埋、切片、苏木精-伊红染色(HE染色),镜下观察VX2骨肿瘤在骨髓组织中7d(附图A),14d(附图B)的表现和对照组家兔骨髓组织的表现(附图C)。
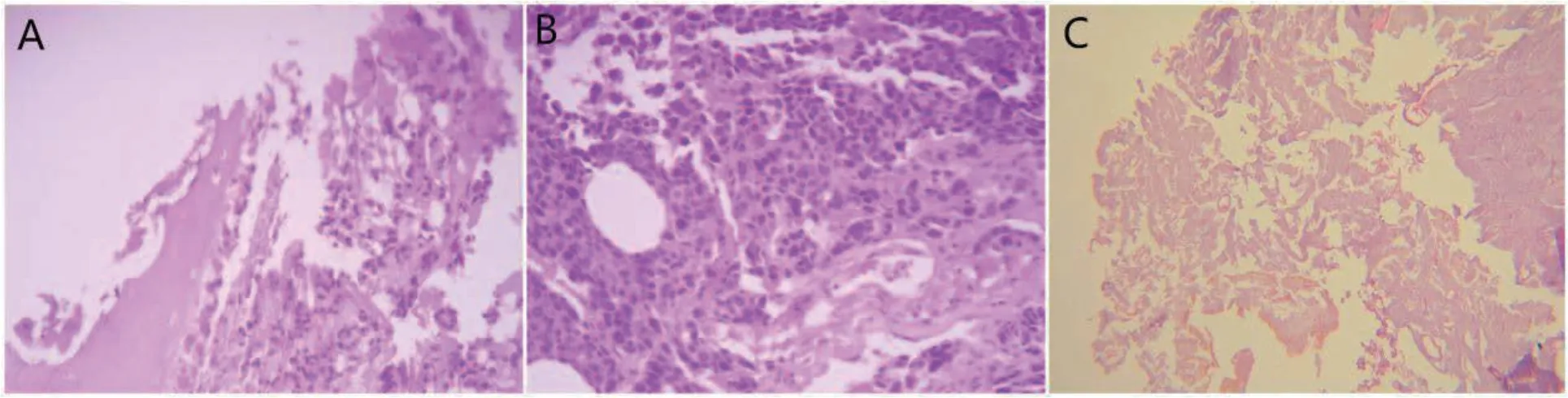
附图 兔骨髓组织HE染色
1.7 ELISA实验
将采集的标本每0.5ml分装留存于含枸橼酸钠抗凝剂的真空采血管中,于无菌操作台上移入离心管,采用4000r/min离心5min,收集上清液,一份采用双抗夹心酶联免疫吸附法(Elisa)测试上清液中的IL-4、CD34含量,测试过程严格按照试剂盒说明书步骤进行,另一份留存备用。
2 统计学方法
应用SPSS 25.0软件对数据进行统计分析,所有数据均以均数±标准差()表示,组间比较采用独立样本t检验,组内比较采用方差分析。显著性差异水平设定为P<0.05。
3 实验结果
3.1 病理检查结果
实验组植瘤第7天穿刺活检组织,可见VX2肿瘤细胞呈圆形或不规则形,核分裂象多见,为核大深染的肿瘤细胞和炎性细胞,植瘤第14天发现肿瘤细胞紧密排列呈巢状,纤维间隔少,细胞异型性大。对照组兔骨髓组织病理检查结果显示正常骨髓组织。
3.2 ELISA检测结果
实验组兔髓内IL-4、CD34含量与建模前相比均明显升高,差异有统计学意义(P<0.05),见表1、表2:
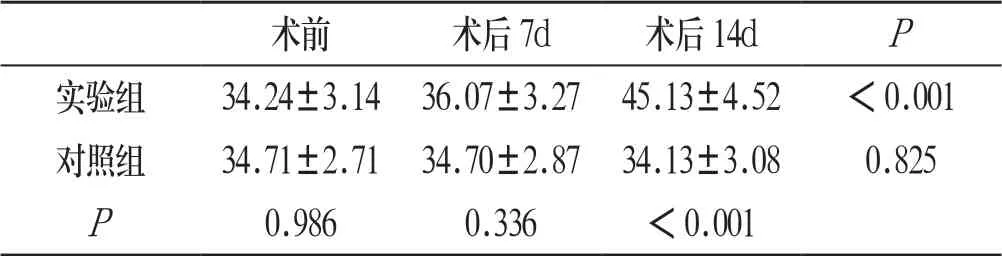
表1 两组荷瘤兔骨髓IL-4水平比较(ng/L)
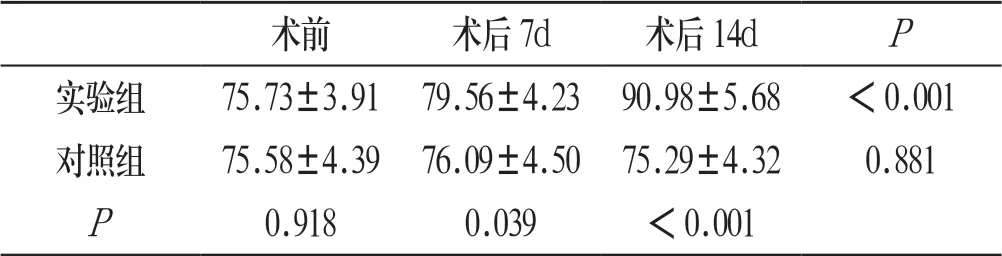
表2 两组荷瘤兔骨髓CD34水平比较(ng/L)
4 讨论
肿瘤的浸润与转移受到多基因多蛋白的影响,是一个复杂的生物学过程,如何早期发现与早期抑制肿瘤转移是肿瘤研究工作的困境之一[9]。骨与软组织肉瘤是一种罕见的间充质细胞起源的肿瘤,约占所有成人恶性肿瘤的1%[10],于早期就发生局部浸润以及远处转移[11]。目前,手术干预一直是骨和软组织肉瘤治疗的主要手段,同时辅以放射治疗以达到局部控制。虽然细胞毒性化疗使得骨与软组织肉瘤的治疗方式产生了革命性的优化,但是经典的治疗方案产生的副作用仍无法避免,且其疗效预后也无法得到明显的改善,其最主要的原因同骨与软组织肉瘤浸润密切相关[12,13]。因此,使用精准骨肿瘤动物模型可以更进一步了解骨肿瘤的发生发展方式和其对骨组织微环境的影响,对临床研究具有重要意义。本研究经胫骨移植VX2肿瘤组织块建立兔胫骨骨肿瘤模型,观察到在肿瘤的生长过程中,肿瘤的增殖导致了骨组织微环境的改变。
IL-4是Th2细胞分泌的最典型的细胞因子,一定程度反映了Th2细胞的表达水平,在肿瘤生物学中对各种髓系来源群体起到了良好的调节作用[1,14]。IL-4分化的肿瘤相关巨噬细胞显著增加肿瘤细胞的迁移和侵袭能力,有相关研究发现,肿瘤细胞上IL-4受体的过表达可以为肿瘤治疗提供靶点[2,15]。实验显示,建立VX2兔骨肿瘤模型后,IL-4肿瘤增殖标记物在植瘤后14d内表达水平不断增高。IL-4增高的原因可能是,随着肿瘤细胞的增殖和分化,VX2瘤细胞产生大量IL-4,而IL-4可诱导巨噬细胞的M2型极化,促进癌细胞生长,最终改变骨组织微环境。CD34分子为高度糖基化的I型跨膜糖蛋白,分子量在105~120kD[16],选择性地表达于人类造血干祖细胞、间质前体细胞、上皮细胞以及多种肿瘤细胞表面,并随细胞的成熟逐渐源弱至消失[4]。CD34分子反映肿瘤的恶性程度,其高表达可促进肿瘤的转移[17]。在实验过程中,发现CD34肿瘤增殖标记物在植瘤后表达水平不断增高,其原因可能与肿瘤增殖生长有着密切的关系。CD34与肿瘤组织微血管密度的情况有关,其在VX2肿瘤组织上高表达,而正常成熟的骨髓组织中低表达或者不表达的特点,可反映肿瘤的增殖程度。
本实验采用的通道内置式骨肿瘤组织取出装置是根据承德医学院附属医院金宇团队自主设计的穿刺活检器械及密封栓取出装置的一种改良装置,避免活检过程中肿瘤组织与正常组织接触的同时,在活检结束后通过尾帽封堵穿刺孔,防止肿瘤细胞扩散,内置通道和封堵尾帽可长期留置体内,是一种有效的物理封堵技术[18]。
本研究显示,通过检测并观察骨髓组织中IL-4与CD34水平的变化,可以了解骨组织微环境的状态,以预测骨肿瘤的生长、转移程度,评价骨肿瘤的恶性程度。同时,对自主设计的通道内置式骨肿瘤取出装置的应用性评价进行了动物测试,是一种有效的物理封堵技术。
