查尔酮类似物清除DPPH自由基和保护H2O2诱导的PC12细胞损伤的抗氧化活性
2021-07-01黄丽丽陈婵婵汪佳兵张佳枫吴建章
黄丽丽,陈婵婵,汪佳兵,张佳枫,吴建章
1.宁波市医疗中心李惠利医院 药剂科,浙江 宁波 315040;2.温州医科大学 药学院 化学生物学研究中心,浙江 温州 325035;3.台州市立医院 台州学院附属市立医院 药剂科,浙江 台州 318000
氧化应激与心血管疾病、脑缺血、癌症和衰老等多种病理过程密切相关,过量产生的自由基在这些病理生理过程中起着至关重要的作用[1-4]。自由基的持续产生和脂质过氧化促使细胞形成了强大而复杂的抗氧化防御系统,可清除已存在的活性氧所引发的连锁反应。同时,体外抗氧化剂的补充也极为重要[5]。查尔酮类似物属于黄酮类化合物[6],广泛存在于水果蔬菜和天然药物中,具有抗氧化、抗炎和抗肿瘤等多种生物学活性[7]。近年来的研究表明合成的查尔酮类似物一般也具有天然查尔酮高效低毒的优点。但目前有关抗氧化活性查尔酮类化合物的报道主要是天然查尔酮,鲜少有抗氧化活性的合成查尔酮类似物的研究报道。
研究表明具有多羟基的抗氧化剂具有较好的生物活性[8]。本研究通过羟醛缩合反应,合成一系列含羟基或不含羟基的查尔酮类似物,检测其对H2O2诱导的PC12细胞凋亡的保护作用,为得到高效低毒的抗氧化候选药物奠定基础。
1 材料和方法
1.1 材料 H2O2(上海国药化工公司),DMSO(广州四佳生物科技公司),DPPH和槲皮素(上海国药集团化学试剂有限公司),大鼠肾上腺髓质嗜铬瘤分化(PC12)细胞(中国科学院生物化学与细胞生物学研究所),DMEM高糖培养基(美国Gibco公司),胎牛血清(FBS,美国HyClone公司),Bcl-2抗体(3498,1:300)、Bax抗体(5023S,1:1 000)、cleavedcaspase-3抗体(9664,1:1 000) 和山羊抗兔IgG二抗(7074,1:3 000)均购自美国CST公司;GAPDH抗体(sc-47724,1:1 000,美国Santa Cruz公司);MDA酶联免疫试剂盒和Hoechst染色试剂盒(上海碧云天生物技术研究所),MTT和其他化学品(美国Sigma公司)。所用试剂均为分析纯。薄层和柱层析用硅胶均为青岛海洋化工厂产品。
1.2 方法
1.2.1 查尔酮类似物的合成:以不同取代苯乙酮和芳醛为原料,通过羟醛缩合反应合成了16个查尔酮类似物。在极性溶剂中,以HCl为催化剂,室温下合成了含羟基的查尔酮;在5~8 ℃的NaOH条件下合成了不含羟基的查尔酮。反应结束时,得到沉淀物或向混合物中加水沉淀产物。纯化后化合物产率为20%~95%。其结构经质谱(ESI-MS)和核磁共振氢谱(1H-NMR)确证。
1.2.2 DPPH自由基清除实验:DPPH粉末用无水乙醇溶解,配置成母液(7.5×104μmol/L)于4 ℃下避光保存,使用前用无水乙醇稀释到150 μmol/L。 将化合物用DMSO溶解,配置成初始浓度为1.0× 104mg/L,于4 ℃下避光保存,使用前用无水乙醇稀释到20 mg/L。在96孔板上将80 μL(20 mg/L)的化合物加入120 μL的DPPH(150 μmol/L)乙醇溶液中(记为样品组A)。对照组B为80 μL(20 mg/L)化合物与120 μL乙醇混合,空白组C为80 μL乙醇与120 μL(150 μmol/L)DPPH溶液混合。混匀混合物,于室温下放置30 min后,在酶标仪于517 nm波长处测定其吸光度(OD)。根据下列公式将OD值换算为DPPH自由基清除率:DPPH清除率(%)=[1-(A样品- B对照)/C空白]×100。每个化合物每次测定3个复孔,实验重复3次。IC50值为清除50% DPPH自由基的化合物浓度。
1.2.3 细胞存活率检测:将PC12以3 000个/孔接种于96孔板,在37 ℃含5% CO2的培养箱中过夜。每孔加入不同的查尔酮类似物孵育1 h,再给予H2O2(600 μmol/L)刺激一定时间,最后加入MTT(5 mg/mL) 20 μL放入培养箱中继续培养4 h。将完整细胞中形成的蓝紫色结晶甲臜溶解于DMSO中,用酶联免疫检测仪于490 nm处测其OD值。细胞生存率(%)= (OD处理组/OD对照组)×100%。DMSO组的生存率为100%。设置对照组(DMSO组)、模型组(H2O2组)和给药组,其中槲皮素组为阳性对照组。实验设置3个复孔,重复3次。
1.2.4 化合物细胞毒性检测:将PC12以3 000个/孔 接种于96孔板,贴壁后每孔加入查尔酮类似物孵育24 h,MTT法测定OD值。4 h后溶解于DMSO中,在 490 nm处测其OD值。生存率(%)=(OD处理组/OD对照组)× 100%。实验设置3个复孔,重复3次。
1.2.5 脂质过氧化检测:将PC12细胞接种于6孔板中,培养24 h。设置对照组、模型组、给药组。给药组中加入药物孵育24 h,对照组则在同一时间加入同等体积的DMSO溶液,以排除溶剂DMSO的影响。之后在给药组和模型组中给予H2O2刺激24 h。用预冷的裂解液裂解细胞后收集,测定蛋白浓度,按照MDA检测试剂盒说明书进行MDA水平的测定。
1.2.6 Hoechst染色:将PC12细胞(3×104个/孔) 接种于6孔板后在培养箱培养过夜,用化合物13(1或5 μmol/L)和槲皮素(5 μmol/L) 预处理1 h,再用H2O2(600 μmol/L)刺激24 h,然后用固定液固定15 min,PBS洗涤2次。加入荧光染料Hoechst 33258染色5 min。用PBS洗涤2次后,在荧光显微镜下观察。
1.2.7 Western blot:PC12细胞接种于6孔板,细胞贴壁后加入不同浓度的化合物13和槲皮素孵育24 h,再用H2O2(600 μmol/L)刺激24 h;然后用PBS洗涤3次,用预冷的裂解液裂解细胞后收集, 12 000×g离心10 min。用BCA蛋白分析试剂盒对上清液进行蛋白质定量。蛋白质用12% SDS-PAGE分离,然后转移到PVDF膜上。用脱脂牛奶封闭2 h,然后与抗体cleaved-caspase-3(1:1 000)、Bcl-2(1:300)、Bax(1:1 000)或GAPDH(1:1 000)在4 ℃下孵育过夜。用TBST洗涤3次后,在室温下用HRP标记的二抗(1:3 000)孵育1 h。最后用Image J软件检测靶蛋白。
1.3 统计学处理方法 应用统计学软件Graphpad prism 5进行作图和数据分析。计量资料用表示,多组间比较采用单因方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 查尔酮类似物的合成 采用HCl或NaOH作为催化剂,在乙醇或甲醇等极性溶剂中通过羟醛缩合反应,合成16个查尔酮类似物(见图1和表1)。通过重结晶或柱层析纯化,通过TLC检测和熔点测定来检验纯度,通过ESI-MS和1H-NMR进行构像表征。

表1 查尔酮类似物的结构

图1 查尔酮类似物的合成路线
化合物1、2、3、4、5、6、7、8、9、10、11和16的化学信息可在文献[9-16]中获得。其中,化合物12、13、14和15是新型的查尔酮类似物,其1H-NMR和ESI-MS数据如下:
(E)-3-(2-氯苯基)-1-(3,5-二氟苯基)丙-2-烯-1-酮(12):白色粉末,产率35.22%,mp 91.2~94.5 ℃。1H-NMR(CDCl3)δ:8.132(d,J=15.6 Hz,1H,H-β),7.733(d,J=9.6 Hz,1H,H-6),7.5~7.531 (m,2H,H-2’,H-6’),7.490(d,J=15.6 Hz,1H,H-α),7.431(d,J=9 Hz,1H,H-3),7.307(m,1H,H-5),7.302(m,1H,H-4),7.028(tt,J=2.4 Hz,8.4 Hz,H-4’)。ESI-MS m/z:279.0(M+H)+,calcd for C15H9ClF2O:278.03。
(E)-1-(3,5-二氟苯基)-3-(3,4-二羟苯基)丙-2-烯-1-酮(13):黄色粉末,产率46.57%,mp 240.2 ℃ Decompose。1H-NMR(Acetone-d6)δ:7.729~7.764(m,3H,H-β,H-2’,H-6’),7.672(d,J=15.6 Hz,1H,H-α),7.379(d,J=1.8 Hz,1H,H-2),7.305(tt,J=2.4 Hz,8.4 Hz,1H,H-4’),7.251(dd,J=1.8 Hz,7.8 Hz,1H,H-6),6.912(d,J=7.8 Hz,1H,H-5)。ESI-MS m/z:277.1(M+H)+,calcd for C15H10F2O3:276.23。
(E)-3-(3,4-二氟苯基)-1-(3,5-二氟苯基)丙-2-烯-1-酮(14):白色粉末,产率37.24%,mp 178.4~187.0 ℃。1H-NMR(CDCl3)δ:7.694(d,J=15.6 Hz,1H,H-β),7.456(d,J=15.6 Hz,1H,H-α),6.833~6.820(dd,J=1.8 Hz,7.8 Hz,2H,H-2’,H-6’),6.601~6.565(tt,J=2.4 Hz,8.4 Hz,1H,H-4’),7.468(d,J=8.4 Hz,1H,H-6),7.354(brs,1H,H-2),7.183~7.227(m,1H,H-5)。ESI-MS m/z:281.1(M+H)+,calcd for C15H8F4O:280.05。
(E)-1-(3,5-二氟苯基)-3-(3,4,5-三甲氧基苯基)丙-2-烯-1-酮(15):白色粉末,产率64.53%,mp 194.7~195.8 ℃。1H-NMR(Acetone-d6)δ:7.264(d,J=15.6 Hz,1H,H-β),7.038(d,J=15.6 Hz, 1H,H-α),6.858(tt,J=2.4 Hz,5.4 Hz,1H,H-4’),6.768(m,2H,H-2’,H-6’),6.280(d,J= 5.4 Hz,2H,H-2,H-6),3.738(s,3H,4-OCH3),3.611(m,6H,3-OCH3,5-OCH3)。ESI-MS m/z:335.2(M+H)+, calcd for C18H16F2O4:334.31。
2.2 查尔酮类似物体外抗氧化活性 采用DPPH自由基清除实验测定查尔酮类似物的抗氧化活性。在前期研究中发现,苯环上含有3,4-二羟基取代的化合物6、8和10均表现出较好的DPPH自由基清除活性(≥90%),而只有一个羟基取代的化合物(化合物3)或没有羟基取代的化合物(化合物7和11)则表现出较低的DPPH自由基清除活性[9]。在此研究的查尔酮类似物(1、2、4、5、9、12、13、14、15和16)的DPPH清除实验中,也发现具有3,4-二羟基的查尔酮类似物2和13具有优异的DPPH清除活性,IC50分别为4.59±0.24和11.11±0.19。见图2。

图2 查尔酮类似物(20 mg/L)的DPPH自由基清除活性
2.3 查尔酮类似物对H2O2诱导的PC12细胞的保护作用 采用MTT法检测了16个查尔酮类似物对H2O2诱导的PC12细胞的保护作用。经查阅文献和前期工作基础,选择10 μmol/L浓度进行活性和毒性研究。其中DMSO为空白对照,槲皮素为阳性对照。相对于DMSO组,H2O2组细胞生存率降至60.38%(P<0.05),而3,4-二羟基查尔酮(化合物2、4、6、8、10和13)预处理后,细胞存活率均在75%以上,其中化合物13的活性最强,见图3A。再通过MTT法检测活性化合物对PC12细胞的毒性,相对于DMSO组,6个活性化合物作用24 h后,对PC12细胞的增殖均无抑制作用。因此,这6个活性查尔酮类似物对PC12细胞均不表现毒性,见图3B。

图3 细胞活力分析
2.4 活性化合物13呈剂量依赖性地抑制H2O2诱导的PC12细胞脂质过氧化和细胞凋亡 综合上述实验结果,优选出高效低毒的化合物13进行下一步的研究。细胞生存率实验显示,与DMSO组相比,H2O2组细胞生存率降低明显(P<0.05);化合物13在1~10 μmol/L的浓度范围内明显提高H2O2诱导的PC12细胞生存率(P<0.05),且呈剂量依赖性(见图4A)。脂质过氧化是生物体内氧中毒的重要标志[17]。与DMSO组相比,H2O2处理PC12细胞后MDA水平明显升高(P<0.05);与H2O2组相比,化合物13(5或 10 μmol/L)预处理1 h后,均明显抑制MDA的产生 (P<0.05),见图4B。通过Hoechst染色检测了化合物13对H2O2诱导的细胞凋亡的保护作用。与H2O2组相比,13(1或5 μmol/L)预处理PC12细胞1 h后H2O2刺激24 h,明显改善PC12细胞核皱缩的现象。见图5。

图4 化合物13对H2O2诱导PC12细胞损伤的保护作用
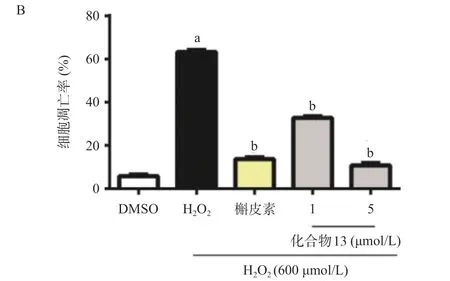
图5 化合物13抑制H2O2诱导的PC12细胞凋亡
2.5 化合物13对cleaved-caspase-3、Bcl-2和Bax蛋白的调节作用 化合物13预处理PC12细胞1 h后,再用H2O2刺激24 h,随后检测细胞内cleavedcaspase-3、Bcl-2和Bax蛋白表达水平。与DMSO组比,H2O2组cleaved-caspase-3蛋白和Bax蛋白表达显著增加(P<0.05),Bcl-2蛋白表达显著下降(P<0.05)。与H2O2组比,化合物13(5和10 μmol/L)处理后均显著抑制cleaved-caspase-3蛋白和Bax蛋白表达 (P<0.05),化合物13在10 μmol/L浓度下促进Bcl-2蛋白表达(P<0.05),见图6。

图6 化合物13对H2O2诱导的PC12细胞cleaved-caspase-3、Bcl-2和Bax蛋白表达的影响

3 讨论
各种刺激诱导ROS的过量产生会导致氧化应激发生,继而破坏细胞的正常功能,降低多种酶的活性,造成脂质、蛋白质和DNA等的损伤,最终诱导细胞凋亡[18]。研究人员致力于抗氧化药物,如萝卜硫醚、二硫杂硫酮和依达拉奉等的研究[19-21]。依达拉奉是一种有效的自由基清除剂,被批准用于治疗急性卒中患者[21]。为发掘高效低毒的抗氧化候选化合物,本研究合成了一系列查尔酮类似物,并研究其清除DPPH自由基活性和保护H2O2诱导PC12细胞损伤的抗氧化活性。
DPPH是一种具有单一稳定电子的自由基,可接受氢自由基或另一个电子。当有自由基清除剂时,接受氢自由基后,DPPH在517 nm处的吸光度消失。而查尔酮类似物可提供这些氢自由基。研究发现,查尔酮类似物苯环上的羟基越多,DPPH自由基清除活性越好。在含有二羟基的查尔酮类似物中,3,4-二羟基查尔酮类似物具有更强的抗氧化活性。这表明化合物的抗氧化活性不仅取决于羟基的数量,跟羟基的相对位置也密切相关。相比于化合物1和6,羟基的邻位二取代方式似乎更有利于抗氧化活性,这可能是由于一个羟基的氢原子与另一个羟基的氧原子容易形成分子内氢键,分子内氢键的存在使脱氢后的自由基更加稳定。
H2O2已被广泛用于诱导氧化应激损伤[4],本研究采用H2O2诱导的PC12细胞损伤模型研究查尔酮类似物的细胞保护作用。相比于对照组,损伤组细胞生存率仅为60.38%,表明细胞对H2O2的刺激较为敏感。其中,6个3,4-二羟基查尔酮(化合物2、4、6、8、10和13)均表现出较好的细胞保护作用,且不表现细胞毒性。但它们之间也存在一定的药效差异,其抗氧化能力13>10>8>4>2>6,其中活性较好的化合物10和13的b环上均含有卤素原子,表明b环上的吸电子基团增强化合物的抗氧化活性。
优选出高效低毒的化合物13进行进一步的研究发现化合物13呈剂量依赖性地提高H2O2诱导的PC12细胞的生存率,降低MDA水平。Hoechst染色分析发现化合物13有效抑制H2O2诱导的细胞凋亡。Bcl-2家族主要由抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax)组成,它们相互作用调节细胞凋亡[22]。Caspase-3是细胞凋亡的关键酶,也是细胞凋亡的特异性执行者,cleaved-caspase-3是caspase-3的激活型[23-24]。实验结果表明损伤组的cleaved-caspase-3和Bax蛋白表达上升,Bcl-2蛋白表达下降;而化合物13能减弱cleaved-caspase-3和Bax蛋白表达量的上升和Bcl-2的下降,也表明13能有效改善H2O2诱导的PC12细胞凋亡。PC12细胞是一种研究神经系统功能的理想模型,研究13在PC12细胞中的保护作用,可能为其在缺血性卒中或神经退行性疾病中的潜在治疗作用提供直接证据。
本研究合成了16个查尔酮类似物,其中化合物12、13、14和15为新型的查尔酮类似物,并对其抗氧化活性进行研究。其中,筛选得到的高效低毒3,4-二羟基查尔酮类似物13不仅具有较强的清除DPPH自由基的能力,而且对H2O2诱导的PC12细胞凋亡具有较好保护作用。
