40例新生儿B族链球菌败血症临床特征及药物敏感性分析
2021-07-01蔡扬帆陈吉如郭继忠林霓阳
蔡扬帆,陈吉如,郭继忠,林霓阳
(汕头大学医学院第一附属医院新生儿科,广东 汕头 515041)
B族链球菌(group B Streptococcus,GBS)是一种兼性厌氧革兰氏阳性球菌,常定植于育龄期妇女泌尿生殖道和胃肠道。GBS是引起围产期感染新生儿败血症、肺炎、脑膜炎的重要致病菌[1-2]。新生儿GBS感染是引起新生儿死亡及遗留神经系统后遗症如脑瘫、脑积水、智力低下及癫痫等的重要原因[3-4]。美国实施妊娠期GBS筛查和产时抗生素预防后早发型GBS感染有所下降,但对晚发型GBS感染的影响不大[5]。目前我国尚未全面普及妊娠期GBS筛查和产时抗菌药物预防。近年来我国GBS感染呈上升趋势,GBS已逐渐成为新生儿早发型败血症的主要病原菌之一。但对GBS感染的认识相对不足,尤其是早期识别及明确病原体之前经验性使用抗生素的选择,且不同地区及不同时间发病的GBS感染在血清型及药敏情况存在差异。因此,本研究回顾性分析早发型与晚发型GBS感染的临床表现及药敏情况,为临床及时识别GBS感染,进行有效的治疗提供参考。
1 资料与方法
1.1 研究对象
选取2010年1月—2020年12月在汕头大学医学院第一附属医院诊断为新生儿GBS败血症的40例患儿作为研究对象。新生儿GBS败血症诊断标准[6-7]:(1)具有新生儿败血症的临床表现如反应差、呼吸困难、腹胀、面色苍白、体温不升或发热、嗜睡、抽搐等;(2)血培养病原菌为GBS。纳入标准:(1)符合新生儿GBS败血症诊断标准;(2)生后28 d内发生感染者。排除标准:(1)合并其他感染、先天性免疫缺陷病、先天性遗传代谢病、其他脏器严重疾病等患儿;(2)仅为GBS菌血症的患儿。根据发病时间将40例患儿分为早发型组(生后<7 d,29例)和晚发型组(生后≥7 d,11例)。
1.2 研究方法
采用回顾性病例分析。收集患儿性别、胎龄、围产期影响因素、出生体质量、生产方式、出生情况、发病时间、转归、主要临床表现、实验室检查结果及药敏试验结果等资料。药敏试验使用梅里埃VITEK 2 Compact全自动细菌鉴定及药敏分析系统,药敏试验结果的判读按照美国临床和实验室标准协会(CLSI)制定的指南,金黄色葡萄球菌ATCC29213为质控菌株。
1.3 统计学分析
使用Stata 15.0统计软件进行数据分析,符合正态分布的计量资料用±s表示,组间比较采用t检验;非正态分布的计量资料以中位数和四分位数间距[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
早发型患儿发病时间为4.5(0,24)h,胎龄(38.00±1.93)周,体质量(2.93±0.53)kg,住院时间(22.69±16.45)d。晚发型患儿发病时间为16(11,26)d,胎龄(37.97±2.69)周,体质量(2.82±0.50)kg,住院时间(25.82±15.42)d。晚发型患儿的母乳喂养及混合喂养率与早发型患儿相比均较高(P<0.05),其他资料差异均没有统计学意义(P>0.05)。见表1。
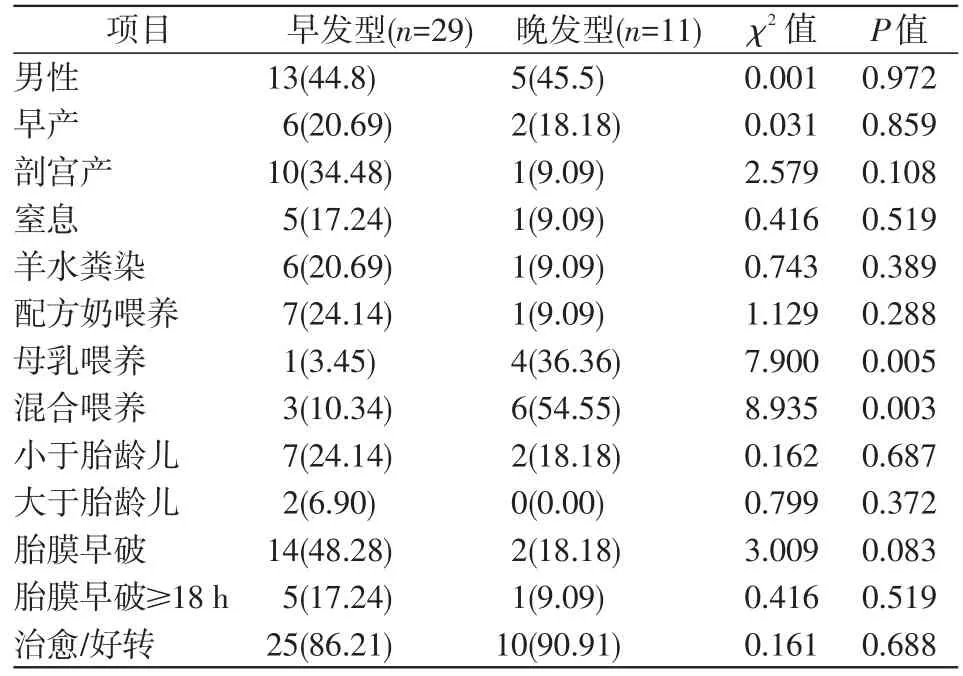
表1 2组患儿一般资料比较 [例(%)]
2.2 临床表现
早发型患儿弥散性血管内凝血、呼吸衰竭、呼吸道感染、颅内出血发生率高于晚发型患儿,差异均具有统计学意义(P<0.05)。而晚发型患儿发热、颅内感染发生率高于早发型患儿,差异均具有统计学意义(P<0.05)。见表2。
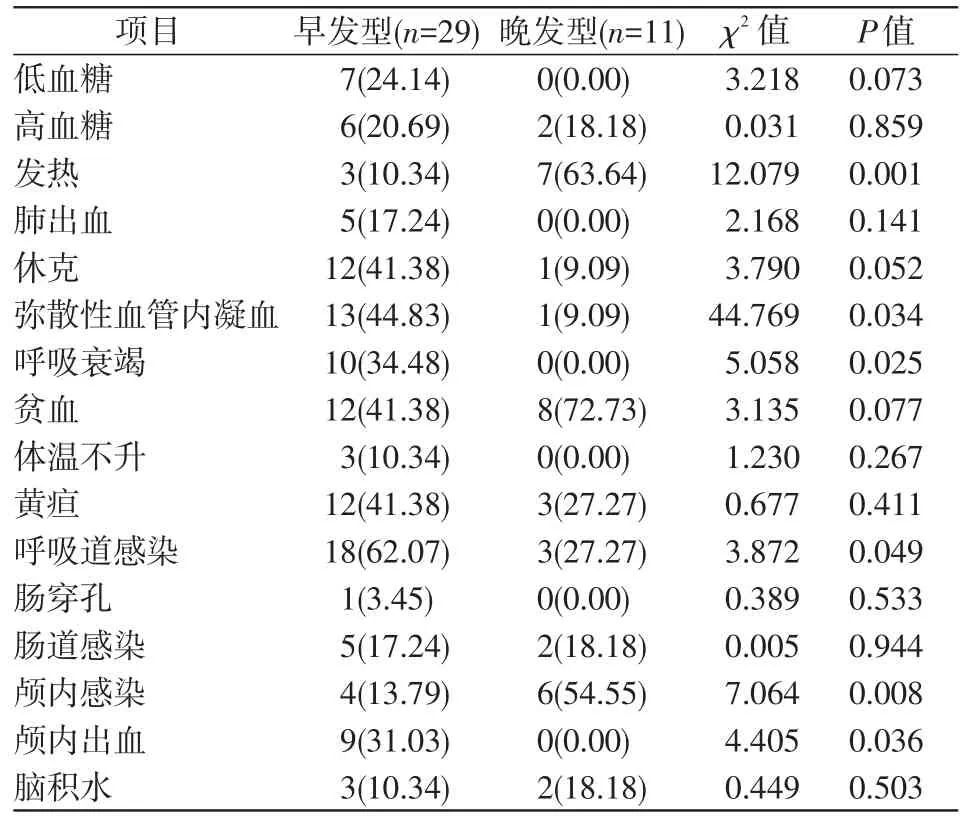
表2 2组患儿临床表现比较 [例(%)]
2.3 实验室检查
早发型GBS败血症患儿低钙血症、肌酐升高及肌酸激酶同工酶升高占比均高于晚发型患儿,差异均具有统计学意义(P<0.05)。见表3。
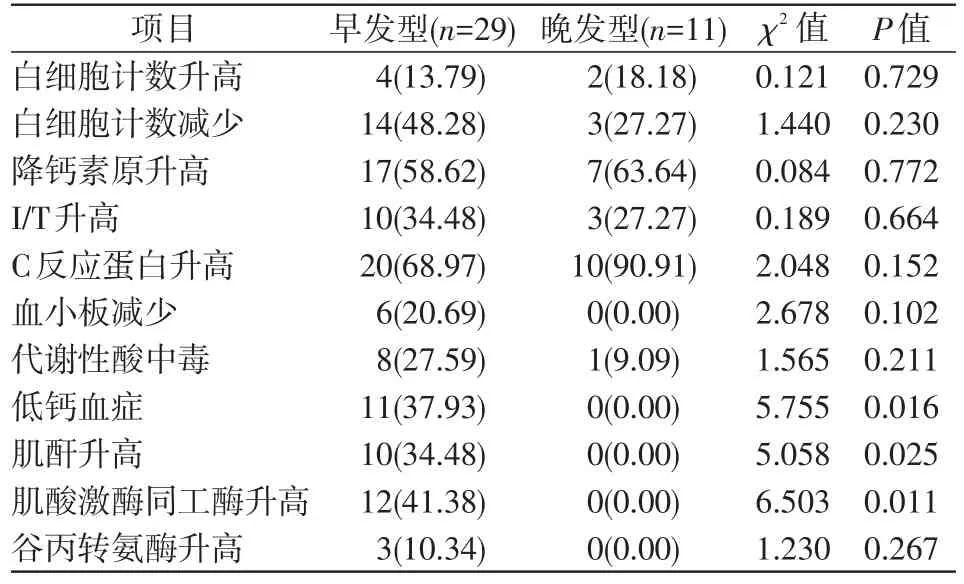
表3 2组患儿实验室检查结果比较 [例(%)]
2.4 药敏试验
药敏试验结果显示,GBS对阿奇霉素、克林霉素、四环素、米诺环素的耐药性高,而对青霉素、万古霉素、阿莫西林、利奈唑胺、替加环素、环丙沙星的敏感性高。见表4。
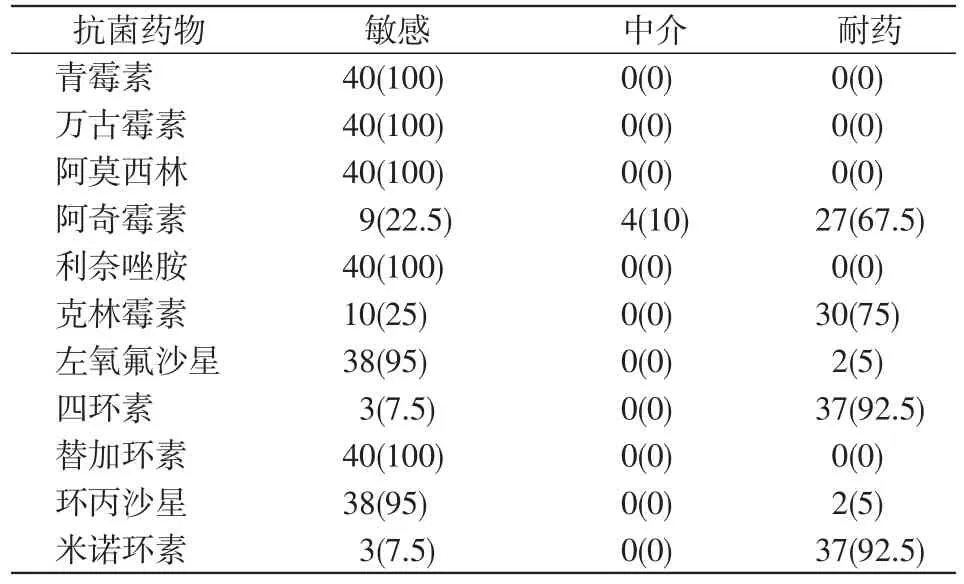
表4 B族链球菌药敏试验结果 [株(%),n=40]
3 讨论
新生儿早发型GBS感染于生后7 d内发病,晚发型则于生后7~28 d发病,二者的临床特征等存在差异。本研究显示晚发型患儿具有较高的母乳喂养率,已有报道母乳喂养引起GBS复发性感染,需注意GBS在新生儿皮肤黏膜、母亲乳腺导管定植的可能性及生后水平传播[8-9]。本研究中,早发型患儿弥散性血管内凝血、呼吸衰竭、呼吸道感染、颅内出血发生率高于晚发型患儿,而晚发型患儿发热、颅内感染发生率高于早发型患儿,可能与不同血清型GBS感染相关。GBS根据荚膜多糖抗原成分不同,分为10种血清型[10],不同血清型GBS的毒力、临床致病情况、耐药谱等均不同。Ⅰa、Ⅰb、Ⅱ、Ⅲ、Ⅳ和Ⅴ型等6种血清型是全球流行的主要血清型(占85%以上),但在不同地区中不同血清型所占比例不同[11-12]。其中Ⅰ、Ⅲ、Ⅴ型具有毒力强,黏附力强,对绒毛膜、血管内皮组织及新生儿肺的侵袭力强的特点,这3种血清型GBS导致的新生儿感染多见[13]。与晚发型脑膜炎密切相关的血清型Ⅲ型具有一种称为高毒力GBS黏附素的表面锚定蛋白,其表达会促进GBS对肠道上皮细胞和血脑屏障的黏附[14]。早发型GBS感染患儿往往以肺部症状为首发表现,病情进展快,一旦未及时诊治,易出现急性呼吸窘迫、弥散性血管内凝血,甚至休克、死亡。本研究发现,早发型患儿胎膜早破、小于胎龄儿、羊水粪染等发生率均较高,提示重视相关的高危因素,对于识别早发型GBS感染至关重要[15-16]。晚发型患儿母亲是否存在GBS感染或定植依然是临床诊断重要的考虑因素。然而,母亲预防性使用抗生素并不能降低婴儿发生感染的风险。晚发型患儿的识别主要基于其临床表现,大约65%的患儿主要表现为菌血症,25%~30%患儿表现为发热、抽搐等脑膜炎表现[17],如不及时诊治可能出现脑积水、脑室管膜炎、硬膜下脓肿等并发症及严重神经系统后遗症。
本研究表明,无论是早发型还是晚发型新生儿GBS血症,均存在血象的变化(如白细胞降低或增高、血小板降低),炎症指标的异常(如降钙素原、心、肝或肾功能的异常),水、电解质酸碱失衡(低钙血症、代谢性酸中毒等)。本研究中1例患儿GBS感染后即表现为严重的应激性高血糖,经抗感染及胰岛素治疗后血糖才恢复正常。
药敏试验结果显示,GBS对青霉素、万古霉素、阿莫西林、利奈唑胺、替加环素的敏感性高。对四环素、克林霉素及阿奇霉素的耐药性较高,与相关文献[18]报道一致。结合新生儿生理特点、药物对生长发育的影响,推荐首选青霉素作为新生儿GBS感染经验性治疗[19]。由于血培养阳性率不高,故临床上针对病原体未明的败血症,建议联合使用抗菌谱覆盖GBS的抗生素。
综上所述,根据不同发病时间分型的新生儿GBS败血症的临床特征不同。早发型GBS败血症主要表现为呼吸道症状,晚发型感染则表现为颅内感染多见。临床医师应加强关注具有高危感染因素的新生儿,一旦怀疑感染,尽早完善实验室非特异性检查、血培养及脑脊液检查,使用青霉素等敏感性高抗生素,积极给予对症支持治疗,提高新生儿GBS败血症治愈率,改善预后。
