环氧合酶-2在小鼠心肌缺血再灌注损伤中表达的时效及其作用
2021-07-01刘燕飞李海燕石刚刚
刘燕飞,李海燕,石刚刚
(汕头大学医学院药理学教研室,广东 汕头 515041)
缺血性心脏病是全球主要死亡原因之一。冠状动脉阻塞导致心肌缺氧和营养物质缺乏,直接造成心肌细胞死亡[1],通过手术干预可以重建血管恢复血流,即再灌注可以降低心肌壁坏死的程度,同时也会诱发比再灌注前更为严重的心肌损伤,被称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)。MIRI的病理机制复杂,常见的有钙超载、炎症[2]、活性氧的积累[3]、代谢紊乱以及能量障碍等。环氧合酶(cyclooxygenase,COX)是合成前列腺素的限速酶[4]。它有COX-1和COX-2两种同工酶。COX-1是结构酶,在大多数组织中呈组成型表达,维持细胞、组织和器官生理功能的稳定;COX-2是诱导酶,可以快速应答促炎介质、细胞因子、内毒素和脂多糖等的刺激,是触发炎症反应的关键环节。目前,COX-2在MIRI中扮演的角色存在争议。有研究发现在大鼠心脏缺血40 min再灌注24 h模型中,使用COX-2抑制剂塞来昔布治疗可以减少心肌梗死面积[5]。在离体研究中发现H9c2和大鼠原代心肌细胞缺氧再复氧前预孵COX-2抑制剂NS-398,可显著减轻缺氧再复氧诱导的心肌细胞损伤和凋亡[6]。在小鼠心脏缺血30 min再灌注24 h模型中,使用COX-2抑制剂NS-398治疗对心肌梗死面积无明显影响[7]。而且有关COX-2在小鼠MIRI中表达的时效尚未有文献报道。因此,本研究在小鼠整体水平结扎心脏冠状动脉左前降支建立MIRI模型,研究COX-2在MIRI中的表达时效,在此基础上通过COX-2基因敲除小鼠研究COX-2在MIRI中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 野生型C57BL/6JNifdc小鼠,SPF级,8~10周龄,雄性,购自北京维通利华实验动物技术有限公司。使用此小鼠研究COX-2在MIRI中表达的时效。COX-2基因敲除小鼠由天津医科大学余鹰教授惠赠,在汕头大学医学院实验动物中心SPF级环境中饲养繁殖。后经基因鉴定出野生型小鼠及COX-2基因敲除小鼠用以研究COX-2在MIRI中的作用。本研究经汕头大学医学院实验动物伦理委员会审查批准。
1.1.2 主要试剂 COX-2抗体(美国CST公司);β-Tubulin抗体(北京中杉金桥生物技术有限公司);HRP1标记山羊抗鼠IgG、HRP标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);2×Taq酶(美国Sigma公司);COX-2基因引物(华大基因公司)。
1.1.3 主要仪器 ALC-V8S小动物呼吸机(上海奥尔科特生物科技有限公司);小型台式高速冷冻离心机(德国Eppendorf公司);垂直电泳仪、PCR仪(美国Bio-Rad公司);全自动乳化分散仪(上海净信实业发展有限公司);Vevo®LAZR小动物多模成像系统(美国FujiFilm VisualSonics公司);全自动血液生化分析仪(日本东芝公司)。
1.2 方法
1.2.1 小鼠基因型鉴定 取COX-2敲基因小鼠一小块耳组织置于1.5 mL EP管底部,加入100 μL 25 mmol/L NaOH溶液(含2 mmol/L EDTA),100 ℃沸水浴30 min后加入100 μL 40 mmol/L Tris-HCl(pH 8.0),振荡30 s以上,3 000 r/min离心10 s,取1.5 μL上清加至以下PCR反应体系:野生、敲除、杂合型COX-2基因引物各0.25 μL,2×Taq酶12.5 μL,H2O 10.25 μL,共计25 μL。PCR条件:94 ℃ 5 min;94 ℃ 4 s,56 ℃ 45 s,72 ℃ 45 s,35个循环;72℃7 min。取10 μL上样,用1.5%的琼脂糖胶进行DNA凝胶电泳。
1.2.2 小鼠MIRI模型的建立 小鼠称重,按每10 g体重0.1 mL的比例腹腔注射1%戊巴比妥钠。小鼠麻醉后,左胸前部脱毛,固定于手术台上,气管插管连接呼吸机,连接肢体导联心电图,剪开小鼠的皮肤、肌肉组织,在第3、4肋骨之间钝性分离,撕开心包膜暴露出心脏。在小鼠心脏冠状动脉左前降支穿线,垫入聚乙烯软管后进行结扎造成心脏缺血,以心电图ST段抬高,心尖部发白为缺血成功标志。取掉软管,剪开结扎线,以ST段下降为再灌注成功标志。模型(Model)组小鼠按上述方法缺血1 h再灌注4 h建立MIRI模型,假手术(Sham)组小鼠只穿线不结扎。
1.2.3 实验动物分组 时效研究分组:假手术组(Sham组)、缺血15 min组、缺血30 min组、缺血45 min组、缺血60 min组;Sham组、缺血1 h再灌注1 h组、缺血1 h再灌注2 h组、缺血1 h再灌注3 h组、缺血1 h再灌注4 h组、缺血1 h再灌注5 h组、缺血1 h再灌注6 h组。因果研究分组:野生型小鼠假手术组(WT Sham组)、COX-2基因敲除小鼠假手术组(KO Sham组)、野生型小鼠缺血1 h再灌注4 h组(WT Model组)、COX-2基因敲除小鼠缺血1 h再灌注4 h组(KO Model组)。
1.2.4 心肌总蛋白的提取 取小鼠心脏结扎线以下部分用生理盐水洗去多余的血液,用滤纸吸干后称重,置于1.5 mL EP管中,按100 mg心肌组织加1 mL裂解液的比例加入现配的RIPA裂解液(V裂解液∶VPMSF=50∶1),把心脏组织剪碎,乳化分散仪研磨组织至无明显组织块,冰上静置30 min,每隔10 min振荡1次,然后13 000 r/min 4℃离心15 min,取上清210 μL于另一1.5 mL EP管中,取10 μL上清稀释50倍后用BCA法测蛋白浓度,剩余200 μL上清中加入5×蛋白上样缓冲液50 μL,沸水中煮5 min,室温冷却后-30℃保存备用。
1.2.5 Western blot检测COX-2蛋白表达 计算50 μg的蛋白量上样体积,将变性后的蛋白样品进行SDS聚丙烯酰胺凝胶电泳,先50 V恒压至样品过浓缩胶,然后将电压调至100 V跑分离胶约80 min,用湿转法将凝胶上的蛋白转移到硝酸纤维素膜上,丽春红染色观察蛋白条带,切出目的条带及内参条带,用5%的牛奶封闭1 h,4℃过夜孵育COX-2一抗(1∶1 000稀释)。第2天条带先用TBST缓冲液洗3次,每次10 min,然后室温孵育二抗1.5 h,条带用TBST缓冲液洗3次,每次10 min。把条带放入暗盒,滴加发光液反应2 min,在暗房用X胶片压片,然后显影、定影。ImageJ图像分析软件分析蛋白条带的光密度。
1.2.6 小动物多模成像系统检测小鼠心功能 用异氟烷气体麻醉系统快速麻醉小鼠,把小鼠固定于操作板上,用脱毛膏将小鼠左胸前部毛发脱除干净,涂抹上适量的耦合剂,超声探头置于耦合剂上,调整探头位置使探头横切心脏长轴,分别保存M-Mode和B-Mode模式图像,用Vevo LAB 3.0.0软件分析实验结果。
1.2.7 小鼠血清心肌酶中肌酸激酶的检测 取小鼠血液约0.5 mL于1.5 mL EP管中,静置0.5 h,然后3 000 r/min 4℃离心10 min,取上清10 μL用生理盐水稀释64倍,取100 μL稀释后的样品于全自动血液生化分析仪检测肌酸激酶活性。
1.3 统计学方法
应用GraphPad Prism 5软件进行分析,正态分布的计量资料以±s表示,组间比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 COX-2在小鼠MIRI中表达的时效研究
2.1.1 心肌缺血时COX-2表达情况 随着缺血时间的延长,COX-2的表达逐渐升高,在缺血60 min时表达最高,与Sham组相比,差异有统计学意义(P<0.05)。见图1。
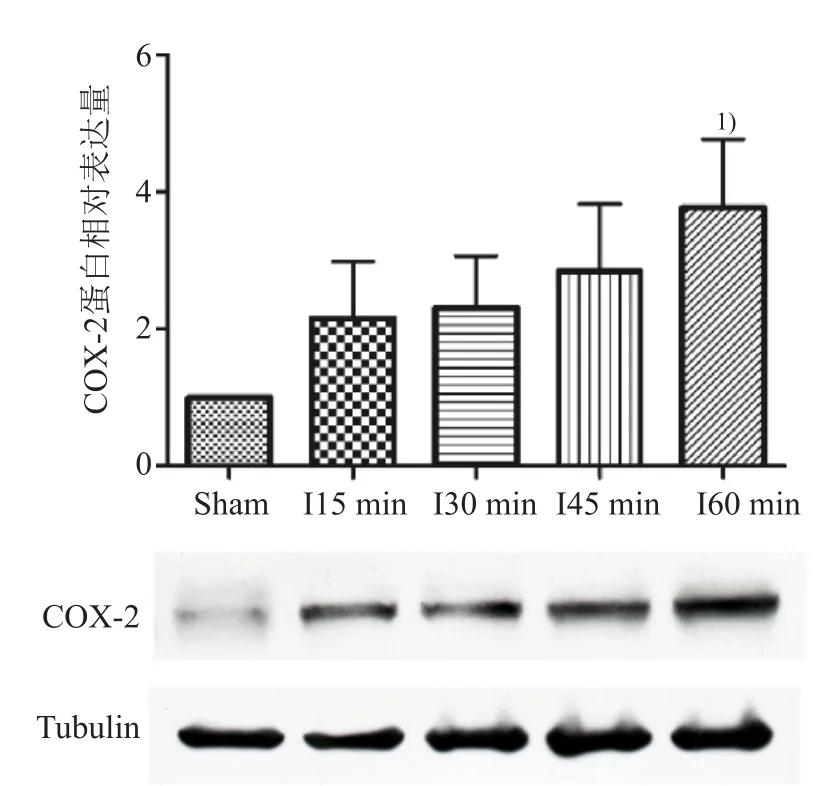
图1 小鼠心肌缺血期间COX-2的表达
2.1.2 心肌缺血再灌注时COX-2表达情况 心肌缺血1 h后随着再灌注时间的延长,COX-2的表达先逐渐升高,再灌注4 h达高峰后趋于稳定,与Sham组相比,差异有统计学意义(P<0.05)。见图2。
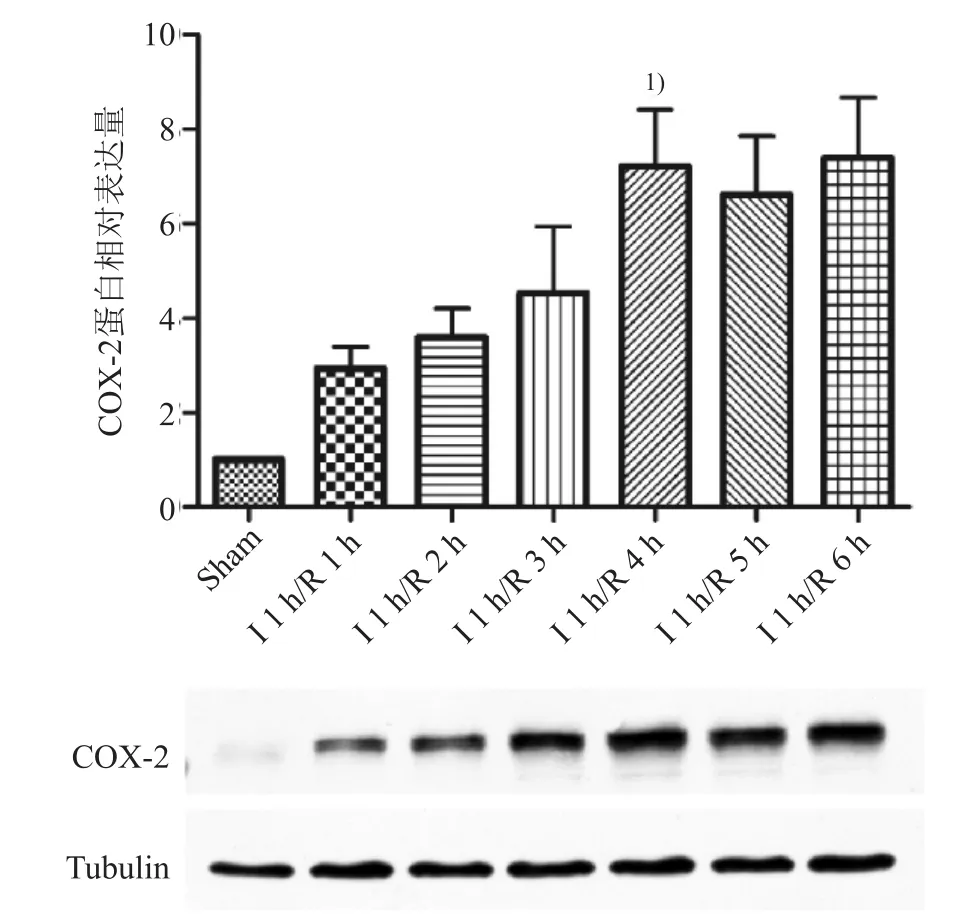
图2 小鼠心肌缺血再灌注期间COX-2的表达
2.2 小鼠基因型鉴定
正常表达的COX-2基因完整DNA序列为800 bp,删除400 bp后造成基因突变,不表达COX-2基因。根据DNA凝胶电泳结果(图3),野生型小鼠仅有800 bp DNA条带,COX-2基因敲除小鼠仅有400 bp DNA条带。杂合子小鼠既有800 bp又有400 bp DNA条带,鉴定后予以剔除,不用于后续实验。

图3 DNA凝胶电泳结果
2.3 COX-2与MIRI的因果关系研究
2.3.1 COX-2基因敲除对MIRI的影响 WT Sham组和KO Sham组左室射血分数、短轴缩短率、左室舒张末期内径和左室舒张末期容积比较,差异均无统计学意义(P>0.05)。与WT Sham组相比,WT Model组左室射血分数和短轴缩短率明显降低,左室舒张末期内径和左室舒张末期容积明显升高,差异均有统计学意义(P<0.05);与WT Model组相比,KO Model组左室射血分数和短轴缩短率明显升高,左室舒张末期内径和左室舒张末期容积明显降低,差异有统计学意义(P<0.05)。见图4。

图4 COX-2基因敲除对缺血再灌注所致的小鼠心功能损伤的影响
2.3.2 COX-2基因敲除对缺血再灌注所致的肌酸激酶漏出的影响 WT Sham组和KO Sham组肌酸激酶活性比较,差异无统计学意义(P>0.05)。与WT Sham组相比,WT Model组肌酸激酶活性明显升高,差异有统计学意义(P<0.05);与WT Model组相比,KO Model组肌酸激酶活性明显降低,差异有统计学意义(P<0.05)。见图5。

图5 COX-2基因敲除对缺血再灌注所致的肌酸激酶漏出的影响
3 讨论
COX-2是诱导酶,在正常组织中表达较低,在不同的刺激下被强烈诱导[8]。越来越多的证据表明,COX-2在心肌缺血时高表达,提示COX-2的诱导可能参与缺血性心脏病[9]。有研究发现在MIRI动物模型中,缺血预处理后COX-2的表达对心脏具有保护作用[10-11]。但也有不少研究发现,COX-2表达的增强在心肌损伤的发展中起着有害的作用。在大鼠[5,12-13]、兔[14]和狗[15]等实验动物模型中,使用COX-2特异性抑制剂治疗可显著改善心功能,减少心肌梗死面积。
本研究发现正常情况下COX-2在小鼠心肌组织中低表达,心肌缺血后COX-2的表达逐渐升高,固定缺血时间为1 h,随着再灌注时间的延长,COX-2表达逐渐升高,于4 h达高峰后趋于稳定,表明虽然COX-2在心肌缺血时开始被诱导高表达,但再灌注对COX-2高表达的诱导更加明显。在此基础上观察野生型小鼠和COX-2基因敲除小鼠的心功能,正常情况下两种小鼠的左室射血分数、短轴缩短率、左室内径、左室容积和肌酸激酶基础值差异均无统计学意义,表明COX-2基因敲除后不影响小鼠正常心功能和肌酸激酶的漏出;在心肌缺血1 h再灌注4 h后,野生型小鼠左室射血分数和短轴缩短率明显降低,左室内径、左室容积和肌酸激酶漏出明显升高,与野生型模型组小鼠相比,COX-2基因敲除小鼠左室射血分数和短轴缩短率升高,左室内径、左室容积和肌酸激酶漏出明显降低,表明COX-2是造成小鼠MIRI的主要原因之一。
综上所述,随着小鼠心肌缺血或再灌注时间的延长,COX-2蛋白的表达呈时间依赖性地升高,COX-2的高表达是造成MIRI的重要原因,也是干预MIRI的潜在靶标。
