鹅星状病毒衣壳纤突蛋白VP27多克隆抗体的制备和鉴定
2021-06-30吕炫张淼胡增金李佳明张冲朱英奇魏娟文吴琼张瑞辰夏伦志王桂军
吕炫 张淼 胡增金 李佳明 张冲 朱英奇 魏娟文 吴琼 张瑞辰 夏伦志 王桂军


摘要: 采用RT-PCR扩增获得鹅星状病毒(Goose astrovirus)的衣壳纤突蛋白基因vp27,并将其克隆至pCold-SUMO原核表达载体。重组表达载体pCold-vp27经过测序和双酶切验证正确后,转化到感受态细胞Rosetta。挑取阳性克隆子,利用异丙基硫代半乳糖苷诱导表达鹅星状病毒衣壳纤突重组蛋白,使用镍柱纯化衣壳纤突蛋白VP27,将定量的重组蛋白免疫BALB/c小鼠。利用ELISA、Western blot和IFA鉴定鼠抗衣壳纤突蛋白VP27多克隆抗体。结果显示,鼠抗衣壳纤突蛋白VP27多克隆抗体的效价大于1∶64 000,Western blot试验结果证明了鼠抗衣壳纤突蛋白VP27多克隆抗体的特异性,IFA试验结果证明鼠抗衣壳纤突蛋白VP27多克隆抗体能够识别天然的鹅星状病毒衣壳纤突蛋白VP27。
关键词: 鹅星状病毒;衣壳纤突蛋白VP27;多克隆抗体
中图分类号: S858.332.65+9.6 文獻标识码: A 文章编号: 1000-4440(2021)02-0412-06
Abstract: The vp27 gene of capsid spike protein of goose astrovirus was amplified by RT-PCR and cloned into prokaryotic expressional vector pCold-SUMO. The recombinant expressional vector pCold-vp27 was transformed into competent cell Rosetta after verified to be correct by sequencing and double enzyme digestion. The positive clones were selected, and the capsid spike recombinant protein of goose astrovirus was induced to express by isopropyl-β-D-thiogalactoside (IPTG). The capsid spike protein VP27 was purified by nickel column and quantitative recombinant protein was used to immune BALB/c mice. The polyclonal antibody against capsid spike protein VP27 in mice was identified by ELISA, Western blot and IFA. The results showed that the titer of polyclonal antibody against capsid spike protein VP27 in mice was higher than 1∶64 000. The specificity of polyclonal antibody against capsid spike protein VP27 in mice was proved by the testing results of Western blot. Results of IFA test proved that the polyclonal antibody against capsid spike protein VP27 in mice could recognize natural goose astrovirus capsid spike protein VP27.
Key words: goose astrovirus;capsid spike protein VP27;polyclonal antibody
星状病毒(Astrovirus)是一种单股正链无囊膜的RNA病毒,可以感染哺乳动物和禽类。在哺乳动物中,星状病毒通常感染人、猪[1]、狗[2]和牛[3]等,主要引起胃肠炎和腹泻,在极个别条件下会引起脑炎[4]。在禽类动物中,星状病毒感染主要发生在鸡、鸭、鹅和火鸡中,引起鸡肾炎[5]、鸭致死性肝炎[6]、火鸡肠炎[7]等临床常见疾病。近年来,在安徽、江苏、福建等省份流行一种由鹅星状病毒(Goose astrovirs)感染引起雏鹅痛风为主要特征的疾病[8]。鹅星状病毒主要感染21日龄左右的雏鹅,死亡率可达30%,给养鹅产业带来极大的经济损失。
目前鹅星状病毒的检测主要依赖于RT-PCR方法,没有商品化的试剂盒[9]。衣壳纤突蛋白VP27作为存在于鹅星状病毒表面的衣壳纤突蛋白,含有中和抗原表位,介导鹅星状病毒粒子与细胞表面受体结合[10]。相关研究结果表明,衣壳纤突蛋白VP27是鹅星状病毒主要的抗原决定蛋白[11]。本研究以本实验室分离的鹅星状病毒DY-19株为基础,构建鹅星状病毒衣壳纤突蛋白VP27原核表达载体,利用IPTG诱导表达和亲和层析柱纯化方法获得衣壳纤突蛋白VP27,免疫小鼠获得多抗血清,利用制备的多克隆抗体对感染新型鹅星状病毒的鸡肝癌细胞(Chicken liver hepatocellular carcinoma cell line,LMH)进行间接免疫荧光(Indirect immunofluorescence assay,IFA)检测,为鹅星状病毒早期检测方法的建立和应用以及后续研究奠定基础。
1 材料与方法
1.1 材料
DH5α和Rosetta大肠杆菌感受态细胞采购于通用公司,Solution Ⅰ、限制性内切酶BamH Ⅰ和Hind Ⅲ采购于宝日医生物技术(北京)有限公司,2×tap PCR Mix、质粒小提试剂盒、胶回收试剂盒购自天根公司,胎牛血清(Fetal bovine serum,FBS)购自Gibco公司,HRP标记的羊抗小鼠IgG和4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的羊抗小鼠IgG购自Solarbio公司,异丙基硫代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)购自biosharp公司,DMEM-F12培养基购自HyClone公司。LMH细胞系、pCold-SUMO载体、鹅星状病毒DY-19株(GenBank:MT708902)由本实验室分离和保存。BALB/c小鼠购自安徽医科大学实验动物中心。
1.2 方法
1.2.1 衣壳纤突蛋白基因vp27的RT-PCR扩增 根据鹅星状病毒DY-19株全基因序列(GenBank:MT708902),利用Primer Premier 5.0软件设计引物,扩增鹅星状病毒衣壳纤突蛋白基因vp27,扩增的衣壳纤突蛋白基因vp27片段大小为723 bp。同时在上、下游引物5′端分别添加BamHⅠ和HindⅢ酶切位点。vp27基因的引物序列如表1所示。
1.2.2 重组质粒pCold-vp27的构建 将胶回收的衣壳纤突蛋白基因vp27目的片段和pCold-SUMO质粒利用BamHⅠ和 HindⅢ限制性内切酶分别进行双酶切。反应总体系50 μl,其中10×K buffer 5 μl, BamHⅠ 2 μl, HindⅢ 2 μl,利用无菌去离子水补足。于37 ℃水浴锅酶切3 h,衣壳纤突蛋白基因vp27片段、pCold-SUMO質粒的酶切产物电泳后利用胶回收试剂盒分别进行回收。
将衣壳纤突蛋白基因vp27片段、pCold-SUMO质粒的胶回收产物进行连接,反应总体系10 μl:衣壳纤突蛋白基因vp27片段4 μl,pCold-SUMO质粒胶回收产物1 μl,Solution Ⅰ 5 μl。于16 ℃条件下连接4 h。吸取连接产物10 μl转化到感受态细胞Rosetta。利用pCold-SUMO载体的氨苄抗性进行筛选。在氨苄琼脂平板上挑取单个菌落进行PCR鉴定。对于PCR鉴定阳性的单个菌落摇菌提取质粒,利用BamHⅠ和 HindⅢ限制性内切酶进行双酶切鉴定,同时将质粒进行测序。鉴定正确后将重组质粒命名为pCold-vp27。
1.2.3 重组衣壳纤突蛋白VP27的诱导表达和纯化 将鉴定正确的重组质粒pCold-vp27转化到大肠杆菌Rosetta,挑取阳性菌落,进行IPTG浓度优化(终浓度0.5 mmol/L、1.0 mmol/L、1.5 mmol/L、2.0 mmol/L),16 ℃ 、120 r/min诱导24 h。收集菌体后,利用超声波细胞粉碎机破碎细菌,细菌破碎后8 000 r/min 离心10 min,分别保存重组星状病毒衣壳纤突蛋白上清液和沉淀。取星状病毒重组衣壳纤突蛋白质上清液和沉淀分别加入蛋白质上样缓冲液进行SDS-PAGE分析。
1.2.4 衣壳纤突蛋白VP27免疫及多克隆抗体制备 按照上述方法大量制备衣壳纤突蛋白VP27,以纯化定量后的衣壳纤突蛋白VP27为抗原免疫6周龄BALB/c雌性小鼠。免疫程序如下:第1次免疫,100 μl衣壳纤突蛋白VP27(100 μg)和100 μl的等体积弗氏完全佐剂完全混合后,皮下注射;14 d后进行第2次免疫,100 μl衣壳纤突蛋白VP27(100 μg)和100 μl的等体积弗氏不完全佐剂完全混合,皮下注射;第1次免疫后28 d进行第3次免疫,免疫方法与第2次免疫相同。第3次免疫后7 d,腹腔注射衣壳纤突蛋白VP27加强免疫,1只100 μg。应用ELISA方法测定其效价。
1.2.5 ELISA 检测多克隆抗体的效价 用碳酸盐缓冲液包被纯化后的衣壳纤突蛋白VP27(10 μg/ml),将包被好的衣壳纤突蛋白VP27加入96孔板,1孔100 μl,4 ℃包被过夜。第2 d早晨,弃掉96孔板中的衣壳纤突蛋白VP27包被液,用配制好的PBST洗涤3次,每次5 min,在室温条件下,用5%的脱脂奶粉溶液(50 g/L,PBST配制)封闭1 h,甩掉5%脱脂奶粉溶液,用PBST洗涤4次,在微量振荡器上振荡5 min,最后拍干确保孔内无PBST残留,然后用5%脱脂奶粉溶液稀释免疫小鼠的血清样品(1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000),8个稀释度,每孔100 μl稀释好的样品,对照组为未经免疫的小鼠血清,于37 ℃培养箱孵育2 h,甩掉稀释的血清样品,用PBST洗涤4次,在微量振荡器上振荡5 min,最后拍干确保孔内无PBST残留,然后将羊抗小鼠IgG-HRP按照1∶2 000进行稀释(稀释液为5%脱脂奶粉溶液),每孔加入100 μl,于37 ℃培养箱孵育1 h,甩掉孔内液体,用PBST洗涤4次,在微量振荡器上振荡5 min,最后拍干确保孔内无PBST残留,在室温条件下每孔加入100 μl TMB显色液,避光反应15 min,最后每孔加入100 μl硫酸溶液(2 mol/L)终止反应。使用酶标仪检测各孔样品吸光值A450。
1.2.6 Western blot鉴定衣壳纤突蛋白VP27多克隆抗体 将利用IPTG诱导的pCold-SUMO空载体和纯化浓缩后的衣壳纤突蛋白VP27经SDS-PAGE分离后转到PVDF膜上,50 g/L脱脂奶粉溶液(PBS配制)37 ℃培养箱封闭1 h,用配制的TBST洗涤3次,每次10 min,一抗为1∶200稀释的鼠血清(PBS稀释),于37 ℃培养箱孵育1 h,然后用配制的TBST缓冲液洗涤PVDF膜3次,每次10 min;二抗为1∶2 000稀释的带HRP标记的羊抗小鼠IgG(PBS稀释),然后用配制的TBST缓冲液洗涤PVDF膜3次,每次10 min,最后用DAB试剂盒显色观察。
1.2.7 IFA鉴定衣壳纤突蛋白VP27多克隆抗体 将处理好的LMH细胞均匀铺到6孔板,待其密度达到80%以上,3孔接种鹅星状病毒DY-19,剩余3孔为对照组,使用DMEM-F12培养基代替鹅星状病毒。鹅星状病毒感染LMH细胞72 h后,用移液枪弃掉维持液,然后沿着侧壁加入PBS洗涤3次,每次5 min,每孔加入2 ml 5%脱脂奶粉溶液(PBS配制)封闭液,37 ℃培养箱封闭1 h,然后沿着侧壁加入PBS洗涤3次,每次5 min。一抗为1∶200稀释的制备的抗鹅星状病毒衣壳纤突蛋白VP27多克隆抗体(PBS配制),37 ℃培养箱孵育1 h,然后沿着侧壁加入PBS洗涤3次,每次5 min;二抗为1∶1 000稀释的带FITC标记的羊抗小鼠IgG,37 ℃培养箱孵育1 h,然后沿着侧壁加入PBS洗涤3次,每次5 min,加入1 ml 1∶1 000稀释的DAPI(PBS配制)溶液,37 ℃培养箱孵育10 min,然后沿着侧壁加入PBS洗涤3次,每次5 min,最后加入600 μl PBS,置于荧光倒置显微镜下进行观察。
2 结果
2.1 衣壳纤突蛋白基因vp27的RT-PCR扩增
以制备的鹅星状病毒 DY-19的cDNA为模板,进行衣壳纤突蛋白基因vp27扩增。衣壳纤突蛋白基因vp27扩增目的条带大小在723 bp左右,与预期结果相符(图1)。
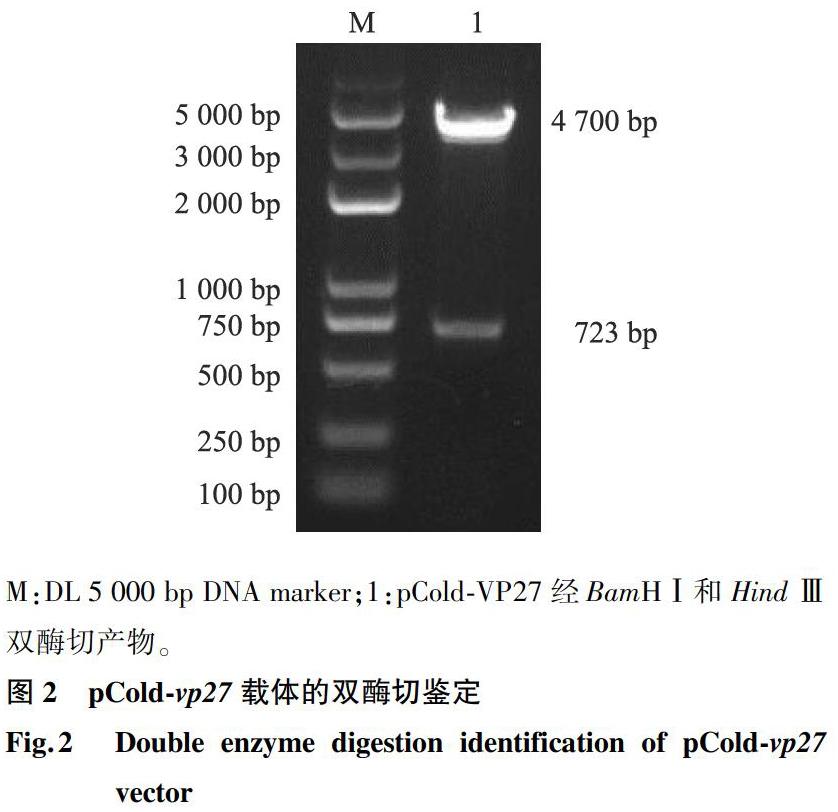
2.2 重组质粒pCold-vp27鉴定
构建的重组质粒pCold-vp27经BamHⅠ和 Hind Ⅲ限制性内切酶双酶切,得到了723 bp的目的基因片段和4.7 kb的pCold-SUMO载体片段,与预期大小相符(图2)。
2.3 衣壳纤突蛋白VP27的表达、鉴定和纯化
将转入重组质粒pCold-vp27的表达菌Rosetta培养至A600=0.6~0.8,用4个不同浓度(0.5 mmol/L、1.0 mmol/L、1.5 mmol/L、2.0 mmol/L)的IPTG诱导,16 ℃、120 r/min诱导表达24 h。SDS-PAGE结果显示,在相对分子质量约为43 000处出现特异性条带(图3),选择终浓度1 mmol/L的IPTG进行蛋白质表达。未经诱导的pCold-vp27无目的条带。可溶性分析结果表明衣壳纤突蛋白VP27在沉淀和上清液中均可表达。收集破碎离心后上清液利用亲和层析法纯化衣壳纤突蛋白VP27。
2.4 衣壳纤突蛋白VP27多克隆抗体的效价
第4次加强免疫后7 d,采集并分离小鼠血清,用ELISA方法检测血清中衣壳纤突蛋白VP27多克隆抗体的效价。结果表明制备的鼠抗衣壳纤突蛋白VP27血清效价大于1∶64 000(图4),衣壳纤突蛋白VP27经 4 次免疫小鼠后诱导机体产生了抗衣壳纤突蛋白VP27特异性多克隆抗体。
2.5 衣壳纤突蛋白VP27多克隆抗体的Western blot法鉴定
以经IPTG诱导的pCold-SUMO空载体和纯化后的衣壳纤突蛋白VP27为抗原,免疫小鼠后获得的血清为一抗,二抗为带HRP标记的羊抗小鼠IgG。结果显示,经IPTG诱导的pCold-SUMO空载体组无明显条带,衣壳纤突蛋白VP27在相对分子质量43 000处有一条明显的条带(图5)。证明制备的衣壳纤突蛋白VP27多克隆抗体特异性良好。
2.6 衣壳纤突蛋白VP27多克隆抗体的IFA鉴定
将衣壳纤突蛋白VP27多克隆抗体应用于病毒的 IFA 检测,结果表明制备的衣壳纤突蛋白VP27多克隆抗体可以识别天然的衣壳纤突蛋白VP27,感染鹅星状病毒的LMH细胞质中检测到明显的荧光信号,未感染鹅星状病毒的LMH细胞中未检测到荧光信号(图6)。表明制备的衣壳纤突蛋白VP27多克隆抗体可以应用于病毒的IFA检测。
3 讨论
1975年,星状病毒首次在婴儿粪便中被发现,因其在透射电子显微镜下具有特征性的五角星结构,故将其命名为星状病毒[12]。随着现代分子生物学和病原检测技术的发展,越来越多的星状病毒在哺乳动物和鸟类动物中被发现[13-15]。导致动物腹泻的主要病原体之一就是星状病毒,同时星状病毒还会感染机体的其他组织脏器,导致雏鸭致死性肝炎、鸡肾炎和哺乳动物脑炎等[16]。鹅星状病毒感染雏鹅,主要引起雏鹅的内脏器官、腿部关节乃至腿部肌肉出现尿酸盐沉积,给养鹅产业造成巨大的经济损失[17-18]。
目前,鹅星状病毒的检测方法主要是RT-PCR方法[19],包括鹅星状病毒SYBR Green I荧光定量检测[20]和鹅星状病毒TaqMan 荧光定量检测[21]。RT-PCR方法主要采集发病或者病死雏鹅的部分组织器官,提取核酸进行检测,不适合在临床上进行大规模检测。建立一种基于衣壳纤突蛋白VP27的ELISA检测方法,应用于临床上大规模检测尤为迫切。
衣壳纤突蛋白VP27为存在于鹅星状病毒粒子表面的蛋白质。相关研究结果表明,鹅星状病毒衣壳纤突蛋白VP27是鹅星状病毒的主要抗原决定蛋白,参加鹅星状病毒粒子与细胞内外受体的结合。因此,衣壳纤突蛋白VP27可以作为疾病检测和疫苗研制的靶点[22]。本研究通过构建pCold-vp27原核质粒,利用大肠杆菌Rosetta表达系统,优化蛋白质表达条件(IPTG浓度),获得高效表达的衣壳纤突蛋白VP27。将衣壳纤突蛋白VP27纯化定量后与弗氏佐剂混合,免疫小鼠,经Western blot 法检测证明抗衣壳纤突蛋白VP27多克隆抗体血清的特异性良好,与对照组无特异性反应。同时应用间接ELISA方法检测制备的鼠抗衣壳纤突蛋白VP27多克隆抗體效价大于1∶64 000。使用感染鹅星状病毒DY-19的LMH 细胞对多克隆抗体使用IFA法进行鉴定,感染鹅星状病毒的LMH细胞中有明显的绿色荧光,而未感染鹅星状病毒的LMH细胞无荧光,证明制备的抗体特异性非常好,可以特异性识别天然的衣壳纤突蛋白VP27。综上所述,制备的鼠抗衣壳纤突蛋白VP27可以用于临床鹅星状病毒的检测和实验室中鹅星状病毒特性研究以及致病机制研究。
参考文献:
[1] FANG Q, WANG C, LIU H, et al. Pathogenic characteristics of a porcine astrovirus strain isolated in China [J]. Viruses, 2019, 11(12): 1156.
[2] TAKANO T, TAKASHINA M, DOKI T, et al. Detection of canine astrovirus in dogs with diarrhea in Japan [J]. Archives of Virology, 2015, 160(6): 1549-1553.
[3] BOUJON C L, KOCH M C, KAUER R V, et al. Novel encephalomyelitis-associated astrovirus in a muskox (Ovibos moschatus): a surprise from the archives [J]. Acta Veterinaria Scandinavica, 2019, 61(1): 31.
[4] KOUKOU G, NIENDORF S, HORNEI B, et al. Human astrovirus infection associated with encephalitis in an immunocompetent child: a case report [J]. Journal of Medical Case Reports, 2019, 13(1): 960-964.
[5] IMADA T, YAMAGUCHI S, MASE M, et al. Avian nephritis virus (ANV) as a new member of the family Astroviridae and construction of infectious ANV cDNA [J]. Journal of Virology, 2000, 74(18): 8487-8493.
[6] LIU N, WANG F, SHI J, et al. Molecular characterization of a duck hepatitis virus 3-like astrovirus [J]. Veterinary Microbiology, 2014, 170(1/2): 39-47.
[7] JINDAL N, PATNAYAK D P, CHANDER Y, et al. Comparison of capsid gene sequences of turkey astrovirus-2 from poult-enteritis-syndrome-affected and apparently healthy turkeys [J]. Archives of Virology, 2011, 156(6): 969-977.
[8] CHEN Q, XU X, YU Z, et al. Characterization and genomic analysis of emerging astroviruses causing fatal gout in goslings [J]. Transboundary and Emerging Diseases, 2020, 67(2): 865-876.
[9] WAN C, CHEN C, CHENG L, et al. Specific detection of the novel goose astrovirus using a TaqMan real-time RT-PCR technology [J].Microbial Pathogenesis, 2019, 137: 103766.
[10]AGUILAR-HERNANDEZ N, LOPEZ S, ARIAS C F. Minimal capsid composition of infectious human astrovirus [J]. Virology, 2018, 521: 58-61.
[11]張清水. 新发肾致病型鹅星状病毒的分离鉴定及弱毒株选育[D].北京:中国农业大学,2019.
[12]LOMBARDI G H, ROSETO A M, STAMBOULIAN D, et al. Letter: Virus of infantile gastroenteritis in argentina [J]. The Lancet, 1975, 2(7948): 1311.
[13]PANKOVICS P, BOROS A, KISS T, et al. Detection of a mammalian-like astrovirus in bird, European roller (Coracias garrulus) [J].Infection, Genetics and Evolution, 2015, 34: 114-121.
[14]ZHANG H H, QIU Q G, LIU S J, et al. Genomic characterization of a novel astrovirus identified in Amur tigers from a zoo in China [J].Archives of Virology, 2019, 164(12): 3151-3155.
[15]章丽娇,黄欣梅,刘 飞,等. 新型鹅星状病毒AHQJ18株的分离鉴定[J].江苏农业学报,2019,35(5):1262-1264.
[16]OLORTEGUI M P, ROUHANI S, YORI P P, et al. Astrovirus infection and diarrhea in 8 countries [J]. Pediatrics, 2018, 141(1): e20171326.
[17]WANG Y, BAI C, ZHANG D, et al. Genomic and phylogenetic characteristics of a novel goose astrovirus in Anhui province, Central-Eastern China [J]. Gene, 2020, 756: 144898.
[18]ZHANG X, REN D, LI T, et al. An emerging novel goose astrovirus associated with gosling gout disease, China [J]. Emerging Microbes & Infectionst, 2018, 7(1): 1-8.
[19]司振书,殷国政,路建彪,等.H9N2亚型AIV双重RT-PcR检测方法的建立[J].江苏农业科学,2019,47(7):35-37.
[20]白彩霞,张 达,赵 靓,等. 鹅星状病毒SYBR Green I荧光定量RT-PCR方法的建立 [J]. 江苏农业学报,2020,36(3): 634-638.
[21]YIN D, YANG J, TIAN J, et al. Establishment and application of a TaqMan-based one-step real-time RT-PCR for the detection of novel goose-origin astrovirus [J]. Journal of Virological Methods, 2020, 275: 113757.
[22]ROYUELA E. Molecular cloning, expression and first antigenic characterization of human astrovirus VP26 structural protein and a C-terminal deleted form [J]. Comparative Immunology, Microbiology and Infectious Diseases, 2010, 33(1): 1-14.
(责任编辑:张震林)
