猪舍细颗粒物促进猪原代肺泡巨噬细胞向M1极化
2021-06-30沈家鲲崔洋洋金晓明李延森李春梅
沈家鲲,唐 倩,崔洋洋,金晓明,李延森,李春梅
(南京农业大学动物科技学院 家畜环境控制与智慧生产研究中心,南京 210095)
猪舍空气颗粒物是猪呼吸道疾病发生的重要原因之一,也是疾病传播的重要媒介[1]。高密度、集约化的养猪生产导致猪舍空气污染物浓度增加,造成猪群呼吸道疾病多发,严重影响养猪生产。其中,细颗粒物(fine particulate matter,PM2.5)因粒径小,表面积大,易吸附携带更多有害物质,且可直接进入肺泡,危害最大[2]。研究表明,高浓度猪舍PM2.5会导致小鼠体重下降,肺组织出现病理损伤和炎症[3]。肺泡巨噬细胞是肺内游离的免疫细胞,主要分布于肺泡表面,是肺抵御外源物质入侵的第一道防线,对维持肺部健康稳态具有重要作用[4]。课题组前期研究发现,猪舍PM2.5能够诱导猪肺泡巨噬细胞(porcine alveolar macrophages,PAMs)发生炎症反应,激活NLRP3炎性小体,引发细胞凋亡[5]。研究结果提示,猪舍PM2.5可诱发猪肺部炎症损伤。
巨噬细胞具有高度的可塑性,能够根据不同的微环境而改变自身表型[6]。根据激活方式的不同,可将巨噬细胞分为M1和M2型。M1型巨噬细胞可由脂多糖(lipopolysaccharide,LPS)、干扰素γ(interferon-γ,IFN-γ)或肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)激活,这类巨噬细胞可分泌较高水平的促炎因子,如TNF-α、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)等[7]。同时,也可产生单核细胞趋化因子-1(monocyte chemotactic protein-1,MCP-1)等趋化因子,并通过趋化性吸引Th1细胞,促进强烈的Th1免疫反应。此外,M1型巨噬细胞还高表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2),并产生大量活性氧(reactive oxygen species,ROS)和一氧化氮(nitric oxide,NO)[8]。M2型巨噬细胞可由白介素-4(interleukin-4,IL-4)、白介素-10(interleukin-10,IL-10)、白介素-13(interleukin-13,IL-13)、糖皮质类激素等诱导产生,主要发挥抗炎作用,具有促进损伤修复和组织再生的功能。M2型巨噬细胞可分泌高水平的抗炎因子,如IL-10、IL-4、转化生长因子-β(transforming growth factor-β,TGF-β);低表达促炎因子,包括IL-12、IL-1β、 TNF-α等,同时也可增强精氨酸酶活性,缓解炎症反应[9]。生物体内的巨噬细胞,在功能和活性上都介于M1型和M2型之间[10]。在具体的微环境中,巨噬细胞会根据微环境的变化不断进行着表型间的转换,维持一种动态平衡状态,任何影响巨噬细胞M1/M2极化稳态的因素都可能导致机体发生炎症或疾病[11]。
PAMs是研究猪肺部炎症与免疫的重要细胞模型,是猪肺炎支原体、猪繁殖与呼吸综合征病毒等病原微生物感染的重要靶细胞[12-13]。本课题组前期研究发现,猪舍PM2.5诱导PAMs发生炎症反应[5],但PM2.5是否影响PAMs的极化尚不清楚。因此,本研究旨在通过建立原代PAMs模型,研究猪舍PM2.5对原代PAMs的细胞活力、NO分泌量、精氨酸酶活性,以及炎症因子和极化表型标志物的mRNA表达水平的影响,探究PM2.5对原代PAMs极化的影响。
1 材料与方法
1.1 材料
原代PAMs分离自140日龄杜×大×长三元杂交猪;特氟龙滤膜购自Whatman公司;基础培养基RPMI 1640和胎牛血清购自BI公司;青霉素-链霉素-两性霉素B三抗购自Sigma公司;红细胞裂解液、DAPI和Alexa Fluor488标记的山羊抗小鼠IgG二抗购自碧云天公司;小鼠F4/80抗体购自Servicebio公司;0.01 mol·L-1PBS、牛血清白蛋白(BSA)和Triton X-100购自北京索莱宝有限公司;多聚甲醛固定液购自Biosharp公司;细胞活力试剂盒、Diff-quik试剂盒和一氧化氮试剂盒均购自南京建成生物技术有限公司;Tris-HCl、硫酸和磷酸购自国药试剂公司;氯化锰、尿素和L-精氨酸购自源叶公司;α-异亚硝基苯丙酮购自安耐吉化学公司;总RNA提取试剂盒和反转录试剂盒(HiScript Ⅱ Q RT SuperMix)购自诺唯赞公司;荧光定量试剂盒(2×T5 Fast qPCR Mix SYBR Green I)购自擎科公司。
1.2 PAMs分离与培养
猪屠宰放血后,用消毒过的棉线结扎主气管(防止血液进入气管),分离猪肺。用预冷的PBS清洗肺表面后,开放主气管,用含0.5%三抗的PBS灌洗猪肺。每次灌洗50 mL,停留2 min,回收肺泡灌洗液,反复3~4次,回收后的灌洗液4 ℃保存,并在24 h内完成PAMs提取。将4 ℃保存的肺泡灌洗液,于100目无菌不锈钢筛过滤,过滤后的液体分装,2 000 r·min-1离心10 min,弃上清,保留沉淀,加入红细胞裂解液1~2 mL,37 ℃裂解红细胞5 min。 裂解完成后2 000 r·min-1离心10 min,留沉淀,用1~2 mL无血清的RPMI 1640重悬,计数。按每孔1×106个细胞接种于6孔板,每孔3×105个细胞接种于24孔板,每孔1×105个细胞接种于96孔板,接种完成后,37 ℃、5% CO2培养4 h,弃去培养液,PBS洗涤3次,贴壁的细胞即为PAMs,换成完全培养基继续培养。
1.3 PM2.5的采集与提取
PM2.5的采集方法详见先前的研究[5],将采样器置于集约化猪舍中,采样器流量为16.67 L·min-1,PM2.5样本被采集在直径为47 mm的特氟龙滤膜上。每天采集PM2.5样本23 h,从早上7:00至第二天早上6:00,采集样本于-20 ℃保存。采集后的滤膜加入超纯水,经超声波振荡后,用6层无菌纱布过滤,过滤后悬浊液于12 000 r·min-1离心40 min,保留沉淀。经冷冻干燥后,在干燥器内室温平衡6 h后,加入一定量的生理盐水,配制成1 mg·mL-1的母液,并高压灭菌后于4 ℃保存,用以处理细胞。
1.4 试验设计与处理
试验分为对照组和PM2.5组(50 μg·mL-1),PM2.5浓度的选择参照课题组先前的研究[5]。纯化后的细胞先培养24 h,PM2.5组细胞用含5%PM2.5母液的完全培养基(PM2.5终浓度为50 μg·mL-1)再培养4、8和12 h,对照组细胞用含有5%生理盐水的完全培养基培养4、8和12 h,两组每个时间均设置3个重复,处理结束后收集相应的细胞上清和细胞用于指标检测。
1.5 细胞形态观察和活力测定
细胞纯化后,先培养24 h,之后每24 h用倒置相差显微镜观察记录细胞形态变化和生长状态,并测定细胞活力。96孔板内的细胞添加不同处理后,培养不同时间,到达设定的时间后,按MTT试剂盒说明书方法测定细胞活力。
1.6 PAMs的鉴定
1.6.1 Diff-quik染色 纯化前的肺泡灌洗液采用涂片法制作涂片,室温风干。接种PAMs于6孔 培养板细胞爬片上,纯化后,培养24 h,弃去培养液,PBS洗涤3次,室温风干。参考黄燕霞等[14]方法,按照Diff-quik试剂盒进行染色。主要步骤:风干后的爬片于Reagent 1内固定10 s,Reagent 2内染色10 s,甩去多余液体,放入Reagent 3中染色10 s, 取出爬片,放入清水中洗去多余的染液,无水乙醇脱水2次,每次10 s,待干后,放入二甲苯中透明10 s,中性树脂封片,镜检。
1.6.2 F4/80免疫荧光标记 F4/80为巨噬细胞膜表面蛋白,是巨噬细胞标志之一[15]。接种PAMs于6孔培养板细胞爬片上,纯化后,培养24 h,弃去培养液,PBS洗涤3次,加入4%多聚甲醛固定30 min,接着PBS洗涤3次,每个爬片加入100 μL的0.5% TritonX-100通透10 min后,PBS洗涤3次。每孔加入1 mL含1% BSA的PBS,室温封闭1 h,弃去封闭液。用含1% BSA的PBS按1∶100稀释一抗(小鼠F4/80单抗),每个爬片上加入100 μL的一抗,37 ℃孵育1 h,弃去一抗,PBS洗涤3次。再用含1% BSA的PBS按1∶200稀释二抗(Alexa Fluor 488标记的山羊抗小鼠IgG),37 ℃避光孵育10 min。 每孔加入50 μL的DAPI,室温避光孵育10 min, 弃去DAPI,PBS洗涤3次。在干净的载玻片上滴加5 μL的抗淬灭剂,将爬片取出倒扣在载玻片上,激光共聚焦显微镜观察。
1.7 巨噬细胞NO含量的测定
细胞处理后收集PAMs的细胞上清,2 500 r·min-1离心10 min,收集上清,按照NO试剂盒说明书方法测定NO含量,550 nm测定吸光度,计算细胞上清中的NO含量。
1.8 细胞内精氨酸酶活性的测定
参考Corraliza等[16]的方法,将处理后的细胞先用PBS洗涤2次,加入100 μL 0.1%Triton X-100,室温裂解30 min,再加入100 μL 的50 mmol·L-1Tris-HCl和10 mmol·L-1MnCl2,56 ℃温育10 min。加入100 μL 的0.5 mol·L-1精氨酸(pH 9.7),37 ℃ 水解精氨酸60 min。加入900 μL H2SO4(96%)/H3PO4(85%)/H2O(1/3/7)终止反应。加入40 μL的9% α-异亚硝基苯乙酮(溶于100%乙醇),95 ℃避光,温育30 min。以尿素为标品建立标准曲线,在540 nm下测定吸光度,计算样品的尿素浓度。每分钟催化产生1 μmol尿素为酶的一个活性单位IU。
1.9 炎症因子与极化表型相关基因的RT-PCR分析
用PBS洗涤6孔板里的细胞2次,利用总RNA提取试剂盒提取细胞总RNA,用Nanodrop®2000测定RNA浓度和纯度,并使用HiScript II Q RT SuperMix将RNA反转录为cDNA,-20 ℃保存。按照2× T5 Fast qPCR Mix SYBR Green I试剂盒说明书操作反应进行。反应体系:T5 Fast qPCR Mix(2×)10 μL, 上、下游引物(10 μmol·L-1)各0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA模板2 μL,ddH2O 4 μL,总体积为20 μL。使用QuantStudio®5 Real-Time PCR进行实时荧光定量反应检测,设置反应条件:95 ℃预变性1 min;95 ℃变性10 s,60 ℃ 退火延伸15 s,共40个循环;熔解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s。每个RT-PCR均进行3个重复。使用2-△△Ct法以β-actin为内参基因测定相对mRNA表达水平。表1为细胞因子和极化标志物相关基因的引物序列。

表1 RT-PCR引物信息
1.10 数据统计与分析
试验结果用“平均值±标准误(SEM)”表示。采用Graphpad Prism 8.0(CA,USA)对数据进行分析,采用独立样本t检验和单因素方差分析(ANOVA)中的Tukey多重比较法对数据进行比较分析,P<0.05则认为这些差异显著,P<0.01则认为差异极显著。
2 结 果
2.1 PAMs的形态观察与活力测定
如图1A所示,分离得到的PAMs呈圆形,大小不等。纯化后,大部分细胞完全贴壁生长,在培养24~48 h内,细胞无明显死亡现象,细胞逐渐发生变形,呈现为圆形、椭圆形或梭形等形状。培养72 h后,一部分细胞出现死亡脱落。PAMs的细胞活力随着培养时间的延长逐渐降低(P<0.05,图1B),适宜的细胞处理时间应在纯化后培养48 h内。

A. PAMs的形态学观察,标尺=100 μm。B. PAMs的活力测定,n=3。柱形图顶部不同小写字母表示差异显著(P<0.05)
2.2 PAMs的鉴定
如图2A所示,纯化前的猪肺泡灌洗液中含有多种细胞成分,除PAMs外,还有大量红细胞和细胞碎片。纯化后的细胞可以清晰看出,PAMs呈紫色,大小不均一,呈圆形或椭圆形等形状,细胞核较大,多偏向一侧,细胞中偶尔可见2个细胞核,细胞质呈微嗜碱性,染成浅蓝色。免疫荧光结果显示(图2B), 分离纯化后细胞带有F4/80标记的均为PAMs。

A. Diff-quik染色。B. F4/80鉴定,F4/80-:未孵育F4/80抗体,F4/80+:孵育F4/80抗体
2.3 猪舍PM2.5对PAMs活力的影响
细胞活力测定结果显示(图3),与对照组相比,PM2.5处理4、8 和12 h,PAMs的活力均没有显著变化(P>0.05),表明PM2.5的短时间处理对PAMs的活力无明显影响。
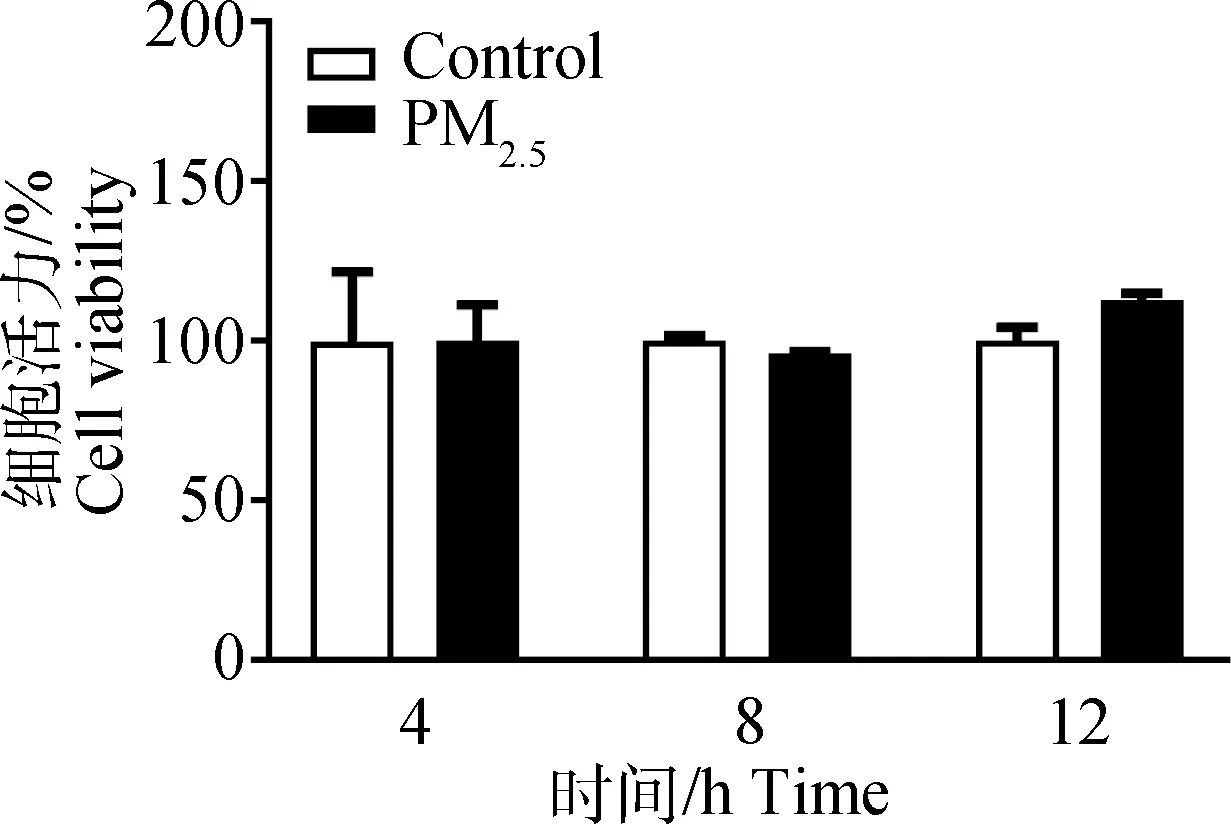
柱形图顶部未标注者表示与对照组相比差异不显著(P>0.05),下同,n=3
2.4 猪舍PM2.5对PAMs精氨酸代谢关键酶活性的影响
用PM2.5处理细胞4、8和12 h,PAMs分泌的NO量随时间增加而增多,在4和12 h,PM2.5处理组PAMs分泌的NO量显著高于对照组(P<0.05,图4A)。PAMs的精氨酸酶活性随时间增加而降低,与对照组相比,PM2.5处理4、8和12 h均极显著降低PAMs精氨酸酶的活性(P<0.01,图4B)。

A. NO测定。B. 精氨酸酶活性测定。*.P<0.05和**.P<0.01表示PM2.5组与对照组相比差异显著,下同,n=3
2.5 猪舍PM2.5对PAMs炎症因子表达水平的影响
如结果所示,与对照组相比,PM2.5处理不同时间均可提高PAMsIL-1β(图5A)和TNF-α(图5B)的mRNA表达水平,且呈时间依赖性增加,并在8和12 h差异显著(P<0.01)。此外,与对照组相比,PM2.5处理8 h,显著降低PAMs抗炎因子IL-10 mRNA表达水平(P<0.05,图5C)。
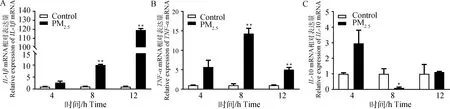
A. RT-PCR检测PM2.5处理后不同时间IL-1β的相对表达量。B. RT-PCR检测PM2.5处理后不同时间TNF-α的相对表达量。C. RT-PCR检测PM2.5处理后不同时间IL-10的相对表达量,n=3
2.6 猪舍PM2.5对PAMs的M1及M2型巨噬细胞标志物表达的影响
与对照组相比,PM2.5处理4 h时,M1型巨噬细胞标志物CD80 mRNA表达水平显著提高(P<0.01,图6A)。另外,与对照组相比,PM2.5处理8 h显著降低M2型巨噬细胞标志物CD206 mRNA表达水平(P<0.01,图6B)。

A. RT-PCR检测PM2.5处理后不同时间CD80的相对表达量。B. RT-PCR检测PM2.5处理后不同时间CD206的相对表达量,n=3
3 讨 论
肺泡灌洗液中的主要成分是巨噬细胞,一般占肺泡灌洗液细胞的90%以上[17]。目前,通过肺泡灌洗液提取原代肺泡巨噬细胞的方法已得到广泛应用。综合前人研究发现,利用不同细胞在无血清培养基中的贴壁时间不同这一特点[18-20],通过差速离心贴壁法可以分离纯化获得PAMs。本试验也采用差速离心贴壁法从猪肺泡灌洗液中分离纯化获得PAMs,并通过观察细胞形态和Diff-quik染色及F4/80免疫荧光标记的方法对PAMs进行鉴定,证实这一方法的有效性。从肺泡灌洗液中分离提取细胞时,一定要注意避免血液污染,一旦有大量的血液混入肺泡灌洗液,容易导致红细胞裂解不完全,并易造成污染。另外,肺泡灌洗液中可添加0.5%的三抗(青霉素-链霉素-两性霉素B),这样可以有效避免分离提取操作时的二次污染。本研究结合已有的研究,进一步完善了原代PAMs的分离提取方法。本试验结果表明,分离提取的PAMs在培养过程中没有出现明显的增殖现象,在培养72 h后细胞数量可以看到明显的减少,这也是原代巨噬细胞培养一直令人困扰的问题。有研究报道,巨噬细胞属于终末分化细胞,不会增殖[20],但在特殊条件下,巨噬细胞也可能会发生增殖[21]。因此,在细胞活力较为稳定的时间点对细胞进行试验处理,可以有效避免因原代细胞脱落死亡而造成的对试验结果的影响。
猪舍PM2.5表面含有大量的LPS和金属离子等,这些都是诱发巨噬细胞发生炎症反应的重要因素[22-23]。当清除PM2.5中LPS后,PM2.5诱导的炎症反应会减轻[24]。先前的研究证实,猪舍PM2.5可通过TLR4/MAPK/NK-κB信号通路激活PAMs,提高NLRP3炎性小体蛋白水平,诱发IL-1β、IL-18、TNF-α和COX-2表达提高[5]。在本研究中,原代PAMs在处理PM2.5后,同样发现促炎因子的高表达,这与前期的研究结果一致。此外,本试验发现,抗炎因子IL-10的表达水平在一定程度上受到抑制,这与M1型巨噬细胞中抗炎因子低表达相似[9, 25]。
精氨酸代谢的差异是M1型和M2型巨噬细胞的主要代谢差异。iNOS在M1型巨噬细胞内高表达,分解精氨酸为瓜氨酸和NO,在机体抵御细胞内病原体感染中起到重要作用,M2型巨噬细胞分泌的精氨酸酶Ⅰ (arginase Ⅰ,Arg-1)可以与iNOS竞争性地结合底物精氨酸,分解精氨酸为鸟氨酸和尿素[26]。正常情况下,iNOS与Arg-1的表达和活性在巨噬细胞中受到严格调控,两者的动态平衡在维持巨噬细胞功能稳定中发挥重要作用[27]。PM2.5处理小鼠巨噬细胞,产生大量NO,同时,精氨酸酶活性降低[28]。本试验中,在PM2.5处理下,PAMs产生的NO含量明显增加,而精氨酸酶的活性显著下降,这与前人研究结果相似。本研究表明,PM2.5处理改变了肺泡巨噬细胞精氨酸代谢关键酶的活性,促进肺泡巨噬细胞向M1型转变。本课题组前期研究发现,猪舍空气PM2.5中的LPS含量高达(681.80±19.47) EU·mg-1,远远高于大气PM2.5中的LPS含量[5]。另外,由于LPS已是公认的M1型巨噬细胞激活剂[29],因此推测,PM2.5诱导的PAMs极化可能与PM2.5高含量的LPS有关。CD80是M1型巨噬细胞的标志物之一,CD206又称甘露糖受体,是M2型巨噬细胞的标志物之一[30]。为进一步证实PM2.5引发PAMs的极化,本研究进一步检测了M1和M2型巨噬细胞标志物的表达情况。研究发现,CD80 mRNA表达水平在PM2.5短期处理(4 h)时显著上升,而CD206 mRNA表达水平在8 h处理时显著下降。这些结果表明,PM2.5很可能诱导了巨噬细胞从M2向M1的转化,破坏了巨噬细胞M1/M2的平衡,进而促进炎症的发生。
巨噬细胞M1/M2的平衡对肺部健康至关重要。在通常情况下,当机体受到细菌感染,巨噬细胞会向M1极化,启动急性感染期的炎症反应,清除病原菌。炎症反应后期,巨噬细胞向M2极化,释放抗炎因子,促进组织修复。巨噬细胞极化的平衡在哮喘[31]和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)[32]中具有重要的作用,通过调控巨噬细胞极化的方向,成为COPD等炎症性肺部疾病治疗的新策略[33]。有研究表明,高浓度的PM2.5暴露会进一步加重哮喘小鼠气道炎症[34]。此外,PM2.5浓度的升高也会加剧COPD引发的炎性反应,诱发疾病的发生[35-36]。本试验发现,PM2.5处理破坏了PAMs的极化平衡,加剧炎症反应。因此,PM2.5加剧呼吸道疾病可能与改变巨噬细胞极化有关。猪长期处于高浓度PM2.5环境,PAMs的极化失衡可能会增加猪呼吸道疾病发生率,进一步影响猪呼吸道疾病的转归。
4 结 论
综上所述,猪舍来源的PM2.5在体外破坏了PAMs的M1/M2平衡,这种改变随时间的延长而加深,并促进巨噬细胞分泌高水平的NO和炎症因子,表明PM2.5在体外能够促进巨噬细胞向M1极化,加剧炎症反应。体外分离培养的原代PAMs能够较好地模拟PM2.5对肺泡微环境的影响,为后续研究微生物和病原菌等对PAMs的影响提供借鉴。
